Általános bevezetés
A legtöbbünk tudja, hogy az élesztő egy nagyon hasznos szervezet, különösen a sütés, a borkészítés és a sörfőzés tekintetében. Azonban mik is azok az élesztők, és miért állnak olyan sok kutatás középpontjában?

Az élesztők gombák
Az élesztők egysejtű mikroorganizmusok, amelyeket a penészgombákkal és a gombákkal együtt a Gombák birodalmába sorolunk. Az élesztők evolúciósan sokfélék, ezért két különálló törzsbe, az Ascomycota vagy zsákgombákba és a Basidiomycota vagy magasabb rendű gombákba sorolják őket, amelyek együttesen a Dikária albirodalmat alkotják. A bimbós élesztők, más néven “valódi élesztők” az Ascomycota törzs és a Saccharomycetales rend tagjai. Ezek az osztályozások a sejt, az aszkospóra és a telep jellemzőin, valamint a sejtfiziológián alapulnak.
Az élesztők egysejtűek, de a magasabb rendű szervezetekhez hasonló sejtszervezettel rendelkeznek
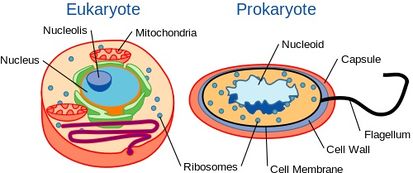
Az élesztők ugyan egysejtűek, mégis hasonló sejtszerveződéssel rendelkeznek, mint a magasabb rendű szervezetek, köztük az ember. Pontosabban, genetikai tartalmukat egy sejtmag tartalmazza. Ez eukarióta szervezetek közé sorolja őket, ellentétben egysejtű társaikkal, a baktériumokkal, amelyeknek nincs sejtmagjuk, és prokariótáknak számítanak.
természetes élőhelyek
Az élesztők széles körben elterjedtek a természetben, és sokféle élőhelyük van. Általában növényi leveleken, virágokon és gyümölcsökön, valamint a talajban találhatók. Az élesztők a bőr felszínén és a melegvérű állatok bélrendszerében is megtalálhatók, ahol szimbiózisban vagy parazitaként élhetnek. A gyakori “élesztőgombás fertőzést” jellemzően a Candida albicans okozza. Amellett, hogy a Candida a hüvelyi élesztőgombás fertőzések kórokozója, a pelenkakiütés és a száj- és torokgyulladás okozója is.
Miért tanulmányozzuk az élesztőt?
Képzeljünk el egy olyan organizmust, amely gyorsan növekszik egy lombikban, és amelynek DNS-e könnyen manipulálható, ugyanakkor betekintést nyújt az alapvető emberi biológiai folyamatokba, beleértve a betegségeket is. Az élesztő megfelel ennek a leírásnak, és világszerte a kutatók tanulmányozásának középpontjában áll, aminek eredményeképpen több mint 50 000 megjelent tudományos cikk írja le az élesztők kutatását!

Milyen sajátos tulajdonságai teszik az élesztőt a tanulmányozás “modellorganizmusává” és oly sok kutatás középpontjává? Az élesztők egysejtű (egysejtű) szervezetek, így egyszerűen tanulmányozhatók, de a magasabb, többsejtű szervezetekhez, például az emberhez hasonló sejtszerveződéssel rendelkeznek – vagyis rendelkeznek sejtmaggal, tehát eukarióták, ahogy fentebb leírtuk. A legfontosabb, hogy az élesztők és a magasabb eukarióták sejtes szerveződésének hasonlósága az alapvető sejtfolyamatok hasonlóságát is jelenti, így az élesztőkben végzett felfedezések gyakran adnak közvetlen vagy közvetett támpontokat arra vonatkozóan, hogyan működnek a biológiai folyamatok az emberben.

Az élesztők másik fontos tulajdonsága, amely elengedhetetlen a “modellorganizmusok” szerepéhez, az, hogy viszonylag könnyű velük dolgozni. Az élesztők gyorsan szaporodnak és könnyen manipulálhatók genetikailag. Az élesztők megduplázódási ideje (az az idő, amely alatt egy sejt megkettőződik és osztódik) körülbelül 90 perc. Ezzel szemben a kultúrában növő emberi sejteknek körülbelül 24 órára van szükségük a megduplázódáshoz. Az élesztőre jól meghatározott genetikai módszerek is léteznek, amelyek lehetővé teszik a kutatók számára, hogy könnyen izoláljanak mutánsokat, keresztezzék őket más mutánsokkal vagy más genetikai háttérrel, és feltérképezzék a gének helyét. Valójában a gének közötti genetikai távolság alapján szerkesztett genetikai térképek adták meg a kutatóknak az első képet a genomról és annak szerveződéséről, és a huszadik század első felére visszanyúló genetikai vizsgálatok csúcspontját jelentették.
A felfedezések felgyorsult üteme azt követően vált lehetővé, hogy a sütőélesztő (S. cerevisiae) teljes genetikai anyagát képviselő genom az első eukarióta genom, amelyet még 1996-ban szekvenáltak. Kisebb és kompaktabb, mint az emberi genom (12 millió bázispár és ~6000 gén, szemben a 3 milliárd bázispárral és ~20-25000 fehérjekódoló génnel). A genomok összehasonlítása mégis azt mutatja, hogy az élesztőgének ~31%-a nagyon hasonló az emberi génekhez, és az emberi betegséggének 20%-ának van megfelelője az élesztőben. Ezenkívül az élesztősejtek létezhetnek haploidként (egy kromoszómakészlet) vagy diploidként (két kromoszómakészlet). Mivel a haploidokban minden génből csak egy példány van, és a DNS-szálak hatékonyan szakadnak meg és egyesülnek újra (rekombináció), nagyon könnyű egy adott gént törölni egy haploidban, és megfigyelni a sejtre gyakorolt hatásokat, vagyis a deléciós mutáns “fenotípusát”. A diploid sejtek viszont lehetővé teszik az esszenciális (a növekedéshez és életképességhez szükséges) gének tanulmányozását azáltal, hogy a gén egyik példányát törlik, a másik példányban pedig finom változtatásokat végeznek. Végül a genomszekvenciából származó információk segítségével molekuláris reagensek és genomszintű gyűjtemények kiterjedt eszköztárát hozták létre, amely a kutatók számára hatékony eszközöket biztosít a biológiai problémák tanulmányozásához. Ha egy élesztőgénről ismert, hogy DNS-szekvenciájában hasonlít egy emberi génhez, az élesztőn végzett vizsgálatok erőteljes támpontokat nyújthatnak a rokon gén(ek) emberben betöltött szerepére vonatkozóan. Így az élesztőben a sejtfunkciók tanulmányozásának viszonylagos egyszerűsége és a magasabb rendű szervezetekre való vonatkoztatottsága együttesen nagyon hatékony “modellorganizmussá” teszi az élesztőt a tanulmányozás számára.
Élesztő élet és sejtciklusok
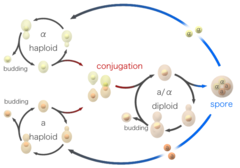
Az élesztőgombák jellemzően aszexuálisan, rügyfakadással szaporodnak. A szülő (anya)sejten kialakul egy kis rügy, amelyből leánysejt lesz, és a további növekedéssel megnagyobbodik. Ahogy a leánysejt növekszik, az anyasejt megkettőződik, majd szétválasztja a DNS-ét. A sejtmag osztódik és átvándorol a leánysejtbe. Amint a bimbó tartalmaz egy sejtmagot és elér egy bizonyos méretet, elválik az anyasejtről. A sejtben végbemenő, megkettőződéshez és osztódáshoz vezető eseménysorozatot nevezzük sejtciklusnak. A sejtciklus négy különböző fázisból áll (G1, S, G2 és M), és a nagyobb eukarióták sejtciklusához hasonlóan szabályozott. Amíg megfelelő tápanyagok, például cukor, nitrogén és foszfát van jelen, az élesztősejtek folytatják az ivartalan osztódást.
Az élesztősejtek képesek ivarosan is szaporodni. Az élesztősejtek kétféle párosodási típus, az a-sejtek és az alfa-sejtek egyikeként léteznek. Ha ellentétes párosodási típusú sejtek keverednek össze a laboratóriumban, vagy véletlenszerűen érintkeznek egymással a természetben, akkor párosodhatnak (konjugálódhatnak). Az egyesülés előtt a sejtek egy shmooingnak nevezett folyamat során alakot váltanak. A “shmoo” kifejezést azért találták ki, mert az alakja hasonlít az azonos nevű képzeletbeli rajzfilmfiguráéhoz, amelyet Al Capp hozott létre a 40-es évek végén, és először a L’il Abner című képregényében jelent meg. A konjugáció során a haploid sejtek először összeolvadnak, majd magjaik összeolvadnak, és így egy diploid sejt jön létre, amelyben minden kromoszóma két példányban van jelen. A kialakulás után a diploid sejtek a haploidokhoz hasonlóan rügyfakadással képesek aszexuálisan szaporodni. Ha azonban a diploid sejteket tápanyaghiánnyal sújtják, sporuláción mennek keresztül. A sporuláció során a diploid sejtek meiózison mennek keresztül, a sejtosztódás egy speciális formáján, amely a kromoszómák számát két példányról egy példányra csökkenti. A meiózist követően a meiózis során keletkezett haploid sejtmagok négy spórába csomagolódnak, amelyek módosított sejtfalakat tartalmaznak, így a környezeti stresszel szemben igen ellenálló szerkezetek jönnek létre. Ezek a spórák hosszú ideig képesek túlélni, amíg a körülmények kedvezőbbé nem válnak, például jobb tápanyagok jelenlétében, mire képesek kicsírázni és aszexuálisan szaporodni. Ezek a különböző állapotok, a rügyfakadás, a konjugáció és a sporuláció együttesen alkotják az élesztő életciklusát.

Élesztőnövekedés és anyagcsere
Ha az élesztősejteket gazdag szénforrásban, például glükózban nevelik, akkor inkább erjedéssel növekednek. Az erjedés során a glükóz szén-dioxiddá és etanollá alakul. Az erjedés általában oxigén hiányában történik, ezért természeténél fogva anaerob. Az élesztősejtek még oxigén jelenlétében is inkább fermentatív módon növekednek, és ezt a preferenciát felfedező biológus után Crabtree-effektusnak nevezik. Ezt a növekedési formát használják ki a kenyér, a sör, a bor és más alkoholos italok készítésénél. Bár a bimbós élesztősejtek előnyben részesítik az erjedés útján történő növekedést, ha a tápanyagok korlátozottak, képesek a sejtlégzés útján történő növekedésre is. A sejtek a légzés során a glükózt szén-dioxiddá és vízzé alakítják át, eközben oxigént fogyasztanak, és ennek eredményeként sokkal nagyobb mennyiségű energia keletkezik ATP formájában.
Történelmi felfedezések

A sört már évezredek óta használják ipari mikroorganizmusként. Az ókori egyiptomiak az élesztőerjesztést a kenyér kovászolásához használták. Vannak bizonyítékok őrlőkövekről, sütőkamrákról és 4000 éves pékségek rajzai. Régészeti ásatások során 7000 éves bormaradványokat tartalmazó korsók formájában bizonyítékokat tártak fel.
Az élesztőt először 1680-ban Antoni van Leeuwenhoek tette láthatóvá kiváló minőségű lencsék segítségével. Ő azonban úgy gondolta, hogy ezek a gömböcskék a sörlé, a sörfőzésnél használt folyékony kivonat előállításához használt gabona keményítőtartalmú részecskéi, nem pedig erjedő élesztősejtek. 1789-ben Antoine Lavoisier francia kémikus hozzájárult a cukornádból történő alkohol előállításához szükséges alapvető kémiai reakciók megértéséhez. A kiindulási anyagok és a termékek (etanol és szén-dioxid) arányának megbecslésével az élesztőpaszta hozzáadása után arra a következtetésre jutott, hogy két kémiai útvonalat használnak: a cukor kétharmada alkohollá, egyharmada pedig szén-dioxiddá redukálódik. Akkoriban azonban úgy gondolták, hogy az élesztő csupán a reakció beindításához szükséges, nem pedig a teljes folyamat során.
1815-ben Joseph-Louis Gay-Lussac francia kémikus módszereket dolgozott ki a szőlőlé erjesztetlen állapotban tartására, és felfedezte, hogy az “erjedés” (amely élesztőt tartalmaz) bevezetése szükséges az erjesztetlen sörlé átalakításához, ezzel bizonyítva az élesztő fontosságát az alkoholos erjedésben. 1835-ben Charles Cagniard de la Tour egy nagyobb teljesítményű mikroszkóp segítségével kimutatta, hogy az élesztők egysejtűek és rügyfakadással szaporodnak. Az 1850-es években Louis Pasteur felfedezte, hogy az erjesztett italok a glükóznak az élesztő által etanollá történő átalakításából származnak, és az erjedést “levegő nélküli légzésként” határozta meg. Az 1800-as évek vége felé Eduard Buchner az élesztősejtek őrlésével nyert sejtmentes kivonatokat használt a zimáz, az erjedést elősegítő vagy katalizáló enzimek gyűjteményének kimutatására, és ezért 1907-ben Nobel-díjat kapott.
Az élesztőgenetikával kapcsolatos úttörő munka nagy részét Øjvind Winge végezte. Ő fedezte fel, hogy az élesztők váltakoznak haploid és diploid állapotok között, és hogy az élesztők heterotallikusak, mivel két törzsre van szükség a haploidok diploiddá alakításához (konjugáció). Kollégájával, Otto Laustsennel együtt olyan technikákat dolgozott ki, amelyekkel mikromanipulálni lehetett az élesztőket, hogy genetikailag vizsgálni lehessen őket. Ezzel a “tetrad analízis” néven ismert technikával egy finom tűt és mikroszkópot használnak az ascusnak nevezett struktúra izolálására, amely a diploid sporulációjából származó négy spóraterméket vagy tetradot tartalmazza. Az ascus izolálása után a tetrádban lévő spórákat szétválasztják, és hagyják, hogy a genetikai elemzéshez kolóniákká nőjenek. Ez az úttörő munka hozta meg számára az “Élesztőgenetika atyja” címet. E munka egy részét Carl Lindegren tovább pontosította, aki tisztázta a párosodó élesztő párosodási típusainak rendszerét, kimutatta a Mat a és Mat alfa sejtek létezését, módszereket dolgozott ki az e párosodási típusok sejtjei közötti tömeges párosítások elvégzésére, és ezt a tudást a cukorhasznosítás genetikájának tanulmányozására használta fel.
Azóta számos más kutató végzett úttörő kutatásokat a pattogó élesztő felhasználásával. E kutatók közül néhányan Nobel-díjat kaptak e vizsgálatok során tett jelentős felfedezéseikért, többek között: Dr. Leland Hartwell (2001) a sejtciklust szabályozó gének felfedezéséért (Paul Nurse-szel és Tim Hunt-tal együtt); Roger Kornberg (2006) a génexpresszió első lépésével kapcsolatos vizsgálataiért, vagyis azért, hogy a gének DNS-szekvenciája miként másolódik át hírvivő RNS-be (mRNS); dr. Elizabeth Blackburnnek, Carol Greidernek és Jack Szostaknak (2009) azon gének és eszközök felfedezéséért és megvilágításáért, amelyekkel a sejtek megvédik a kromoszómavégeket vagy telomereket a lebomlástól; valamint Dr. Randy Schekmannak, James Rothmannak és Thomas Südhofnak (2013) a vezikuláris forgalmat szabályozó gépezet kutatásáért. Legutóbb Dr. Yoshinori Ohsumi kapta a díjat az autofágiával kapcsolatos munkájáért, amely élesztőn végzett vizsgálatokkal kezdődött.
Kereskedelmi alkalmazások

Az élesztőt régóta az alkoholtartalmú italok, a kenyér és számos ipari termék előállításához használt szervezetnek tekintik. Ez azon alapul, hogy az élesztő anyagcseréje könnyen manipulálható genetikai technikákkal, hogy gyorsan lehet nagy sejthozamot (biomasszát) termeszteni, hogy ez a biomassza könnyen elválasztható a termékektől, és hogy az élesztő általánosan biztonságosnak elismert (GRAS).
A S. cerevisiae bimbós élesztőt és más élesztőfajokat már régóta használják a rizs, búza, árpa és kukorica cukrok erjesztésére, hogy alkoholos italokat, például sört és bort állítsanak elő. A sörélesztőnek két fő típusa van, a felső erjesztésű sörélesztő és az alsó erjesztésű lágerélesztő. A felső erjesztésű élesztők, mint például a S. cerevisiae az erjedés során a felszínre emelkedik, és sörök, portói sörök, stoutok és búzasörök főzéséhez használják. Ezzel szemben a S. pastorianus (korábbi nevén S. carlsbergensis) egy alsó erjesztésű élesztő, amelyet láger sör készítésére használnak. A lágerélesztők alacsonyabb hőmérsékleten fejlődnek a legjobban. Ennek eredményeként lassabban nőnek, kevesebb felületi habot termelnek, és ezért jellemzően az erjesztő aljára ülepednek. A pilseni, a Märzen, a Bock és az amerikai malátaitalok mind a láger sörök stílusai. A modern sörfőzésben az eredeti felső erjesztő törzsek közül sokakat módosítottak, hogy alsó erjesztőkké váljanak.
A szőlőmustból (mustból) származó cukrok etanollá történő erjesztésével bort állítanak elő. Bár a bor erjedését a szőlőben természetesen előforduló élesztők is elindíthatják, sok borászat úgy dönt, hogy tiszta élesztőkultúrát ad hozzá, hogy uralja és irányítsa az erjedést. A pezsgőkben és habzóborokban a buborékok másodlagos erjedés során keletkeznek, jellemzően a palackban, amely a szén-dioxidot csapdába ejti. A bortermelés során keletkező szén-dioxid melléktermékként távozik. Egy élesztősejt óránként körülbelül a saját súlyának megfelelő mennyiségű glükózt képes erjeszteni. Optimális körülmények között a S. cerevisiae akár 18 térfogatszázaléknyi etanolt is képes előállítani, a 15-16%-os érték a szokásos. A kereskedelemben előállított borban jelen lévő kén-dioxidot közvetlenül a szőlő zúzása után adják hozzá, hogy elpusztítsák a természetesen jelen lévő baktériumokat, penészgombákat és élesztőket.

Saccharomyces cerevisiae vagy pékélesztő régóta használják kovászként a sütésben. A pékélesztő a tésztában lévő cukrokat erjeszti, szén-dioxidot és etanolt termelve. A szén-dioxid a tésztában lévő kis buborékokba záródik, ami a tészta megemelkedését okozza. A kovászos kenyér kivételt képez, mivel nem pékélesztővel, hanem vadélesztő és baktériumok kombinációjával készül. A Candida milleri élesztőt a glutén erősítésére, a “Lactobacillus sanfranciscensis” savtermelő baktériumot pedig a malátacukor erjesztésére használják.
Ezeken a hagyományos felhasználási módokon kívül az élesztőt számos más kereskedelmi felhasználásra is használják. A vegánok gyakran használják az élesztőt sajtpótlóként, és gyakran használják olyan termékek feltétjeként, mint a pattogatott kukorica. Használják a petrolkémiai iparban, ahol bioüzemanyagok, például etanol és farnezin, egy dízel- és repülőgép-üzemanyag előanyag előállítására fejlesztették ki. Kenőanyagok és mosószerek előállításához is használják. Az élesztőt az élelmiszeriparban élelmiszer-adalékanyagok, köztük színezékek, antioxidánsok és ízfokozók előállítására használják. Gyakran használják gyógyszerek, többek között parazitaellenes szerek, rákellenes vegyületek, biofarmakonok, például inzulin, vakcinák és nutrautikumok előállításához. Az élesztőt általában ipari enzimek és vegyi anyagok előállítására használják. A környezeti bioremediáció területén a törzseket még a bányászati hulladékból származó fémek eltávolítására is felhasználták.
A humán betegségekben és kutatásokban való alkalmazás

Az élesztőgének és emberi megfelelőik közötti nagyfokú hasonlóság és a konzervált alapvető sejtbiológia miatt az élesztő népszerű modellrendszerré vált a humán betegségek génjeinek vizsgálatára. Számos megközelítést alkalmaztak arra, hogy többet tudjanak meg a humán génekről, amint egy emberi és egy élesztőgén között kapcsolat jön létre. Az egyik megközelítés szerint egy emberi betegséggel összefüggő gén felfedezése után a szekvenciát összehasonlítják az élesztőgenom összes génjének szekvenciájával, hogy azonosítsák a leghasonlóbb élesztőgén(ek)et. Annak vizsgálatához, hogy a gének funkcionális kapcsolatban állnak-e egymással, az emberi gént ezután olyan élesztőfoltban fejezik ki, ahol az élesztőgént először mutációval inaktiválták. Ez lehetővé teszi a kutatók számára annak megállapítását, hogy a humán gén képes-e megmenteni az életképességet, a növekedést vagy az élesztőgén elvesztésével járó specifikusabb hibákat; ezt a módszert funkcionális komplementációnak nevezik. Ha azok az útvonalak és/vagy folyamatok, amelyekben egy élesztőgén részt vesz, konzerválódnak, akkor a rokon élesztőgénről már ismert információk alapján sokat lehet megtudni a humán gén működéséről. Miután a funkcionális komplementációt megállapították, a kutatók ezt a rendszert használhatják a kapcsolódó emberi géntermék funkciójának további jellemzésére. Kevésbé irányított megközelítések, amelyek gyakran nagy áteresztőképességű (HTP) technikákat alkalmaznak, hogy véletlenszerűen egyszerre több ezer emberi gént szűrjenek a komplementer aktivitással rendelkező gén vagy gének azonosítására. Az ilyen megközelítéseket sikeresen alkalmazták konzervált sejtciklus-szabályozók (CDC2), a rákban szerepet játszó gének és a neurodegeneratív betegségekben szerepet játszó gének azonosítására.
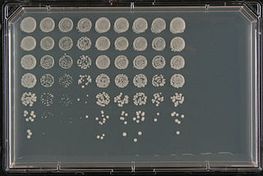
Számos olyan forgatókönyv van, ahol a vizsgálatok értékes információkkal szolgálhatnak a kutatók számára arról, hogy egy emberi gén milyen sejtpályákban és/vagy folyamatokban vesz részt, ha a kapcsolódó élesztőgén nincs jelen. Például egyes neurodegeneratív betegségek, mint az Alzheimer- és a Parkinson-kór, úgy alakulnak ki, hogy az amiloidnak nevezett fehérjeaggregátumok felhalmozódnak a fehérjék helytelen hajtogatása miatt, és ez mérgező az idegsejtekre. A hasonló amiloidképző potenciállal rendelkező, félrecsúszott élesztőfehérjék, az úgynevezett prionok tanulmányozása betekintést nyújtott a kutatóknak ezekbe a neurodegeneratív betegségekbe. Alternatív megoldásként a betegséggel kapcsolatos gén fokozott expressziója élesztőben fenotípust eredményezhet. Például az alfa-szinuklein, a Parkinson-kórral összefüggésbe hozható gén, ha elég magas szinten expresszálódik, toxikus hatású. Egy ilyen törzs ezután felhasználható olyan élesztőgének vagy kismolekulák szűrésére, amelyek elnyomják vagy fokozzák a szinuklein-indukált toxicitást, és gyakran nyomokat szolgáltatnak a vonatkozó sejtszintű útvonalakról. Az amyotrófiás laterális szklerózisban (ALS) vagy Lou Gehrig-kórban szenvedő betegek gyakran mutációval rendelkeznek néhány RNS-kötő fehérjében, ami hajlamossá teszi őket az RNS-anyagcserét zavaró aggregátumok kialakulására. Élesztőszűréssel sikeresen azonosítottak számos hasonló tulajdonságú (toxikus aggregátumokat képző) élesztőgént, így a kutatók új génjelölteket kaptak a vizsgálathoz. Ezzel szemben élesztőben kifejezve a humán RNS-kötő fehérjék toxikus aggregátumokat képeznek, és ezt a törzset olyan élesztőgén azonosítására használták, amely mutációval blokkolja ezen aggregátumok képződését.
Az élesztő egyre inkább a gyógyszerek célpontjainak és a különböző gyógyszerek hatásmechanizmusának azonosítására irányuló vizsgálatok választott szervezetévé válik. A kemogenomika vagy kémiai-genomika azokra a szűrésekre utal, amelyek a vegyi anyagok és a genomika kombinációját használják a gyógyszercélpontok vizsgálatára és potenciálisan új gyógyszerek azonosítására. Ezekben a kémiai-genomikai vizsgálatokban két fő megközelítést alkalmaztak. Az elsőben diploid törzsek egész genomra kiterjedő gyűjteményét hozzák létre, ahol egy gén két azonos kópiája közül az egyiket törlik, ezáltal csökkentve egy adott géntermék szintjét. A célgének és a célútvonalban részt vevő gének érzékenyebbé válnak a vegyületre, és az ilyen típusú szűrés során előnyben részesítik őket. Egy második megközelítésben a nem esszenciális géneket szisztematikusan törlik, és a gyűjteményt egy hatóanyaggal szűrik, hogy olyan géneket keressenek, amelyek a hatóanyag célútvonalát pufferolják. Ettől a megközelítéstől azt várják, hogy a vegyület jelenlétében történő növekedéshez szükséges géneket azonosítják. További, overexpressziós szűréseket alkalmazó megközelítéseket alkalmaztak a gyógyszerrezisztenciában szerepet játszó gének azonosítására, beleértve a potenciális gyógyszercélpontot is. A gén szempontjából deletált élesztősejtek és az adott gyógyszerrel kezelt vad típusú élesztősejtek expressziós profiljának összehasonlítása szintén hatékony módszer lehet olyan gének azonosítására, amelyek elárulhatnak valamit a kutatóknak arról, hogy a gyógyszer hogyan hat a sejtekben.
Ez csak néhány példa arra, hogy az élesztő hogyan használható mind az emberi betegségek tanulmányozásához. Az élesztőn végzett vizsgálatok segíthetnek a kutatóknak abban, hogy e modellrendszer segítségével többet tudjanak meg az alapul szolgáló biológiáról, vagy segíthetnek a gyógyszercélpontok vagy a gyógyszerek hatásmechanizmusának azonosításában.
Források
- A Saccharomyces Genome Database (SGD) átfogó integrált biológiai információt nyújt a Saccharomyces cerevisiae nevű bimbós élesztőre vonatkozóan, valamint keresési és elemzési eszközöket biztosít ezen adatok feltárásához.
- A MIPS Comprehensive Yeast Genome Database (CYPD) a teljes mértékben szekvenált, jól tanulmányozott modell eukarióta, a Saccharomyces cerevisiae bimbós élesztő molekuláris szerkezetére és funkcionális hálózatára vonatkozó információkat tartalmazza.
- Candida Genome Database (CGD), a Candida albicans genomiális szekvenciaadatait, valamint gén- és fehérjeinformációkat tartalmazó forrás.
- PomBase, a Schizosaccharomyces pombe hasadóélesztő átfogó adatbázisa, amely strukturális és funkcionális annotációt, irodalmi kurációt és hozzáférést biztosít nagyméretű adathalmazokhoz.
- Fungal genome resources at NCBI, a National Center for Biotechnology Information (NCBI) gombák genomforrásainak útmutatója.
- Élesztővel kapcsolatos források átfogó listája az általános élesztőinformációktól kezdve a nukleinsavak, genomok és fehérjék, expressziós adatok, lokalizáció, fenotípusok és más témákban.
Suggested Reading
Books
- YeastBook. (2011) A Saccharomyces cerevisiae élesztő molekuláris biológiájával, sejtbiológiájával és genetikájával kapcsolatos ismeretek jelenlegi állását bemutató átfogó áttekintő gyűjtemény, Genetics
- From a to alpha: Az élesztő mint a sejtdifferenciálódás modellje. (2007) Hiten D. Madhani, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
- Landmark Papers in Yeast Biology. (2006), szerkesztette Patrick Linder, David Shore és Michael N. Hall, Cold Spring Harbor Press, Cold Spring Harbor, New York.
- Methods in Yeast Genetics: A Cold Spring Harbor Laboratory Course Manual. (2005) David C. Amberg, Daniel J. Burke és Jeffrey N. Strathern. Cold Spring Laboratory Press, Cold Spring Harbor, New York.
- The Early Days of Yeast Genetics. (1993) Szerkesztette Michael N. Hall és Patrick Linder. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
- I. kötet: The Molecular and Cellular Biology of the Yeast Saccharomyces cerevisiae: Genome Dynamics, Protein Synthesis, and Energetics. (1991) szerkesztette James R. Broach, John R. Pringle és Elizabeth W. Jones. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
- Volume II: The Molecular and Cellular Biology of the Yeast Saccharomyces cerevisiae: Gene Expression. (1992) szerkesztette Elizabeth W. Jones, John R. Pringle és James R. Broach. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
- III. kötet: The Molecular and Cellular Biology of the Yeast Saccharomyces cerevisiae: Cell Cycle and Cell Biology. (1997) szerkesztette John R. Pringle, James R. Broach és Elizabeth W. Jones. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
- Yeast: A Practical Approach. (1988) szerkesztette I. Campbell és , és John H. Duffus, IRL Press, Ithaca, New York.
Folyóiratcikkek
- Duina A.A., Miller M.E., és J.B. Keeney (2014) Budding Yeast for Budding Geneticists: A Primer on the Saccharomyces cerevisiae Model System. Genetics. 197:33-48.
- Botstein D. és G.R. Fink (2011) Yeast: An Experimental Organism for 21st Century Biology. Genetics. 189:695-704.
- Cherry J.M., Hong E.L., Amundsen C., Balakrishnan R., Binkley G., Chan E.T., Christie K.R., Costanzo M.C., Dwight S.S., Engel S.R., Fisk D.G., Hirschman J.E., Hitz B.C., Karra K., Krieger C.J., Miyasato S.R., Nash R.S., Park J., Skrzypek M.S., Simison M., Weng S. és E.D. Wong (2011) Saccharomyces Genome Database: the genomics resource of budding yeast. Nucleic Acids Res. 40:D700-D705.
- Altman T.J., Boone C., Churchill G.A., Hengartner M.O., Mackay T.F. és D.L. Stemple (2011) The future of model organisms in human disease research. Nat. Rev. Genet. 18:575-582.
- Ho C.H., Piotrowski J., Dixon S.J., Baryshnikova A., Costanzo M. és C. Boone (2011) Combining functional genomics and chemical biology to identify targets of bioactive compounds. Curr Opin Chem Biol. 15:66-78.
- Smith A.M., Ammar R., Nislow C. és G. Giaever (2010) A survey of yeast genomic assays for drug and target discovery. Pharmacol Ther. 127:156-164.
- Dolinski K., and D. Botstein (2007) Orthology and functional conservation in eukaryotes. Annu. Rev. Genet. 41:465-507.
- Barnett J.A. (2007) A history of research on yeasts 10: foundations of yeast genetics. Yeast 24:799-845.
- Spradling A., Ganetsky B., Hieter P., Johnston M., Olson M., Orr-Weaver T., Rossant J., Sanchez A. és R. Waterston (2006) New roles for model genetic organisms in understanding and treating human disease: report from the 2006 Genetics Society of America meeting. Genetics 172:2025-2032.
- Sherman F. (2002) Getting started with yeast Methods Enzymol. 350:3-41.