US Pharm. 2012;37(5):HS-2-HS-7.
A fájdalom a leggyakoribb ok, amiért az emberek orvoshoz fordulnak.1 Egy nemrégiben készült tanulmány becslése szerint a fájdalom több tízmillió amerikait érint, és évente 635 milliárd dollárba kerül az Egyesült Államoknak az orvosi ellátás megnövekedett igénybevétele és a kiesett munkanapokból és termelékenységkiesésből eredő közvetett költségek miatt.2 A krónikus fájdalom gyógyszeres kezelése, például opioidokkal, általános stratégia, de a krónikus fájdalom az agresszív opioidkezelés ellenére is fennállhat vagy súlyosbodhat. Ez a cikk a fájdalom kezelésére felírt, de új vagy paradox módon súlyosbodó fájdalmat okozó opioidok jelenségét kívánja megvilágítani.Ezt az állapotot opioidok által kiváltott hiperalgéziának (OIH) nevezik. Az OIH formálisabban az opioidoknak való kitettség által okozott fokozott nociceptív szenzitizációként határozható meg.3Az OIH jelentősen különbözik a toleranciától, a függőségtől, a függőségtől és a betegség progressziójától. Az OIH klinikai prevalenciája ismeretlen.4
Diagnózis és prezentáció
Az OIH megfelelő diagnózisának egyik fő problémája az, hogy az állapot nagyon hasonlít az opioid-toleranciára. A tolerancia és az OIH közös jellemzője az opioiddózisra adott csökkent fájdalomcsillapító válasz, és valószínűleg számos azonos sejtmechanizmusuk van.5 A tolerancia az opioiddózis növelésével leküzdhető, míg ugyanez a növelés az OIH-ban szenvedő betegnél a fájdalom súlyosbodását eredményezi.4A tolerancia ráadásul általában lassan, idővel alakul ki, míg az OIH-ban szenvedő betegnél az opioidkezelés következtében megnövekedett fájdalom viszonylag gyorsan jelentkezik. Az OIH gyakran abban különbözik a toleranciától, hogy a fájdalom intenzitása erősebb, mint amiről kezdetben beszámoltak.6
Az alulkezelt fájdalom egy másik lehetőség, amelyet ki kell zárni. Ha azopioidterápia szuboptimális, a dózis növelésének fájdalomcsillapításhoz kell vezetnie; ha OIH van jelen, ennek az ellenkezőjének kell igaznak lennie. Az OIH pontos diagnózisa érdekében a fájdalomnak meg kell szűnnie, amint a vétkes opioiddal való kezelést abbahagyják.6 A helyzetet tovább bonyolítja, hogy az opioidok megvonásából eredő hiperalgesia jól dokumentált jelenség.7 Mint ilyen, az opioidok megvonásából eredő fájdalom megszűnése OIH esetén nem lesz azonnali, és türelmet igényel. Ez mind a klinikus, mind a beteg számára kihívást jelent.
Az OIH általában más jellegzetességekkel jelentkezik (1. TÁBLÁZAT).Az OIH-hoz társuló fájdalom általában diffúzabb és gyengébb minőségű, és a káros ingerek általában fájdalmasabbak, mint ami normális esetben várható lenne. OIH-ban a fájdalom gyakran a sérülés vagy szövetkárosodás területén túlnyúló területeken jelentkezik. Az OIH-ban a fájdalom fennmaradhat a fájdalom eredeti forrásának eltávolítása vagy a sérült szövet gyógyulása ellenére is.Az OIH-ban az opioidkezelés előrehaladtával a fájdalom azt az illúziót keltheti, hogy az eredetileg jelentettnél rosszabb lesz az idő, a pihenés és más olyan intézkedések ellenére, amelyek normális esetben lehetővé tennék a klinikailag releváns mértékű gyógyulást.5 Emellett az OIH-val kapcsolatos számos humán és állatkísérletben allodíniát mutattak ki.8

Etiológia
Az OIH okával kapcsolatban számos elmélet létezik. A legtöbbet kutatott és jelenleg a legnagyobb figyelmet kapó elmélet a neuroexcitációs modell. Úgy gondolják, hogy bizonyos opioidok és metabolitjaik agonizálják az N-metil-D-aszpartát (NMDA) receptort. Az NMDA-receptor aktiválása kalcium beáramlását okozza, amely nagymértékben fokozza a neuron gerjeszthetőségét. Amikor az NMDA-receptor és a megfelelő neuronok aktívabbak, könnyebben tudják továbbítani a keringő anyag Por más káros ingerek által kiváltott fájdalmas impulzusokat. A glutamát az NDMA receptor elsődleges endogén agonistája.9
Az NMDA receptoraktiváció által modulált pronociception elméletét alátámasztják azok a vizsgálatok, amelyek az OIH enyhülését mutatják NMDA receptor antagonisták adását követően. Ezek az antagonisták nemkompetitív módon kötődnek az NMDA-csatorna fenciklidin helyéhez, és blokkolják a kalcium beáramlását, ami akkor következne be, ha a receptor glutamátot vagy más agonistát kötne.10 Állati és humán vizsgálatok kimutatták, hogy azok az OIH-ban szenvedő alanyok, akiknek ketamint, egy NMDA-receptor-antagonistát adtak, jobban teljesítettek a kontrollált fájdalomstimulációs tesztek során. Egy vizsgálatban patkányoknak több napon keresztül intrathecális morfiuminjekciókat adtak, amíg hőre érzékeny OIH-t nem mutattak. A dizocilpin, egy NMDA-gátló beadása hatásos volt a termikus hiperalgézia legalább részleges visszafordításában5. Más NMDA-receptor-antagonisták, mint például a dextrometorfán, az NMDA-receptor gátlásán keresztül enyhítik a hiperalgesiás állapotokat.
Az opioidok, mint például a kodein, a hidromorfon és a morfium, a normál metabolikus folyamat részeként számos biotranszformáción mennek keresztül.A kodein a CYP2D6 enzim által metabolizálódik morfinná. A morfin számos molekulává metabolizálódik, de elsősorban glükuronidáció útján metabolizálódik morfin-3-glükuroniddá (M3G) és kisebb mértékben morfin-6-glükuroniddá (M6G) (1. ÁBRA).11
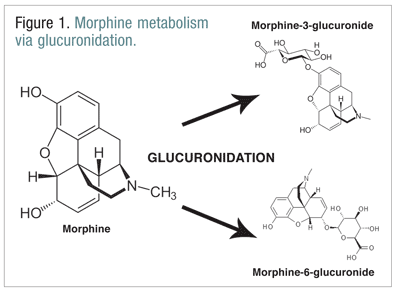
A M6G terápiásan fontos metabolit. A morfiuméhoz hasonló mu-receptor-kötési affinitással rendelkezik, és képes a morfiuméhoz hasonló analgéziát, légzésdepressziót és egyéb hatásokat kiváltani. Az M3G azonban nem agonista a mu-receptoron, és a morfiumhoz képest kis affinitással rendelkezik a mu-receptorhoz. A morfinnal, az M6G-vel és más opioidokkal ellentétben az M3G NMDA-agonista. A glükuronidáció révén az M3G körülbelül hatszor nagyobb sebességgel alakul át, mint az M6G.12 Más opioidok NMDA agonista aktivitással és paradox neuroexcitatorikus hatással rendelkeznek.6
Az elméletet, hogy az OIH-t a mu opioid receptoron kívüli receptorok aktivitása okozza, alátámasztja az a bizonyíték, hogy az OIH-t nem enyhíti egy opioid antagonista (pl. naloxon) alkalmazása. A nagy dózisú opioidterápia alatt OIH-t tapasztaló betegeknél a naloxon beadása a fájdalom súlyosbodását okozta.13 Azáltal, hogy a naloxon kiszorította az opioidot a mu receptorból, megakadályozta, hogy az opioid azt a fájdalomcsillapítást nyújtsa, ami a mu receptor aktiválása révén lehetséges volt, miközben a hiperalgézia egyidejűleg nem változott.14
A dinorfin is szerepet játszhat az OIH kialakulásában.15 A dinorfin egy endogén opioid peptid, amely elsősorban a kappa opioid receptorhoz és kisebb mértékben a mu opioid és NMDAreceptorokhoz kötődik. Úgy gondolják, hogy a dynorfin kappa opioidreceptor és NMDA-receptor agonizmusa szerepet játszik az OIH pronociceptiójában, a tiszta mu-receptor agonisták jelenléte ellenére. Vizsgálatok kimutatták, hogy a dynorfin visszafordítása képes helyreállítani a morfium fájdalomcsillapító hatását, ha az alanyok dynorfin-antiszérumot kapnak. Továbbá, a dynorphinről ismert, hogy hosszan tartó opioidadagolás során növekszik. A dynorphinalso gerjesztő neuropeptidek felszabadulását okozza a központi idegrendszer különböző helyein.
Kezelési lehetőségek
Mihelyt az OIH diagnózisát felállították, számos kezelési lehetőség van, amelyek közül gondosan kell választani. Feltéve, hogy a kezdeti fájdalmas sérülés vagy szövetkárosodás megszűnt, és a fájdalom az opioidkezelés ellenére – és annak hatására – fennáll, a legegyszerűbb megközelítés a jogsértő opioid abbahagyása. Ezt fokozatosan kell elvégezni a káros elvonási hatások minimalizálása érdekében. Meg kell jegyezni, hogy a hyperalgézia valószínűleg súlyosbodhat az abbahagyási folyamat korai szakaszában.16 Ez kihívást jelentő etikai helyzetet jelent, amelyben a klinikusnak nehéz lehet meggyőzni a beteget arról, hogy a fájdalom kezelésére felírt gyógyszer okozhatta vagy súlyosbíthatta a fájdalmat, és hogy a fájdalom még rosszabbodhat, mielőtt végül megszűnne.17
Ha a jogos fájdalom továbbra is fennáll és bizonyos mértékű fájdalomcsillapításra van szükség opioidokkal, az opioidok teljes abbahagyásán túl más stratégiákat is meg kell vizsgálni. Az OIH-t tapasztaló betegek az opioiddózis csökkentésével enyhülést érhetnek el.4 Vannak beszámolók arról, hogy a betegek az opioiddózis csökkentésével elfogadható egyensúlyt találtak az analgézia és a hiperalgézia enyhítése között.
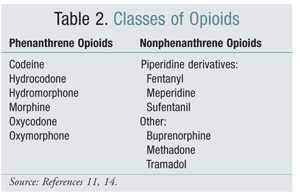
Az opioidok egyik szerkezeti osztályáról egy másikra való váltás néhány vizsgálatban hatékony lehetőségnek bizonyult az OIH enyhítésére. Az eddigi vizsgálatok azt mutatták, hogy az OIH erősebben társul a fenantrén osztályba tartozó opioidokhoz (2. TÁBLÁZAT).4 A fenantrén opioid titrálása és egy másikra való átállás az OIH feloldását biztosíthatja. A kodein, a hidromorfon, a morfin és a szerkezetileg hasonló opioidok metabolizmusuk részeként glükuronidáción mennek keresztül. Az NMDA-receptort aktiváló glükuronid-metabolit elkerülése egy szerkezetileg egyedi opioidra, például fentanilra való átállással lehetséges. E sorok írásakor az oximorfonnal végzett vizsgálatokban nem mutatták ki az OIH-t.4
Az opioidterápia ciklooxigenáz 2 (COX-2)-gátlóval való kiegészítése egy másik stratégia, amely némi támogatást élvez. A prosztaglandinszintézis csökkentésével a COX-2 gátlók csökkenthetik a pronociceptív neuronok szenzitizációját. Úgy tűnik, hogy a nem szteroid gyulladáscsökkentők (NSAID-ok) és a COX-2-gátlók fájdalomcsillapító hatásuk független attól, hogy képesek a prosztaglandinszintézist perifériásan elnyomni.9 A COX-2-gátlók az NMDA-receptor antagonizálására is képesek. Centrálisan az NSAID-ok képesek antagonizálni az NMDA-receptort a glutamát, a substance P és más gerjesztő aminosavak blokkolásával. Ettől függetlenül az NMDA-receptor aktiválása felszabályozhatja a COX-2 expresszióját.18
Az NMDA-receptornak az OIH-ban betöltött szerepe miatt kapott figyelmet figyelembe véve, e receptor antagonizálása ésszerű kezelési stratégiának tűnik. A ketamint sokat kutatták, de mellékhatásai súlyosak lehetnek. Miközben antagonizálja az NMDA-t és olyan érzéstelenítő hatást biztosít, amely elősegíti a fájdalomcsillapítást, a mellékhatások gyakoriak, sokfélék és súlyosak.19 E hatások közé tartoznak a tachyarrhythmia, a magas vérnyomás, a kognitív károsodások és a pszichomimetikus reakciók, beleértve a hangulatváltozásokat, az élénk álmokat, a delíriumot, a hallucinációkat és a szedációt. A ketamin hatásos a hiperalgézia visszafordításában és az opioidok hatásainak fokozásában a nagy dózisban kapott betegeknél, de mellékhatásai megakadályozzák, hogy életképes kezelési lehetőség legyen.
A dextrometorfán egy másik NMDA-receptor-antagonista, amelyet az OIH kezelésében vizsgáltak. A morfium és a dextrometorfán 1:1 arányú keverékét tartalmazó kombinált készítményt vizsgálták.20A vizsgálatok nem bizonyították, hogy a kombinált terápia jobb fájdalomcsillapítást tudna elérni, mint a morfium önmagában. Hasonló terápiás sikertelenség történt egy olyan vizsgálatban, amelyben ugyanezen szerek 2:1 arányú keverékét alkalmazták.21 A vizsgálatokat kritizálták, mivel a dextrometorfán mennyisége nem volt elegendő az NMDA-receptor megfelelő antagonizálásához.Továbbra sem ismert, hogy a dextrometorfán mekkora dózisa szükséges ahhoz, hogy vagy fokozza az opioid analgéziáját, vagy megakadályozza az NMDAreceptor aktiválódása által okozott OIH-t.
A metadon olyan opioid, amely egyedi tulajdonságokkal rendelkezik, amelyek az OIH-ban szenvedő betegek fájdalomcsillapításának meggyőző lehetőségévé teszik. A mu-opioid receptorhoz kötődő fájdalomcsillapító hatása mellett a metadon gyenge NMDA-receptor-antagonista.4 Arról számoltak be, hogy még alacsony dózisú metadon hozzáadása is hatásos a hiperalgézia csökkentésében. Egy esetben az alacsony dózisú metadon (napi kétszer 10 mg) hozzáadása jelentősen javította a fájdalomról szóló beszámolókat, a teljes opioiddózis 40-50%-os csökkenése mellett.22 A káros opioidról a metadonra való váltás népszerű kezelési stratégia volt. A tramadol és a meperidin is rendelkezik némi NMDA-receptor-antagonista aktivitással.
A másik kezelési mód, amely bizonyos potenciállal rendelkezik az OIH kezelésében, a buprenorfin.23,24 A buprenorfin a mu-receptor részleges opioid-agonistája, és kappa-receptor-antagonista aktivitással is rendelkezik.4 A dinorfin, egy kappa-receptor-agonista, ismert, hogy az opioidokkal való kezelés során emelkedik. A kappa receptor aktiválása nagymértékben antagonizálja az opioidok mu receptor által közvetített hatásait.25 A buprenorfin klinikai hasznosságát az OIH kezelésében még nem sikerült teljesen megmagyarázni.
Következtetés:
Még sok munka áll előttünk, mielőtt kijelenthetjük, hogy az OIH-t megértettük. A jelenségért felelős pontos sejtszintű mechanizmus és jelátviteli útvonalak nincsenek meghatározva. Ezt tovább bonyolítja, hogy ellentmondó jelentések vannak arról, hogy bizonyos komponensek kulcsszerepet játszanak-e, vagy egyáltalán játszanak-e szerepet. Az OIH patofiziológiájának tisztázására irányuló kutatások nagy része állatmodellben zajlott. Ennek van némi értéke, de az emberi modellből származó információ kevés.
Az állapot okának gyenge megértése a kezelési lehetőségek bizonytalan eszköztárát eredményezi. A rendelkezésre álló legjobb stratégia a problémás opioid teljes abbahagyása, de ez kevéssé hasznos az opioid típusú fájdalomcsillapítást igénylő beteg számára.Számos más kezelési módot vizsgáltak, de mindegyiket további tanulmányozásra érdemes lenne. Az embereken végzett vizsgálatok többsége műtéti betegek, gyógyulóban lévő kábítószerfüggők és kísérleti fájdalommodellek bevonásával készült. Ezek a vizsgálatok nem értéktelenek, de ezek a populációk nem tükrözik a krónikus fájdalommal küzdő lakosságot. A rendelkezésre álló kezelési lehetőségek egyéb korlátai közé tartoznak a gyenge eredmények, a mérsékelt siker ellenére a túlzott toxicitás és a kis vizsgálatok, amelyek gyenge következtetéseket hoznak.
Az írás időpontjában számos klinikai vizsgálat van folyamatban vagy tervben az NMDA-receptor-antagonista memantinnal az OIH kezelésére.26Még mindig vannak ellentmondásos jelentések az NMDA-receptorok pontos szerepéről az OIH-ban. További kutatásokat kell végezni az OIH-ban jelenlévő kulcsfontosságú receptorok és mechanizmusok meghatározására. A vizsgálatok mintaméretének bővítése segíteni fogja a már meghozott következtetések alátámasztását azzal kapcsolatban, hogy mely kezelési szerek felelősek az OIH-ért és hatékonyak a kezelésében. Az akut fájdalom modelljei helyett a krónikus fájdalomra összpontosító vizsgálatok elvégzése klinikailag releváns információkat hozhat a gyakorló orvos számára.
Chapman és munkatársai konkrét kérdéseket vetettek fel, amelyeket meg kell válaszolni, mielőtt az OIH diagnózisa és a hatékony kezelés megvalósulhat.27 Milyen összefüggések vannak az opioiddózis és -tartam és az OIH között? Milyen típusú fájdalom esetén, illetve milyen típusú betegnél hajlamosabb az OIH kialakulására? Ezeknek a kérdéseknek kell irányítaniuk a jövőbeni klinikai kutatásokat.
1. Parselis Kelly J, Cook SF, Kaufman DW, et al. Az opioidhasználat előfordulása és jellemzői az amerikai felnőtt lakosság körében. Pain. 2008;138:507-513.
2. Institute of Medicine. A fájdalom enyhítése Amerikában: A Blueprint for Transforming Prevention, Care, Education, and Research. Washington, DC: The National Academies Press; 2011.
3. Chu LF, Angst MS, Clark D. Opioidok által kiváltott hiperalgézia emberekben: molekuláris mechanizmusok és klinikai megfontolások. Clin J Pain. 2008;24:479-496.
4. Lee M, Silverman SM, Hansen H, et al. A comprehensive review of opioid-induced hyperalgesia. Fájdalomorvos. 2011;14:145-161.
5. Mao J. Opioidok által kiváltott abnormális fájdalomérzékenység: következmények a klinikai opioidterápiában. Fájdalom. 2002;100:213-217.
6. Raffa RB, Pergolizzi JV Jr. Opioidok által kiváltott hiperalgézia: van-e klinikai jelentősége a fájdalombetegek kezelésében? Pain Manage Nurs. 2011;1-17.
7. Li X, Clark JD. Hiperalgézia opioid absztinencia alatt: közvetítés a glutamát és a substance P által. Anesth Analg. 2002;95:979-984.
8. Pud D, Cohen D, Lawental E, Eisenberg E. Opioidok és abnormális fájdalomérzet: új bizonyítékok krónikus opioidfüggők és egészséges alanyok vizsgálatából. Drug Alcohol Depend. 2006;82:218-223.
9. Malmberg AB, Yaksh TL. A gerincvelői glutamátvagy a P-anyag receptor által közvetített hiperalgézia, amelyet a gerincvelői ciklooxigenáz gátlása blokkol. Science. 1992;257:1276 -1279.
10. Fisher K, Coderre TJ, Hagen NA. AzN-metil-D-aszpartát receptor megcélzása a krónikus fájdalom kezelésében. Preklinikaiállatkísérletek, legújabb klinikai tapasztalatok és jövőbeli kutatási irányok. J Pain Symptom Manage. 2000;20:358-373.
11. Lötsch J. Opioid metabolitok. J Pain Symptom Manage. 2005;29:S10-S24.
12. Skarke C, Lötsch J. Morfium metabolitok: klinikai vonatkozások. Semin Anesth, Perioperative Med Pain. 2002;21:258-264.
13. Juni A, Klein G, Kest B. Morphine hyperalgesia in mice isunrelated to opioid activity, analgesia, or tolerance: evidence formultiple diverse hyperalgesic systems. Brain Res. 2006;1070:35-44.
14. Angst M, Clark JD. Opioidok által kiváltott hiperalgézia: egy kvalitatív szisztematikus áttekintés. Aneszteziológia. 2006;104:570-587.
15. Vanderah TW, Gardell LR, Burgess SE, et al. A dinorfin elősegíti a kóros fájdalmat és a gerincvelői opioidok antinociceptív toleranciáját. J Neurosci. 2000;20:7074-7079.
16. Hooten WM, Mantilla CB, Sandroni P, Townsend CO. Asszociációk a hőfájdalom észlelése és az opioiddózis között krónikusfájdalommal küzdő, opioidok szűkítésén átesett betegek körében. Pain Med. 2010;11:1587-1598.
17. Silverman S. Opioidok által kiváltott hiperalgézia: klinikai következmények a fájdalomorvos számára. Pain Physician. 2009;12:679-684.
18. Li SQ, Xing YL, Chen WN, et al. Az NMDA receptor aktiválása a COX-2 expresszió felszabályozásával jár együtt a gerincvelői dorsalis szarvban a nociceptív bemenetek során patkányokban. Neurochem Res. 2009;34:1451-1463.
19. Okon T. Ketamin: bevezetés a fájdalom- és palliatív orvosok számára. Pain Physician. 2007;10:493-500.
20. Galer BS, Lee D, Ma T, et al. MorphiDex (morfinsulfát/dextrometorfán-hidrobromid kombináció) a krónikus fájdalom kezelésében: három multicentrikus, randomizált, kettős vak, kontrollált klinikai vizsgálat nem bizonyította a fokozott opioid analgéziát vagy a tolerancia csökkenését. Pain. 2005;115:284-295.
21. Wiesenfeld-Hallin Z. Kombinált opioid-NMDA antagonista terápiák. milyen előnyökkel járnak a fájdalom szindrómák kontrolljában? Drogok. 1998;55;1-4.
22. Vorobeychik Y, Chen L, Bush MC, Mao J. Javuló opioid analgetikus hatás az opioid dózis csökkentését követően. Pain Med. 2008;9:724-727.
23. Baron MJ, McDonald PW. Jelentős fájdalomcsökkenés krónikus fájdalommal küzdő betegeknél a nagy dózisú opioidoktól való detoxikációt követően. J Opioid Manag. 2006;2:277-282.
24. Koppert W, Ihmsen H, Körber N, et al. A buprenorfin által kiváltott analgézia és antihiperalgézia különböző profiljai egy humán fájdalommodellben. Pain. 2005;118:15-22.
25. Pan ZZ. A kappa-opioid receptor Mu-ellenes hatásai. Trends Pharmacol Sci. 1998;19:94-98.
26. Ballantyne JC, Mao J. A krónikus fájdalom opioidterápiája. N Engl J Med. 2003;349:1943-1953.
27. Chapman CR, Lipschitz DL, Angst MS, et al. Opioid farmakoterápia krónikus, nem rákos fájdalomra az Egyesült Államokban: kutatási irányelv a bizonyíték-alap kidolgozásához. J Pain. 2010;11:807-829.