A thylakoidok számos integrális és perifériás membránfehérjét, valamint lumenes fehérjét tartalmaznak. A tilakoid frakciók legújabb proteomikai vizsgálatai további részleteket szolgáltattak a tilakoidok fehérjeösszetételéről. Ezeket az adatokat több, online elérhető plasztidfehérje-adatbázisban foglalták össze.
A vizsgálatok szerint a tikakoid proteom legalább 335 különböző fehérjéből áll. Ebből 89 a lumenben található, 116 integrális membránfehérje, 62 perifériás fehérje a stróma felőli oldalon, és 68 perifériás fehérje a lumen felőli oldalon. Számítógépes módszerekkel további alacsonyabundanciájú lumenes fehérjéket lehet megjósolni. Az ismert funkciójú tikakoidfehérjék 42%-a részt vesz a fotoszintézisben. A következő legnagyobb funkcionális csoportok közé tartoznak a fehérjék célba juttatásában, feldolgozásában és hajtogatásában részt vevő fehérjék 11%-kal, az oxidatív stresszválasz (9%) és a transzláció (8%).
Integrális membránfehérjékSzerkesztés
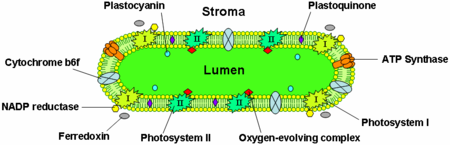
A tilakoidmembránok integrális membránfehérjéket tartalmaznak, amelyek fontos szerepet játszanak a fénynyerésben és a fotoszintézis fényfüggő reakcióiban. A tilakoidmembránban négy fő fehérjekomplex található:
- Fényrendszer I és II
- Citokróm b6f komplex
- ATP-szintáz
A fényrendszer II főként a grana-tilakoidokban található, míg a fényrendszer I és az ATP-szintáz főként a stroma-tilakoidokban és a grana külső rétegeiben. A citokróm b6f komplex egyenletesen oszlik el a tilarakoid membránokban. A két fotoszisztéma tikakoid membránrendszerben való külön elhelyezkedése miatt mobil elektronhordozókra van szükség az elektronok közöttük való mozgatásához. Ezek a hordozók a plasztokinon és a plasztocianin. A plasztokinon a II. fotoszisztémából a citokróm b6f komplexbe szállítja az elektronokat, míg a plasztocianin a citokróm b6f komplexből az I. fotoszisztémába.
Ezek a fehérjék együttesen a fényenergiát használják fel az elektrontranszportláncok működtetésére, amelyek a tikakoidmembránon keresztül kemoszmotikus potenciált és a terminális redoxireakció termékét, a NADPH-t hozzák létre. Az ATP-szintáz a kemozmotikus potenciált használja fel ATP előállítására a fotofoszforiláció során.
FényrendszerekSzerkesztés
A fotoszisztémák fényvezérelt redox-központok, amelyek mindegyike egy-egy antennakomplexből áll, amely klorofillokat és kiegészítő fotoszintetikus pigmenteket, például karotinoidokat és fikobiliproteineket használ a különböző hullámhosszúságú fény begyűjtésére. Minden egyes antennakomplex 250-400 pigmentmolekulát tartalmaz, és az általuk elnyelt energiát rezonancia-energiatranszferrel továbbítják az egyes fotoszisztémák reakcióközpontjában lévő speciális klorofill a-ba. Amikor a reakcióközpontban lévő két klorofill a molekula valamelyike energiát nyel el, egy elektron gerjesztődik és átkerül egy elektron-elfogadó molekulához. Az I. fotoszisztéma egy P700-nak nevezett klorofill a molekulapárt tartalmaz a reakcióközpontban, amely maximálisan elnyeli a 700 nm-es fényt. A II. fotoszisztéma P680 klorofillt tartalmaz, amely a 680 nm-es fényt nyeli el legjobban (megjegyzendő, hogy ezek a hullámhosszok a mélyvörösnek felelnek meg – lásd a látható spektrumot). A P a pigment rövidítése, a szám pedig az egyes reakcióközpontokban lévő klorofillmolekulák nanométerben kifejezett specifikus abszorpciós csúcsát jelenti. Ez a növényekben jelen lévő zöld pigment, amely szabad szemmel nem látható.
Citokróm b6f komplexSzerkesztés
A citokróm b6f komplex a tilakoid elektrontranszportlánc része, és az elektronátvitelt a protonok tilakoid lumenbe való pumpálásával kapcsolja össze. Energetikai szempontból a két fotoszisztéma között helyezkedik el, és az elektronokat a II-es fotoszisztéma-plasztokinonból a plasztocianin-fotoszisztéma I-be továbbítja.
ATP-szintázSzerkesztés
A tikakoid ATP-szintáz a mitokondriális ATPázhoz hasonló CF1FO-ATP-szintáz. A tilakoid membránba épül be, a CF1-része a strómába tapad. Így az ATP-szintézis a tikakoidok strómaoldalán történik, ahol az ATP-re a fotoszintézis fényfüggetlen reakcióihoz van szükség.
LumenfehérjékSzerkesztés
A lumenben található az elektrontranszportfehérje, a plastocianin, amely az elektronokat a citokróm b6f fehérjekomplexből a fotoszisztéma I-be szállítja. Míg a plasztokinonok lipidoldékonyak, és ezért a tilakoidmembránon belül mozognak, a plasztocianin a tilakoidlumenben mozog.
A tilakoidok lumenében történik a víz oxidációja is a II. fotoszisztéma lumenes oldalához kapcsolódó oxigénfejlesztő komplex által.
A lumenfehérjéket céljelzéseik alapján számítással lehet megjósolni. Arabidopsisban a Tat szignállal rendelkező prediktált lumenális fehérjék közül a legnagyobb, ismert funkciójú csoportok 19%-a a fehérjefeldolgozásban (proteolízis és folding), 18%-a a fotoszintézisben, 11%-a az anyagcserében, 7%-a pedig a redox-hordozókban és a védelemben vesz részt.
FehérjeexpresszióSzerkesztés
A kloroplasztiszok saját genommal rendelkeznek, amely számos tilakoid fehérjét kódol. A cianobakteriális endoszimbionta őseikből származó plasztidok evolúciója során azonban kiterjedt géntranszfer történt a kloroplasztisz genomból a sejtmagba. Ennek eredményeképpen a négy fő tikakoid fehérjekomplexet részben a kloroplaszt genom, részben pedig a nukleáris genom kódolja. A növények számos mechanizmust fejlesztettek ki a két különböző organellumban kódolt különböző alegységek expressziójának együttes szabályozására, hogy biztosítsák e fehérjekomplexek megfelelő sztöchiometriáját és összeszerelését. Például a fotoszintetikus apparátus részeit kódoló nukleáris gének transzkripcióját a fény szabályozza. A tikakoid fehérjekomplexek biogenezisét, stabilitását és forgalmát a tikakoidmembránokban lévő redox-érzékeny kinázokon keresztül történő foszforiláció szabályozza. A kloroplasztiszban kódolt fehérjék transzlációs sebességét az összeszerelési partnerek jelenléte vagy hiánya szabályozza (a szintézis episztázis általi szabályozása). Ez a mechanizmus negatív visszacsatolást foglal magában a kloroplasztisz mRNS 5′ nem transzlált régiójához kötődő felesleges fehérje kötődésén keresztül. A kloroplasztiszoknak az elektronátviteli lánchoz az I. és II. fotoszisztéma arányát is egyensúlyban kell tartaniuk. Az elektronhordozó plasztakinon redoxállapota a tilakoidmembránban közvetlenül befolyásolja a kloroplasztisz génjeinek átírását, amelyek a fotoszisztémák reakcióközpontjainak fehérjéit kódolják, így ellensúlyozva az elektronátviteli lánc egyensúlyhiányát.
Fehérjék célba juttatása a tilakoidokbaSzerkesztés
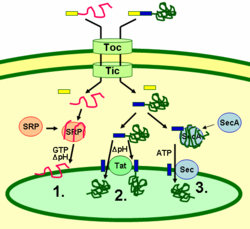
A thylakoid fehérjék a kloroplasztiszon belüli szignálpeptideken és prokarióta típusú szekréciós útvonalakon keresztül jutnak célba. A legtöbb növényi nukleáris genom által kódolt tikakoidfehérjének két célzási jelre van szüksége a megfelelő lokalizációhoz: Egy N-terminális kloroplasztisz-célzó peptid (az ábrán sárgával jelölve), majd egy tikakoid-célzó peptid (kékkel jelölve). A fehérjék importálása a külső és belső membrán (Toc és Tic) komplexek transzlokonján keresztül történik. A kloroplasztiszba való bejutás után az első targetáló peptidet az importált fehérjéket feldolgozó proteáz lehasítja. Ez leleplezi a második célzási jelet, és a fehérje egy második célzási lépésben a strómából a tikakoidba exportálódik. Ez a második lépés a tilakoidok fehérjetranszlokációs komponenseinek hatását igényli, és energiafüggő. A fehérjék az SRP-függő úton (1), a Tat-függő úton (2) vagy spontán módon, transzmembrán doménjeiken keresztül kerülnek a membránba (az ábrán nem látható). A lumenális fehérjék a tilakoid membránon keresztül a lumenbe exportálódnak a Tat-függő (2) vagy a Sec-függő (3) útvonalon keresztül, és a tilakoid célszignáltól való hasítással szabadulnak fel. A különböző útvonalak különböző jeleket és energiaforrásokat használnak. A Sec (szekréciós) útvonal ATP-t igényel energiaforrásként, és az importált fehérjéhez kötődő SecA és egy Sec membránkomplexből áll, amely a fehérje áthaladásához szükséges. A tikakoid szignálpeptidjükben iker arginin-motívummal rendelkező fehérjéket a Tat (iker arginin-transzlokációs) útvonalon keresztül szállítják, amely egy membránhoz kötött Tat-komplexet és a pH-gradienst mint energiaforrást igényli. Néhány más fehérje az SRP (signal recognition particle) útvonalon keresztül kerül a membránba. A kloroplasztisz SRP akár poszt-transzlációsan, akár ko-transzlációsan kölcsönhatásba léphet a célfehérjéivel, így az importált fehérjéket és a kloroplasztiszon belül transzlálódó fehérjéket is szállíthatja. Az SRP útvonal energiaforrásként GTP-t és pH-gradienst igényel. Egyes transzmembránfehérjék spontán is beilleszkedhetnek a membránba a stróma felől, energiaigény nélkül.