Nei primi tempi della chimica organica, gli alcheni venivano descritti come “insaturi” perché, a differenza degli alcani “saturi”, si trovavano a reagire facilmente con sostanze come alogeni, alogenuri di idrogeno, agenti ossidanti e così via. Pertanto, l'”affinità chimica” degli alcheni era considerata insoddisfatta o “insatura”. (Vedi anche la sezione 1-1I.)
Una ragione per cui gli alcheni e gli alchini reagiscono più facilmente degli alcani è che i legami carbonio-carbonio di un legame multiplo sono individualmente più deboli dei normali legami carbonio-carbonio singoli. Consideriamo le energie di legame coinvolte. Secondo la Tabella 4-3, le forze dei legami carbonio-carbonio singoli, doppi e tripli sono rispettivamente \(83\), \(146\), e \(200 \testo{kcal}). Da questi valori possiamo calcolare che la scissione di metà di un doppio legame carbonio-carbonio dovrebbe richiedere \(63 \: \text{kcal}\ e la scissione di un terzo di un triplo legame carbonio-carbonio dovrebbe richiedere \(54 \: \text{kcal}\:

Di conseguenza, le reazioni di addizione a legami multipli dovrebbero essere circa \(20 \)-(30 \: \La differenza sostanziale nei calori di reazione di etano, etene ed etilene con il bromo si riflette in una considerazione pratica molto importante nel maneggiare l’etilene (acetilene), cioè la sua stabilità termodinamica rispetto al carbonio solido e all’idrogeno gassoso. A differenza dell’etano, sia l’etene che l’etilene possono essere dimostrati dalle energie di legame come instabili rispetto alla formazione di carbonio solido e idrogeno gassoso:
Anche se questo non sembra offrire particolari problemi con l’etene, una decomposizione esplosiva dell’etilene in carbonio e idrogeno può avvenire se il gas viene compresso a \(10\)-\(20 \text{kg cm}^{-2}\). Anche l’etilene liquido (bp \sim 83^{text{o})) deve essere maneggiato con cura. L’etilene non è usato commercialmente sotto pressione a meno che non sia mescolato con un gas inerte e maneggiato in attrezzature robuste. L’etilene brucia con ossigeno puro per dare una fiamma molto calda che è ampiamente utilizzata per la saldatura. Per questo scopo, il gas è dissolto sotto circa \(15 \: \text{kg cm}^{-2}} in 2-propanone (acetone, 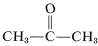 , bp \(56.5^\text{o})) e contenuto in cilindri imballati con terra diatomacea.
, bp \(56.5^\text{o})) e contenuto in cilindri imballati con terra diatomacea.
Perché l’etina è così meno stabile dell’etene o dell’etano? In primo luogo, i legami \(\ce{C-C}) non sono così forti come i legami \(\ce{C-H}). Quindi ci si deve aspettare un guadagno in stabilità quando i legami \(\ce{C-H}) sono fatti a spese dei legami \(\ce{C-C}); l’etene e l’etano hanno più legami \(\ce{C-H}) dell’etilene. In secondo luogo, l’etene ha sei elettroni tenuti tra i due carboni e questi elettroni subiscono una considerevole repulsione interelettronica reciproca. Questo spiega il fatto che la forza di legame media del triplo legame di un alchene è di \200/3 = 67 \testo kcal, rispetto a \146/2 = 73 \testo kcal) per il doppio legame di un alchene e \83 \testo kcal) per un normale legame singolo di un alchano.
- John D. Robert e Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, seconda edizione. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Questo contenuto è protetto da copyright alle seguenti condizioni: “È concesso il permesso per la riproduzione individuale, educativa, di ricerca e non commerciale, la distribuzione, la visualizzazione e l’esecuzione di questo lavoro in qualsiasi formato.”