Evaporazione
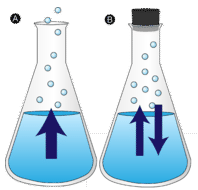
Una pozza d’acqua lasciata indisturbata alla fine scompare. Le molecole liquide scappano nella fase gassosa, diventando vapore acqueo. La vaporizzazione è il processo in cui un liquido viene convertito in un gas. L’evaporazione è la conversione di un liquido nel suo vapore al di sotto della temperatura di ebollizione del liquido. Se l’acqua è invece tenuta in un contenitore chiuso, le molecole di vapore acqueo non hanno la possibilità di uscire nell’ambiente circostante e quindi il livello dell’acqua non cambia. Mentre alcune molecole d’acqua diventano vapore, un numero uguale di molecole di vapore acqueo si condensa di nuovo allo stato liquido. La condensazione è il cambiamento di stato da un gas a un liquido.
Per fare in modo che una molecola liquida passi allo stato gassoso, la molecola deve avere abbastanza energia cinetica per superare le forze attrattive intermolecolari nel liquido. Ricordiamo che un dato campione di liquido avrà molecole con una vasta gamma di energie cinetiche. Le molecole liquide che hanno questa certa soglia di energia cinetica sfuggono alla superficie e diventano vapore. Di conseguenza, le molecole liquide che rimangono hanno ora un’energia cinetica inferiore. Quando avviene l’evaporazione, la temperatura del liquido rimanente diminuisce. Avete osservato gli effetti del raffreddamento per evaporazione. In una giornata calda, le molecole d’acqua del tuo sudore assorbono il calore del corpo ed evaporano dalla superficie della tua pelle. Il processo di evaporazione lascia il sudore rimanente più freddo, che a sua volta assorbe più calore dal tuo corpo.
Un dato liquido evapora più rapidamente quando viene riscaldato. Questo perché il processo di riscaldamento fa sì che una frazione maggiore delle molecole del liquido abbia l’energia cinetica necessaria per sfuggire alla superficie del liquido. La figura qui sotto mostra la distribuzione dell’energia cinetica delle molecole del liquido a due temperature. Il numero di molecole che hanno l’energia cinetica necessaria per evaporare è mostrato nell’area ombreggiata sotto la curva a destra. Il liquido a temperatura più alta \(\sinistra( T_2 \destra)\ ha più molecole che sono capaci di sfuggire nella fase di vapore rispetto al liquido a temperatura più bassa \(\sinistra( T_1 \destra)\).

A 29,029 piedi (a sinistra( 8848 \testo{m} a destra)\), il Monte Everest nella catena dell’Himalaya al confine tra Cina e Nepal è il punto più alto della terra. La sua altitudine presenta molti problemi pratici per gli scalatori. Il contenuto di ossigeno nell’aria è molto più basso che al livello del mare, rendendo necessario portare con sé delle bombole di ossigeno (anche se alcuni scalatori hanno raggiunto la vetta senza ossigeno). Un altro problema è quello di far bollire l’acqua per cucinare il cibo. Anche se l’acqua bolle a 100° C a livello del mare, il punto di ebollizione sulla cima del Monte Everest è solo 70° C circa. Questa differenza rende molto difficile ottenere una tazza di tè decente (cosa che ha sicuramente frustrato alcuni degli scalatori britannici).