Gas reali e ideali
Un gas ideale è un gas che segue le leggi dei gas in tutte le condizioni di temperatura e pressione. Per farlo, il gas dovrebbe rispettare completamente la teoria cinetico-molecolare. Le particelle del gas dovrebbero occupare un volume pari a zero e non dovrebbero esibire alcuna forza attrattiva l’una verso l’altra. Poiché nessuna di queste condizioni può essere vera, non esiste un gas ideale. Un gas reale è un gas che non si comporta secondo i presupposti della teoria cinetico-molecolare. Fortunatamente, alle condizioni di temperatura e pressione che si incontrano normalmente in laboratorio, i gas reali tendono a comportarsi molto simile ai gas ideali.
In quali condizioni, allora, i gas si comportano meno idealmente? Quando un gas è messo sotto alta pressione, le sue molecole sono forzate ad avvicinarsi, poiché lo spazio vuoto tra le particelle diminuisce. Una diminuzione dello spazio vuoto significa che l’ipotesi che il volume delle particelle stesse sia trascurabile è meno valida. Quando un gas viene raffreddato, la diminuzione dell’energia cinetica delle particelle le fa rallentare. Se le particelle si muovono a velocità inferiori, le forze attrattive tra loro sono più importanti. Un altro modo di vedere la cosa è che il continuo raffreddamento del gas finirà per trasformarlo in un liquido e un liquido non è certamente più un gas ideale (vedi l’azoto liquido nella figura qui sotto). In sintesi, un gas reale si discosta maggiormente da un gas ideale a basse temperature e alte pressioni. I gas sono più ideali ad alta temperatura e bassa pressione.

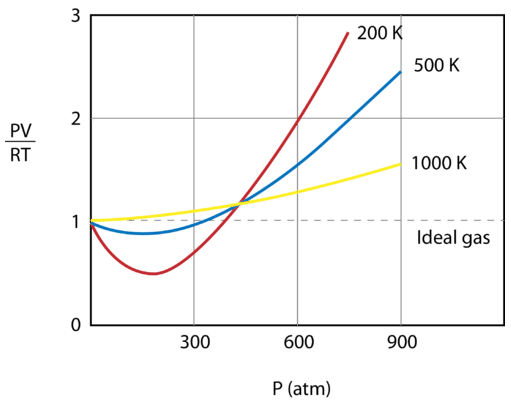
La figura qui sotto mostra un grafico di \frac{PV}{RT}} tracciato contro la pressione per \(1 \: \text{mol}}) di un gas a tre diverse temperature – \(200 \: \text{K}}), \(500 \: \text{K}), e 1000 \: \testo{K}). Un gas ideale avrebbe un valore di 1 per questo rapporto a tutte le temperature e pressioni e il grafico sarebbe semplicemente una linea orizzontale. Come si può vedere, si verificano deviazioni da un gas ideale. Quando la pressione comincia a salire, le forze attrattive fanno sì che il volume del gas sia inferiore al previsto e il valore di \frac{PV}{RT}\ scende sotto 1. Continuando ad aumentare la pressione, il volume delle particelle diventa significativo e il valore di \frac{PV}{RT}\ sale a più di 1. Notate che la grandezza delle deviazioni dall’idealità è maggiore per il gas a \200 \: \testo{K}\ e minore per il gas a \1000 \: \testo{K}\.
L’idealità di un gas dipende anche dalla forza e dal tipo di forze attrattive intermolecolari che esistono tra le particelle. I gas le cui forze attrattive sono deboli sono più ideali di quelli con forze attrattive forti. Alla stessa temperatura e pressione, il neon è più ideale del vapore acqueo perché gli atomi di neon sono attratti solo da deboli forze di dispersione, mentre le molecole di vapore acqueo sono attratte da legami idrogeno relativamente più forti. L’elio è un gas più ideale del neon perché il suo minor numero di elettroni fa sì che le forze di dispersione dell’elio siano ancora più deboli di quelle del neon.