Forza dei legami: Legami Covalenti
Le molecole stabili esistono perché i legami covalenti tengono insieme gli atomi. Misuriamo la forza di un legame covalente dall’energia richiesta per romperlo, cioè l’energia necessaria per separare gli atomi legati. La separazione di qualsiasi coppia di atomi legati richiede energia; più forte è un legame, maggiore è l’energia richiesta per romperlo. L’energia richiesta per rompere uno specifico legame covalente in una mole di molecole gassose è chiamata energia di legame o energia di dissociazione del legame. L’energia di legame per una molecola biatomica, \(D_{X-Y}}), è definita come la variazione di entalpia standard per la reazione endotermica:
Per esempio, l’energia di legame del puro legame covalente H-H, \(\Delta_{H-H}\), è 436 kJ per mole di legami H-H rotti:
La rottura di un legame richiede sempre energia da aggiungere alla molecola. Corrispondentemente, fare un legame rilascia sempre energia.
Le molecole con tre o più atomi hanno due o più legami. La somma di tutte le energie di legame in una tale molecola è uguale alla variazione entalpica standard per la reazione endotermica che rompe tutti i legami nella molecola. Per esempio, la somma delle quattro energie di legame C-H in CH4, 1660 kJ, è uguale alla variazione entalpica standard della reazione:
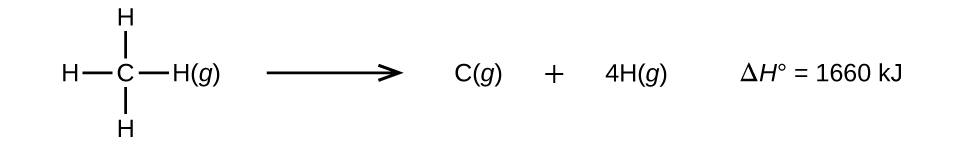
L’energia media del legame C-H, \(D_{C-H}\), è 1660/4 = 415 kJ/mol perché ci sono quattro moli di legami C-H rotti per mole della reazione. Anche se i quattro legami C-H sono equivalenti nella molecola originale, non richiedono tutti la stessa energia per rompersi; una volta che il primo legame è rotto (che richiede 439 kJ/mol), i legami rimanenti sono più facili da rompere. Il valore di 415 kJ/mol è la media, non il valore esatto richiesto per rompere un qualsiasi legame.
La forza di un legame tra due atomi aumenta all’aumentare del numero di coppie di elettroni nel legame. Generalmente, all’aumentare della forza del legame, la lunghezza del legame diminuisce. Così, troviamo che i legami tripli sono più forti e più corti dei legami doppi tra gli stessi due atomi; allo stesso modo, i legami doppi sono più forti e più corti dei legami singoli tra gli stessi due atomi. Le energie medie di legame per alcuni legami comuni appaiono nella Tabella \PageIndex{2}, e un confronto delle lunghezze e delle forze di legame per alcuni legami comuni appare nella Tabella \PageIndex{2}. Quando un atomo si lega a vari atomi di un gruppo, la forza di legame tipicamente diminuisce man mano che ci si sposta verso il basso del gruppo. Per esempio, C-F è 439 kJ/mol, C-Cl è 330 kJ/mol, e C-Br è 275 kJ/mol.
| Bond | Bond Energy | Bond | Bond Energy | Bond | Bond Energy | ||
|---|---|---|---|---|---|---|---|
| H-H | 436 | C-S | 260 | F-Cl | 255 | ||
| H-C | 415 | C-Cl | 330 | F-Br | 235 | ||
| H-N | 390 | C-Br | 275 | Si-Si | 230 | ||
| H-O | 464 | C-I | 240 | Si-P | 215 | ||
| H-F | 569 | N-N | 160 | Si-S | 225 | ||
| H-Si | 395 | \(\mathrm{N=N}) | 418 | Si-Cl | 359 | ||
| H-P | 320 | \(\mathrm{N≡N}) | 946 | Si-Br | 290 | ||
| H-S | 340 | N-O | 200 | Si-I | 215 | ||
| H-Cl | 432 | N-F | 270 | P-P | 215 | ||
| H-Br | 370 | N-P | 210 | P-S | 230 | ||
| H-I | 295 | N-Cl | 200 | P-Cl | 330 | ||
| C-C | 345 | N-Br | 245 | P-Br | 270 | ||
| \(\mathrm{C=C}) | 611 | O-O | 140 | P-I | 215 | ||
| \(\mathrm{C≡C}) | 837 | (\mathrm{O=O}) | 498 | S | 215 | ||
| C-N | 290 | O-F | 160 | S-Cl | 250 | ||
| \(\mathrm{C=N}) | 615 | O-Si | 370 | S-Br | 215 | ||
| \(\mathrm{C≡N}) | 891 | O-P | 350 | Cl | 243 | ||
| C-O | 350 | O-Cl | 205 | Cl-Br | 220 | ||
| \(\mathrm{C=O}) | 741 | O-I | 200 | Cl-I | 210 | ||
| \(\mathrm{C≡O}) | 1080 | F | 160 | Br-Br | 190 | ||
| C-F | 439 | F-Si | 540 | Br-I | 180 | ||
| C-Si | 360 | F-P | 489 | I | 150 | ||
| C-P | 265 | F-S | 285 |
| Bond | Lunghezza di legame (Å) | Energia di legame (kJ/mol) |
|---|---|---|
| C-C | 1.54 | 345 |
| \(\mathrm{C=C}) | 1.34 | 611 |
| \(\mathrm{C≡C}) | 1.20 | 837 |
| C-N | 1.43 | 290 |
| \(\mathrm{C=N}) | 1.38 | 615 |
| \(\mathrm{C≡N}) | 1.16 | 891 |
| C-O | 1.43 | 350 |
| \(\mathrm{C=O}) | 1.23 | 741 |
| \(\mathrm{C≡O}) | 1.13 | 1080 |
Possiamo usare le energie di legame per calcolare cambiamenti entalpici approssimativi per reazioni dove non sono disponibili entalpie di formazione. Calcoli di questo tipo ci diranno anche se una reazione è esotermica o endotermica.
- Una reazione esotermica (ΔH negativo, calore prodotto) risulta quando i legami nei prodotti sono più forti di quelli nei reagenti.
- Una reazione endotermica (ΔH positivo, calore assorbito) risulta quando i legami nei prodotti sono più deboli di quelli nei reagenti.
La variazione di entalpia, ΔH, per una reazione chimica è approssimativamente uguale alla somma dell’energia richiesta per rompere tutti i legami nei reagenti (energia “in”, segno positivo) più l’energia rilasciata quando tutti i legami sono formati nei prodotti (energia “out”, segno negativo). Questo può essere espresso matematicamente nel modo seguente:
\
In questa espressione, il simbolo \(\Sigma\) significa “la somma di” e D rappresenta l’energia di legame in chilojoule per mole, che è sempre un numero positivo. L’energia di legame si ottiene da una tabella e dipenderà dal fatto che il particolare legame è un legame singolo, doppio o triplo. Quindi, nel calcolare le entalpie in questo modo, è importante considerare il legame in tutti i reagenti e prodotti. Poiché i valori di D sono tipicamente medie per un tipo di legame in molte molecole diverse, questo calcolo fornisce una stima approssimativa, non un valore esatto, per l’entalpia di reazione.
Considera la seguente reazione:
o
\
Per formare due moli di HCl, una mole di legami H-H e una mole di legami Cl-Cl deve essere rotta. L’energia richiesta per rompere questi legami è la somma dell’energia del legame H-H (436 kJ/mol) e del legame Cl-Cl (243 kJ/mol). Durante la reazione, si formano due moli di legami H-Cl (energia di legame = 432 kJ/mol), rilasciando 2 × 432 kJ; o 864 kJ. Poiché i legami nei prodotti sono più forti di quelli nei reagenti, la reazione rilascia più energia di quella che consuma:
-2D_{H-Cl}}\\7367>&=\mathrm{-2(432)=-185\:kJ}
fine {align*}]
Questa energia in eccesso viene rilasciata come calore, quindi la reazione è esotermica. La tabella T2 dà un valore per l’entalpia molare standard di formazione di HCl(g), \(ΔH^\circ_\ce f\), di -92,307 kJ/mol. Il doppio di questo valore è -184,6 kJ, che concorda bene con la risposta ottenuta in precedenza per la formazione di due moli di HCl.
Esempio \(\PageIndex{1}): Usare le energie di legame per approssimare le variazioni di entalpia
Il metanolo, CH3OH, può essere un eccellente carburante alternativo. La reazione ad alta temperatura di vapore e carbonio produce una miscela di gas monossido di carbonio, CO, e idrogeno, H2, da cui può essere prodotto il metanolo. Usando le energie di legame nella tabella \(\PageIndex{2}}), calcola il cambiamento entalpico approssimativo, ΔH, per la reazione qui:
Soluzione
Prima, dobbiamo scrivere le strutture di Lewis dei reagenti e dei prodotti:
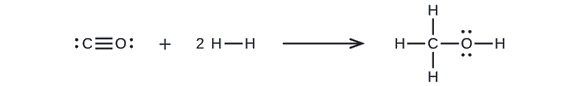
Da questo, vediamo che ΔH per questa reazione coinvolge l’energia richiesta per rompere un triplo legame C-O e due legami singoli H-H, così come l’energia prodotta dalla formazione di tre legami singoli C-H, un legame singolo C-O, e un legame singolo O-H. Possiamo esprimere questo come segue (attraverso l’equazione EQ3}):
\-}
{align*}\end]
Utilizzando i valori di energia di legame nella tabella \(\PageIndex{2}), otteniamo:
&=\ce{-107\:kJ}
fine {align*}]
Possiamo confrontare questo valore con quello calcolato in base ai dati \(ΔH^\circ_\ce f\) dell’Appendice G:
fine {align*}]
Nota che c’è un divario abbastanza significativo tra i valori calcolati usando i due diversi metodi. Questo accade perché i valori D sono la media di diverse forze di legame; quindi, spesso danno solo un accordo approssimativo con altri dati.
Esercizio \(\PageIndex{1})
L’alcol etilico, CH3CH2OH, è stato uno dei primi prodotti chimici organici sintetizzati deliberatamente dall’uomo. Ha molti usi nell’industria, ed è l’alcol contenuto nelle bevande alcoliche. Può essere ottenuto dalla fermentazione dello zucchero o sintetizzato dall’idratazione dell’etilene nella seguente reazione:

Utilizzando le energie di legame nella tabella \(\PageIndex{2}), calcola una variazione entalpica approssimativa, ΔH, per questa reazione.
Sommario
Video \(\PageIndex{2}}}: Un ripasso dei legami atomici.
I legami covalenti si formano quando gli elettroni sono condivisi tra gli atomi e sono attratti dai nuclei di entrambi gli atomi. Nei legami covalenti puri, gli elettroni sono condivisi equamente. Nei legami covalenti polari, gli elettroni sono condivisi in modo disuguale, poiché un atomo esercita una forza di attrazione sugli elettroni più forte dell’altro.
La forza di un legame covalente è misurata dalla sua energia di dissociazione del legame, cioè la quantità di energia richiesta per rompere quel particolare legame in una mole di molecole. I legami multipli sono più forti dei legami singoli tra gli stessi atomi. L’entalpia di una reazione può essere stimata sulla base dell’energia richiesta per rompere i legami e l’energia rilasciata quando si formano nuovi legami.
Equazioni chiave
- Energia di legame per una molecola biatomica: \(\ce{XY}(g)⟶\ce{X}(g)+\ce{Y}(g)\hspace{20px}\ce{D_{X–Y}}=ΔH°\)
- Enthalpy change: ΔH = Ʃ legami rotti – Ʃ legami formati
Note
- Questa domanda è tratta dal Chemistry Advanced Placement Examination ed è utilizzata con il permesso dell’Educational Testing Service.
Glossario
energia di legame (anche, energia di dissociazione del legame) energia richiesta per rompere un legame covalente in una sostanza gassosa
Contributori
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) e Richard Langley (Stephen F. Austin State University) con gli autori che hanno contribuito. Il contenuto del libro di testo prodotto da OpenStax College è concesso in licenza Creative Commons Attribution License 4.0. Scarica gratuitamente a http://cnx.org/contents/85abf193-2bd…[email protected]).
- Adelaide Clark, Oregon Institute of Technology
- Fuse School, Open Educational Resource gratuito, sotto una Licenza Creative Commons: Attribuzione-Non commerciale CC BY-NC (Visualizza l’atto di licenza: https://creativecommons.org/licenses/by-nc/4.0/)
- Crash Course Chemistry: Crash Course è una divisione di Complexly e i video sono gratuiti per lo streaming a scopo educativo.
Feedback
Hai un feedback da dare su questo testo? Clicca qui.
Hai trovato un errore di battitura e vuoi un credito extra? Clicca qui.