Che cos’è il cobalto
Il cobalto (pronuncia: KO-bolt) è un elemento duro, lucente e argenteo appartenente al gruppo dei metalli di transizione, ed è rappresentato dal simbolo chimico Co . È chimicamente attivo e può formare molti composti. È un metallo ferromagnetico che può essere magnetizzato ed è legato con nichel e alluminio per produrre potenti magneti.

Simbolo del cobalto
Isotopi
Ha un isotopo stabile, presente in natura, 59Co e 28 radioisotopi di cui i più stabili sono 60Co, 57Co, 56Co e 58Co con emivite di 5,2714 anni, 271,8 giorni, 77,27 giorni e 70,86 giorni rispettivamente. I periodi di emivita dei suoi altri radioisotopi sono meno di 18 ore.
Dove si trova il cobalto
Il cobalto si trova naturalmente in combinazione con altri elementi nei minerali come la cobaltite (un solfuro contenente cobalto, arsenico, ferro e nichel), l’eritrite (arsenato di cobalto idrato) e la skutterudite (arsenato di cobalto). Si ottiene generalmente come sottoprodotto dell’estrazione del rame e del nichel.
I noduli di manganese trovati sui fondali oceanici sono enormi riserve di metalli di transizione, contenenti tonnellate di cobalto. I primi 3 paesi detentori di riserve di cobalto sono la Repubblica Democratica del Congo (RDC), l’Australia e Cuba, mentre i primi 3 produttori sono RDC, Cina e Zambia.

Cobalto
Storia
Origine del suo nome: Il nome deriva da ‘kobald’, tedesco per “folletto” e da ‘cobalos’, una parola greca che significa “miniera”.
Chi lo ha scoperto: L’elemento fu trovato dal chimico e mineralogista svedese Georg Brandt .
Quando e come fu scoperto
La tomba di Tutankhamon, l’antico faraone egiziano che regnò durante il 1361-1352 a.C., aveva un oggetto di vetro blu profondo che era fatto di cobalto . In Cina, il blu di cobalto era usato per fare smalti per ceramiche.
A parte le sue origini antiche, la sua scoperta in tempi recenti risale agli anni 1730 quando Georg Brandt si interessò a un minerale blu di alcune miniere locali. Infine, riuscì a dimostrare che il minerale blu conteneva un nuovo metallo. Descrisse le sue proprietà e pubblicò i risultati nel 1739.
La sua scoperta fu controversa, poiché altri chimici contestarono le sue scoperte per molti anni. Tuttavia, il suo collega chimico svedese Torbern Bergman condusse ulteriori studi e confermò la scoperta di Georg Brandt nel 1780.
Identificazione del cobalto |
|||
| Numero atomico | 27 | ||
| Numero CAS | 7440-48-4 | ||
| Posizione nella tavola periodica | Gruppo | Periodo | Blocco |
| 9 | 4 | d | |
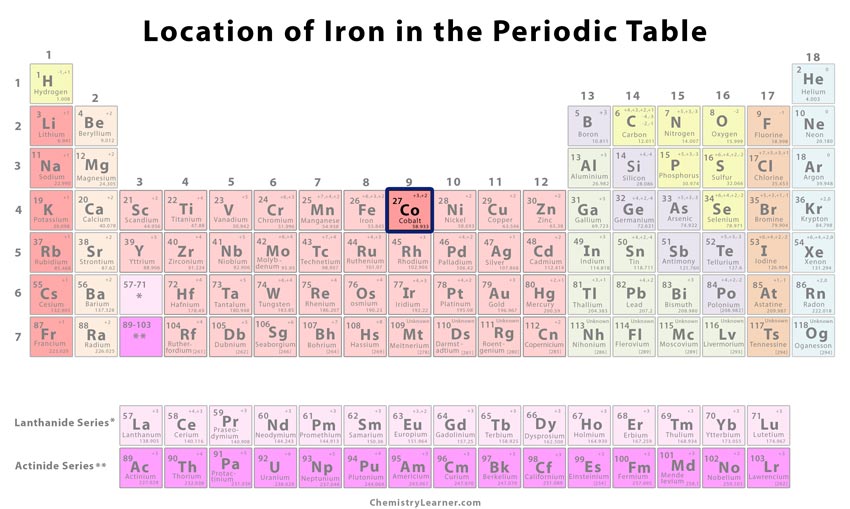
dove si trova il cobalto sulla tavola periodica
Proprietà e caratteristiche del cobalto
Proprietà generali |
||||||||||||||||
| Massa atomica relativa | 58.933 | |||||||||||||||
| Massa atomica | 58.933 amu | |||||||||||||||
| Massa molecolare | 58.9331950 ± 0.0000050 g/mol | |||||||||||||||
| Peso molecolare | 58.933 g/mol | |||||||||||||||
Proprietà fisiche |
||||||||||||||||
| Colore | Blu-argento, bianco-bluastro | |||||||||||||||
| Punto di fusione/congelamento | 1495 °C, 2723 °F | |||||||||||||||
| Punto di ebollizione | 2927 °C, 5301 °F | |||||||||||||||
| Densità | 8.86 g cm-3 | |||||||||||||||
| Stato della materia a temperatura ambiente (solido/liquido/gas) | Solido | |||||||||||||||
| Durezza | ||||||||||||||||
| – Brinell | 700 MPa | |||||||||||||||
| – Mohs | 5 | |||||||||||||||
| – Vickers | 1043 MPa | |||||||||||||||
| Conducibilità elettrica | 1.7 X 107 S/m | |||||||||||||||
| Carica ionica | 3+ | |||||||||||||||
| Conducibilità termica (calore) | 100 W/(m K) | |||||||||||||||
| Calore specifico | 421 J kg-1 K-1 | |||||||||||||||
| Modulo di massa | ignoto | |||||||||||||||
| Modulo di taglio | ignoto | |||||||||||||||
| Modulo di Young | Sconosciuto | |||||||||||||||
| Pressione di vapore | ||||||||||||||||
| – Temperatura (K) | 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 | 2200 | 2400 | |||||
| – Pressione (Pa) | – | – | – | 2.09 X 10-10 | 1,00 X 10-6 | 4,19 X 10-4 | 0,0379 | 1.15 | 16 | – | – | |||||
Proprietà chimiche |
||||||||||||||||
| Stato di ossidazione | 3, 2, 0, -1 | |||||||||||||||
| Isotopi | Isotopo | Massa | Abbondanza (%) | Età media | Modo di decadimento | |||||||||||
| 59Co | 58.933 | 100 | – | – | ||||||||||||
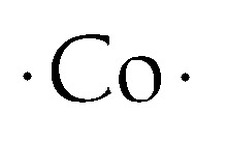
Struttura a punti di Lewis del cobalto
Dati atomici del cobalto (elemento 27)
| Elettroni di valenza | 9 | |||||||
| Numeri quantici | ||||||||
| – n | 3 | |||||||
| – ℓ | 2 | |||||||
| – mℓ | -1 | |||||||
| – ms | -1/2 | |||||||
| Configurazione degli elettroni (configurazione dei gas nobili) | 3d74s2 | |||||||
| Struttura atomica | ||||||||
| – Numero di elettroni | 27 | |||||||
| – Numero di neutroni | 32 | |||||||
| – Numero di protoni | 27 | |||||||
| Raggio dell’atomo | ||||||||
| – Raggio atomico | 2.00 Å | |||||||
| – Raggio covalente | 1,18 Å | |||||||
| Elettronegatività (scala Pauling) | 1,88 | |||||||
| Affinità degli elettroni | 63.873 kJ mol-1 | |||||||
| Energia di ionizzazione (kJ mol-1) | 1° | 2° | 3° | 4° | 5° | 6° | 7° | 8° |
| 760.402 | 1648.356 | 3232.3 | 4949.7 | 7670.6 | 9842 | 12437 | 15225.4 | |
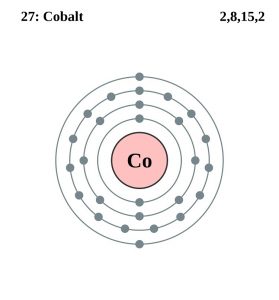
Configurazione degli elettroni di cobalto (modello Bohr)
A cosa serve il cobalto
- Il cobalto è legato per l’uso in generatori di turbine a gas e turbine a reazione per la sua resistenza alle alte temperature e alla corrosione.
- Il cobalto viene occasionalmente utilizzato nella galvanoplastica per la sua durezza e l’aspetto attraente.
- E’ comunemente usato come materiale catodico nelle batterie agli ioni di litio.
- I sali di cobalto sono usati per conferire colori blu intensi in vetro, porcellana, ceramica, smalti e vernici.
- Il 60Co radioattivo è usato per il trattamento del cancro e nell’irradiazione alimentare per controllare gli agenti patogeni e prolungare la durata di conservazione.
- Le superleghe di stellite, composte da cromo, cobalto e tungsteno, sono usate per fare utensili da taglio resistenti alle alte temperature e all’usura
Tossicità del cobalto ed effetti sulla salute
L’avvelenamento da cobalto può avvenire quando si ingerisce accidentalmente, si respira o si ha contatto con la pelle in grandi quantità. In grandi quantità, il cobalto può essere cancerogeno nell’uomo e in alcuni animali.
Si trova in tracce nell’uomo ed è un componente essenziale della vitamina B12. Piccole dosi di cobalto sono anche dati ad alcuni animali per prevenire carenze minerali in loro.

Minerale di cobalto (Cobaltite)
Fatti interessanti
- Il cobalto è rappresentato graficamente da un ‘kobold’ o goblin (considerato fastidioso dai minatori tedeschi medievali) con alcune porcellane cinesi sullo sfondo, in riferimento al suo uso come smalto per ceramica nell’antica Cina.
- Il cobalto può mantenere le sue proprietà magnetiche fino a una temperatura (punto di Curie) di 1.121 °C (2049.8 °F), il più alto di tutti gli elementi ferromagnetici .
- Nel 2010, gli scienziati tedeschi hanno utilizzato un atomo di cobalto per catturare le prime immagini di spin cambiando .
Prezzo del cobalto
Il costo del cobalto puro è di circa $ 0,21 al grammo, e in massa, costa circa $ 0.044 al grammo.
- http://www.rsc.org/periodic-table/element/27/cobalt
- https://education.jlab.org/itselemental/ele027.html
- https://www.livescience.com/29275-cobalt.html
- https://www.chemicool.com/elements/cobalt.html
- https://education.jlab.org/itselemental/iso027.html
- https://www.webqc.org/molecular-weight-of-Co%28cobalt%29.html
- https://pubchem.ncbi.nlm.nih.gov/compound/cobalt#section=Top
- http://periodictable.com/Elements/027/data.html
- http://www.gpb.org/files/pdfs/gpbclassroom/chemistry/ionicChargesChart.pdf
- http://dwb4.unl.edu/Chem/CHEM869B/CHEM869BLinks/learn.chem.vt.edu/tutorials/bonding/valence.html
- http://chemistry-reference.com/q_elements.asp?Symbol=Co&language=en
- https://medlineplus.gov/ency/article/002495.htm