Ogni elettrone in un atomo può essere identificato univocamente da un insieme di quattro numeri quantici.

Anche se la loro scoperta ha richiesto una matematica avanzata, sono tutti numeri convenzionali: tre di essi possono assumere solo valori interi semplici; il quarto è una frazione semplice.
I primi tre numeri quantici derivano dalla funzione d’onda, Ψ, ottenuta risolvendo l’equazione di Schrödinger.
Il quarto numero quantico, lo spin dell’elettrone, deriva dalla scoperta che gli elettroni hanno due possibili orientamenti.
I numeri e le loro definizioni sono i seguenti:
I numeri quantici
| Numero quantico | Nome | Valori possibili | Informazione |
|---|---|---|---|
| n | numero quantico principale | 1, 2, 3,…, n | Definisce il guscio energetico occupato dall’elettrone. I gusci più vicini al nucleo hanno il valore più basso di n e l’energia potenziale più bassa.n è il primo numero scritto nelle configurazioni elettroniche come quella del magnesio: 1s2 2s2 2p6 3s2 |
| l | numero quantico di momento angolare orbitale (chiamato anche numero quantico azimutale) |
0, 1, 2,…, (n-1) | Definisce il sottoguscio di energia – nei sistemi con più di un elettrone, i sottogusci hanno energie diverse. l definisce la lettera del sottoguscio nelle configurazioni elettroniche. Per esempio: 1s2 2s2 2p6 3s2 l = 0 dà un sottoguscio s. l = 1 dà un sottoguscio p. l = 2 dà un sottoguscio d, ecc. |
| ml | numero quantico magnetico | -l, (l+1), …, 0,… , (l+1), l | Definisce l’orientamento dell’orbitale di sottoguscio. Il sottoguscio p, con l = 1, ha tre valori ml: -1, 0, 1. Questi indicano che esistono tre orbitali p, cioè gli orbitali px, py e pz. Il sottoguscio d, con l = 2, ha cinque valori ml: -2, -1, 0, 1, 2.Questi indicano che esistono cinque orbitali d. |
| ms | numero quantico di spin degli elettroni | -½ o +½ | Gli elettroni hanno due possibili orientamenti di spin. |
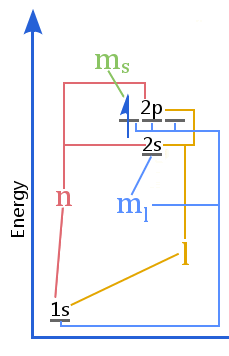
Il diagramma dei livelli energetici mostra la relazione tra i numeri quantici e i gusci, i sottogusci, gli orbitali e lo spin degli elettroni in un atomo.Ogni elettrone può essere identificato univocamente dal suo numero quantico – vedi il principio di esclusione di Pauli.
Le forme degli orbitali non sono date dai numeri quantici, ma sono densità di probabilità – mappe tridimensionali dello spazio intorno al nucleo dove un elettrone si troverà il 99% delle volte.Le forme degli orbitali sono ottenute dal quadrato della funzione d’onda, Ψ2.La posizione precisa e la quantità di moto di qualsiasi elettrone non possono mai essere conosciute – vedi il principio di indeterminazione di Heisenberg.
