Introduzione
I meningiomi sono la più comune neoplasia primaria del sistema nervoso centrale (SNC) e rappresentano oltre il 37% di tutti i tumori cerebrali primari (1). Le opzioni di gestione dei meningiomi includono l’osservazione, la chirurgia e la radioterapia (2, 3). Mentre una minoranza di meningiomi sono aggressivi, compresi i gradi II e III dell’Organizzazione Mondiale della Sanità (OMS), oltre l’80% sono di grado I dell’OMS e sono spesso chiamati “benigni” (4). Tuttavia, anche i meningiomi di grado I dell’OMS possono recidivare, con studi precedenti che hanno evidenziato un tasso di recidiva fino al 47% con un follow-up a lungo termine (4, 5). La recidiva del meningioma richiede spesso un trattamento con un ulteriore intervento chirurgico o una radioterapia di salvataggio, con conseguente potenziale morbilità (6, 7). Di conseguenza, la capacità di prevedere la recidiva è una componente cruciale della gestione del meningioma di grado I dell’OMS per formulare raccomandazioni sulla frequenza delle immagini di sorveglianza o sull’uso della radioterapia adiuvante.
Oltre al grado Simpson raggiunto alla resezione, una serie di caratteristiche del tumore sono state valutate come possibili predittori di recidiva, con particolare attenzione ai risultati istopatologici (8). Questi includono l’indice MIB-1 (un marcatore di proliferazione cellulare), l’invasione cerebrale e la presenza di caratteristiche istologiche atipiche, tra cui l’aumento della cellularità, il rivestimento, i focolai di necrosi spontanea e l’atipia nucleare (9-13). Infatti, le classificazioni OMS del 2016 utilizzano esclusivamente i risultati patologici per determinare il grado del tumore con il grado II definito dall’invasione cerebrale e dall’aumento delle mitosi su 4/10 di campo ad alta potenza (HPF) (4). Inoltre, tre caratteristiche atipiche determinano insieme un aumento del grado del tumore (4). Guardando al futuro, le caratteristiche molecolari del meningioma sono state recentemente associate al rischio di recidiva e saranno probabilmente utilizzate nella classificazione del meningioma in futuro (14-16).
Mentre le classificazioni dell’OMS sintetizzano la letteratura disponibile per creare chiari delineatori tra i gradi del tumore, la letteratura che circonda il meningioma di grado I dell’OMS rimane mista. Per esempio, mentre l’invasione cerebrale da sola può comportare un aumento del grado del tumore dal grado I-II dell’OMS, una serie di studi successivi non ha trovato una relazione tra invasione cerebrale e recidiva, evidenziando la necessità di ulteriori ricerche sui fattori predittivi di recidiva (10, 17, 18). Anche l’utilità dell’indice MIB-1 nel predire la recidiva del meningioma è controversa; uno studio sui meningiomi di grado I dell’OMS ha suggerito solo un rischio di recidiva più elevato con un indice MIB-1 di >3%, ma altra letteratura che include tutti i gradi dell’OMS ha dimostrato una maggiore incidenza di recidiva a >5% o >10% (9-11). Studi precedenti hanno anche proposto un cutoff MIB-1 di >3% solo in pazienti con una resezione Simpson II o III, dimostrando ulteriormente la varietà dei cutoff MIB-1 e il loro utilizzo (13). In confronto, un numero limitato di studi ha indagato l’impatto delle caratteristiche atipiche nella recidiva del meningioma di grado I dell’OMS; anche se, hanno suggerito un maggior rischio di recidiva nei tumori di grado I dell’OMS che mostrano caratteristiche atipiche all’analisi patologica (9).
Quindi, l’obiettivo di questo studio è stato quello di indagare i predittori clinici, radiografici e patologici della recidiva nei meningiomi di grado I dell’OMS. Data la mancanza di consenso sull’uso del MIB-1 nei meningiomi di grado I dell’OMS, utilizziamo anche l’analisi di partizione ricorsiva per identificare un cutoff clinicamente rilevante per l’indice MIB-1. Identifichiamo poi i predittori di recidiva precoce e post-mediana nei tumori di grado I dell’OMS.
Metodi
Popolazione di pazienti
I pazienti sottoposti a trattamento per un meningioma di grado I dell’OMS dal 2007 al 2017 sono stati identificati retrospettivamente utilizzando un database istituzionale. Questo studio è stato formalmente approvato dalla University of California, San Francisco Institutional Review Board (IRB#13-12587). Sono stati esclusi i pazienti senza valori dell’indice MIB-1 disponibili nella cartella clinica elettronica. All’inizio del periodo di studio, il MIB-1 è stato ottenuto a discrezione del neuropatologo curante, ma, con il passare del tempo, il MIB-1 è stato ottenuto su tutti i pazienti con meningioma di grado I dell’OMS.
Dati clinici
Le caratteristiche demografiche, cliniche e di trattamento dei pazienti, i dati istopatologici e gli esiti clinici sono stati rivisti e raccolti retrospettivamente. I dati clinici raccolti comprendevano l’età del paziente, il sesso, il Karnofsky Performance Status (KPS) al momento del trattamento, la presentazione clinica e la precedente storia di trattamento del meningioma. I dati istopatologici includevano l’indice MIB-1, il rivestimento/perdita di architettura, l’aumento della cellularità, la necrosi, l’atipia nucleare e la presenza di invasione ossea. I risultati della colorazione del recettore del progesterone (PR), dell’antigene di membrana epiteliale (EMA), del CD34, della S100, della proteina fibrillare e acida gliale (GFAP) sono stati raccolti quando disponibili. I dati patologici sono stati estratti dal rapporto patologico generato al momento dell’intervento chirurgico. La posizione del tumore, le dimensioni e la presenza di edema peritumorale preoperatorio sono stati determinati utilizzando la risonanza magnetica preoperatoria. Sono stati raccolti i diametri anteriore-posteriore (AP), superiore-inferiore (SI) e trasversale (TV). Il volume tumorale preoperatorio è stato calcolato utilizzando l’equazione per il volume tumorale non sferico. Il tipo di trattamento è stato raccolto in modo simile. Il grado Simpson è stato determinato attraverso il rapporto operativo. La resezione totale lorda (GTR) e subtotale (STR) sono state determinate utilizzando le scansioni post-operatorie di risonanza magnetica (MRI).
I risultati primari di interesse erano la recidiva del tumore e il tempo alla recidiva. La recidiva è stata determinata sulla radiografia post-operatoria come una recidiva locale o una progressione del tumore residuo. Il tempo alla recidiva è stato determinato a partire dalla data del trattamento del paziente. La durata del follow-up è stata calcolata dalla data del trattamento all’ultima visita presso la clinica neurochirurgica. Gli esiti secondari includevano la recidiva precoce e post-mediana. La recidiva precoce è stata definita come entro 2 anni dal trattamento iniziale (19). La recidiva post-mediana è stata definita come verificatasi >2 anni dopo il trattamento iniziale.
Analisi statistica
Il chi-quadrato e il test t di Student sono stati utilizzati per il confronto delle variabili categoriche e continue, rispettivamente. Un modello di regressione di Cox multivariato con verosimiglianza all’indietro per la recidiva è stato costruito utilizzando le variabili con p < 0,200 sull’analisi univariata. Allo stesso modo, sono stati costruiti modelli logistici binari multivariati backward likelihood per prevedere la recidiva precoce e post-mediana utilizzando le variabili con p < 0.200 sull’analisi univariata. L’analisi di partizione ricorsiva (RPA) è stata utilizzata per identificare ulteriormente i fattori di rischio chiave della recidiva complessiva, precoce e post-mediana del meningioma. Un p < 0,050 è stato usato come soglia di significatività statistica. Tutte le analisi statistiche sono state eseguite con SPSS 26.
Risultati
Demografia complessiva dei pazienti e risultati clinici
La demografia complessiva dei pazienti, le caratteristiche istopatologiche e i risultati clinici possono essere visti nella tabella 1. In totale, 239 pazienti con meningiomi di grado WHO I sono stati inclusi nello studio. L’età media era di 60,0 anni e il 69,5% dei pazienti era di sesso femminile. Il sintomo di presentazione più comune era il mal di testa (30,5%), seguito da un deficit neurologico focale (27,6%). La maggior parte dei pazienti è stata sottoposta alla sola chirurgia (98,3%), con 2 pazienti che hanno ricevuto trattamenti di radioterapia adiuvante (0,8%) o gamma knife (0,8%). L’edema peritumorale era presente sulla risonanza magnetica preoperatoria del 38,1% dei pazienti. Il volume tumorale medio calcolato era di 30,6 cm3 (range = 0,23-215,73 cm3), e la dimensione media del tumore più grande era di 3,8 cm (range = 0,6-11,3 cm). Nel complesso, 91 (38,1%) tumori erano situati sulla base cranica, 57 (23,8%) erano tumori della convessità, 43 (18,0%) avevano una posizione falx/parasagittale, e 55 (23,0%) avevano un’altra posizione. La maggior parte dei pazienti ha ricevuto una resezione totale lorda (63,6%). L’incidenza della resezione Simpson I, II, III e IV era rispettivamente del 31,4, 29,7, 2,5 e 35,6%. Le caratteristiche atipiche erano presenti in un certo numero di pazienti; le caratteristiche atipiche più comuni erano l’invasione ossea (18,0%) e il rivestimento/perdita di architettura (8,4%). Il follow-up medio era di 41,1 mesi (range: 0-147 mesi).
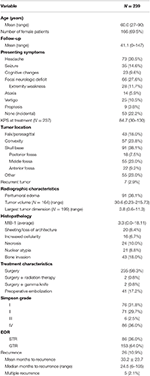
Tabella 1. Caratteristiche dei pazienti, caratteristiche istopatologiche, radiografia ed esiti.
Predittori di recidiva del meningioma di grado I dell’OMS
Un totale di 26 pazienti è recidivato con un tempo mediano alla recidiva di 24,5 mesi (Tabella 1). Un confronto tra i pazienti con una recidiva e quelli senza si trova nella tabella 2. Non c’era differenza di età (60.2 vs. 58.8, p = 0.582) o di sesso femminile (61.5 vs. 70.4%, p = 0.353) tra i pazienti con tumori recidivanti e quelli non recidivanti. Le caratteristiche del trattamento erano simili tra i gruppi, con la maggior parte dei pazienti in ogni gruppo che ricevevano solo la chirurgia (100,0 vs. 98,1%, p = 1,000). Tuttavia, i pazienti con tumori ricorrenti avevano una maggiore incidenza di STR (61,5 vs. 32,7%, p = 0,004) e una minore incidenza di resezione di grado Simpson I (11,5 vs. 34,1%, p = 0,019). L’incidenza dell’edema peritumorale, le dimensioni e il volume del tumore erano simili tra i gruppi. All’analisi istopatologica, i pazienti con recidiva tendevano verso una maggiore atipia nucleare (19,2 vs. 7,5%, p = 0,061). I pazienti con recidiva avevano anche un follow-up medio più alto (68,9 vs. 37,7 mesi, p = 0,001).
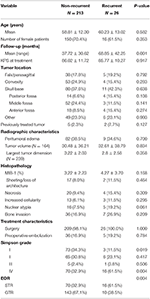
Tabella 2. Confronto tra pazienti con meningiomi ricorrenti vs. meningiomi non ricorrenti.
Una successiva analisi di cox-regressione backward likelihood ha evidenziato una relazione indipendente tra recidiva e localizzazione del tumore della fossa posteriore (HR = 5..25, CI 1.71-16.17, p = 0.004), indice MIB-1 (HR = 1.18, CI 1.05-1.34, p = 0.008), atipia nucleare (HR = 5.24, CI 1.73-15.92, p = 0.003), e STR (HR = 5.66, CI 1.30-13.92, p < 0.001; Tabella 3). Le curve di Kaplan-Meier che evidenziano la sopravvivenza libera da recidiva per la posizione della fossa posteriore (p = 0,007), l’atipia nucleare (p = 0,137), l’estensione della resezione (p = 0,001), e MIB-1 >4,5% (p = 0,001) sono mostrate nelle figure 1A-D.
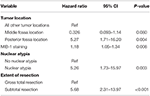
Tabella 3. Analisi di regressione di Cox per la recidiva.

Figura 1. Curve di Kaplan Meier dei fattori di rischio per la recidiva del meningioma di grado I WHO. (A) atipia nucleare (linea blu) vs. nessuna atipia nucleare (linea rossa) (X2 = 2.21, p = 0.137). (B) Posizione del tumore nella fossa posteriore (linea blu) rispetto ad altre posizioni (linea rossa) (X2 = 10.36, p = 0.001). (C) Indice MIB-1 >4,5% (linea blu) vs. ≤4,5% (linea rossa) (X2 = 6,17, p = 0,013). (D) STR (linea blu) vs. GTR (linea rossa) (X2 = 10.46, p = 0.001).
Predittori di recidiva precoce vs. post-mediana del meningioma di grado I dell’OMS
Un confronto tra i pazienti non recidivanti e i pazienti con tumori che si sono ripresentati precocemente o post-mediana è presentato nella tabella 4. I pazienti con una recidiva precoce avevano una maggiore incidenza di resezione subtotale (76.9 vs 32.7%, p = 0.001). Tendevano anche verso una maggiore incidenza di atipia nucleare (23.1 vs. 7.5%, p = 0.084) all’istopatologia (Tabella 4). I pazienti con una recidiva post-mediana tendevano verso una maggiore incidenza di localizzazione del tumore nella fossa posteriore (23.1 vs. 6.6%, p = 0.063) e una maggiore incidenza di invasione ossea (38.5 vs. 16.9%, p = 0.064) così come un più alto indice MIB-1 (5.55 vs. 3.22%, p = 0.098). Non c’era alcuna differenza significativa tra i tassi di Simpson grading o GTR nei pazienti con recidiva post-mediana rispetto ai pazienti non recidivanti (Tabella 4).
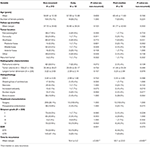
Tabella 4. Due modelli logistici binari multivariati a probabilità inversa sono stati utilizzati per identificare i predittori di recidiva precoce e post-mediana (Tabella 5). I predittori indipendenti di recidiva tumorale precoce includevano l’atipia nucleare all’istopatologia (OR = 6.45, CI 1.34-31.07, p = 0.020) e STR (OR = 8.92, CI 2.18-36.46, p = 0.002). L’unico predittore indipendente di recidiva post-mediana era l’indice MIB-1 (OR = 1,24, CI 1,05-1,45, p = 0,010), anche se la posizione della fossa posteriore si avvicinava alla significatività (OR = 4,42, CI 0,954-20,49, p = 0,058; Tabella 5).

Tabella 5. Modello logistico binario per la recidiva post-mediana e precoce del tumore.
Analisi ricorsiva del partizionamento della recidiva
RPA è stata eseguita per identificare i fattori di rischio chiave della recidiva del meningioma (Figura 2). Coerentemente con l’analisi di cox-regressione, STR era la prima partizione nel predire la recidiva complessiva: Il 18,6% dei pazienti con una resezione STR è recidivato rispetto al 6,5% con una GTR. Il successivo nodo decisionale all’interno dei soli pazienti GTR ha coinvolto un cutoff MIB-1 del 4,5%, poiché il 18,8% dei pazienti con un MIB-1 >4,5% è recidivato rispetto al 3,3% dei pazienti con un MIB-1 ≤4,5% (Figura 2A). Per quanto riguarda specificamente la recidiva post-mediana, la RPA ha identificato il primo nodo decisionale con un cutoff MIB-1 del 5,83%: Il 22,2% dei pazienti con MIB-1 >5,83% si è ripresentato contro il 3,3% dei pazienti con un MIB-1 ≤5,83%. Il successivo nodo decisionale ha utilizzato una localizzazione del tumore della fossa posteriore: Il 13,3% dei pazienti con un tumore della fossa posteriore si è ripresentato rispetto al 2,5% delle altre sedi tumorali (Figura 2B). La RPA per la recidiva precoce ha identificato l’estensione della resezione come nodo decisionale primario: L’11,6% dei pazienti con STR si è ripresentato rispetto al 2,0% dei pazienti con GTR. Il seguente nodo decisionale ha utilizzato la posizione falx o parasagittale: Il 36,4% dei tumori falx o parasagittali si è ripresentato contro l’8,1% delle altre sedi tumorali (Figura 2C).
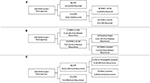
Figura 2. Analisi di partizione ricorsiva che evidenzia i fattori di rischio chiave per (A) la recidiva complessiva, (B) la recidiva post-mediana e (C) la recidiva precoce.
Discussione
Risultati chiave
La recidiva del meningioma di grado I dell’OMS è indipendentemente associata all’indice MIB-1, alla localizzazione posteriore della fossa tumorale, alla presenza di atipia nucleare e alla STR. Più specificamente, un indice MIB-1 del 4,5% è stato identificato come un cutoff clinicamente rilevante nella stratificazione del rischio per i pazienti con meningioma di grado I dell’OMS dopo la GTR. I pazienti con un indice MIB-1 >4,5% e GTR del loro meningioma di grado I WHO avevano un rischio di recidiva simile a quello dei pazienti con una STR. Ulteriori analisi hanno evidenziato il MIB-1 come fattore critico associato alla recidiva post-mediana, mentre l’estensione della resezione era il driver principale della recidiva precoce.
Predittori di recidiva del meningioma di grado I WHO
Studi precedenti hanno valutato in modo simile la relazione tra caratteristiche istopatologiche, caratteristiche cliniche e recidiva in tutti i gradi WHO di meningioma. In uno studio di 901 pazienti (716 WHO Grade I, 174 Grade II e 11 Grade III), Gousias et al. dimostrano un maggior rischio di recidiva nei meningiomi con un indice MIB-1 di >10%, un grado WHO più alto, dimensioni del tumore >6 cm, localizzazione petroclivale o del seno cavernoso e molteplicità (11). Tuttavia, Gousias et al. non hanno valutato la relazione tra la presenza di caratteristiche atipiche sull’istologia e la recidiva del tumore. Nei meningiomi di grado I dell’OMS in particolare, Marciscano et al. hanno utilizzato una coorte di 148 pazienti con meningioma di grado I dell’OMS con analisi patologica completa per identificare le variabili associate alla recidiva, con particolare attenzione all’impatto delle caratteristiche patologiche atipiche sul rischio di recidiva (9). È interessante notare che essi identificano la presenza di caratteristiche atipiche come un fattore di rischio indipendente oltre all’indice MIB-1 >3% e alla resezione Simpson. Il nostro studio evidenzia analogamente la GTR chirurgica e l’atipia nucleare, una caratteristica atipica, come predittori indipendenti di recidiva (tabella 3), anche se abbiamo valutato ogni caratteristica atipica in modo indipendente. Consideriamo anche la posizione del tumore nel nostro modello di cox-regressione, identificando ulteriormente la posizione della fossa posteriore del tumore come un fattore di rischio indipendente di recidiva. Mentre Marciscano et al. non hanno incluso la localizzazione del tumore nella loro analisi dei predittori di progressione, Gousias et al. dimostrano similmente la localizzazione petroclivale del tumore come fattore di rischio per la recidiva, anche se quando si considerano tutti i gradi di meningioma WHO (9, 11). Il maggior rischio di recidiva associato alla localizzazione della fossa posteriore può essere dovuto alla maggiore prevalenza di mutazioni NF2 nella fossa posteriore (14, 15, 20), anche se non siamo in grado di esplorare completamente questo dato che non eseguiamo abitualmente test genetici del meningioma nel nostro istituto. In ogni caso, ulteriori studi con coorti di pazienti con meningioma di grado I WHO più grandi sono necessari per indagare questa relazione.
Indice MIB-1 e recidiva di meningioma di grado I WHO
Similmente agli studi precedenti (9, 11, 13, 21) abbiamo anche valutato la relazione tra l’indice MIB-1 di un tumore e il suo rischio di recidiva. Abbiamo prima valutato l’indice MIB-1 in un modello di cox-regressione per la recidiva globale, come precedentemente discusso. In accordo con gli studi precedenti, abbiamo trovato che un indice MIB-1 più alto era indipendentemente associato a un aumento del rischio complessivo di recidiva. Date le discrepanze nei valori di cutoff per MIB-1 tra la letteratura e la variabilità interlaboratorio, abbiamo inizialmente valutato MIB-1 come una variabile continua. Abbiamo poi cercato di determinare il cutoff per l’indice MIB-1 nella nostra popolazione di pazienti utilizzando la RPA per modellare la recidiva complessiva, che ha identificato un valore cutoff di MIB-1 del 4,5% nei pazienti con GTR (Figura 2A). È interessante notare che questi pazienti avevano un rischio di recidiva simile a quello dei pazienti con una STR, dimostrando l’utilità del MIB-1 nei pazienti dopo la GTR. Perry et al. identificano analogamente un indice MIB-1 del 4,2% come associato alla recidiva dopo GTR su analisi univariata, anche se quando si considerano tutti i gradi di meningioma (22).
Il tasso di recidiva del 18,8% nei pazienti con una GTR e MIB-1 >4,5%, evidenzia la necessità di una stretta sorveglianza di questi pazienti o anche la considerazione della radioterapia adiuvante, a seconda delle preferenze del paziente. La radioterapia adiuvante dopo la resezione per il meningioma di grado I dell’OMS ha dimostrato di ridurre la recidiva, specialmente dopo la STR (23-25), anche se l’osservazione dopo la STR rimane la pratica standard (8). In uno studio su 92 meningiomi di grado I WHO, Soyuer et al. hanno dimostrato una sopravvivenza libera da progressione (PFS) del 91% nei pazienti che hanno ricevuto una radioterapia adiuvante dopo una STR, che era significativamente superiore al 38% di PFS nei pazienti che non avevano ricevuto radioterapia adiuvante (24). Poiché i pazienti del nostro studio con una STR avevano un rischio di recidiva simile a quelli con una GTR e MIB-1 >4,5%, la radioterapia adiuvante per entrambi i gruppi può essere ragionevole. Tuttavia, sono necessari studi più ampi per convalidare ulteriormente il nostro cutoff MIB-1 e le implicazioni cliniche associate. Sono necessari anche studi prospettici che indaghino l’uso della radioterapia adiuvante nei meningiomi di grado I dell’OMS.
Predittori di recidiva precoce e post-mediana del meningioma di grado I dell’OMS
Data la tendenza a una recidiva più tardiva nei pazienti con un MIB elevato >4.5% (Figura 1C), abbiamo quindi cercato di indagare le differenze nei predittori tra i pazienti che si sono ripresentati presto (definito come entro 2 anni dal trattamento) o post-mediana (quelli che si sono ripresentati >2 anni dopo il trattamento). Pochi studi in letteratura hanno indagato i predittori di recidiva precoce nei meningiomi. Uno studio di Budohoski et al. identifica la localizzazione parafalcale, la STR e l’edema peritumorale all’imaging radiografico come predittori di recidiva precoce in una coorte di 220 meningiomi atipici (26). Uno studio simile di Maillo et al., in meningiomi di grado I dell’OMS, utilizza l’ibridazione di fluorescenza in situ (FISH) e le caratteristiche patologiche per identificare i fattori di rischio per la recidiva precoce (definita come 2,5 anni dopo il trattamento) e ha trovato dimensioni maggiori del tumore, anomalie del cariotipo, età del paziente e anomalie del cromosoma 10 per essere associati a un aumento del rischio di recidiva (19). Tuttavia, gli autori non hanno considerato la presenza di atipia sulla patologia o l’indice MIB-1. Utilizzando una coorte di pazienti con meningioma di grado I dell’OMS con dati patologici e clinici più granulari, abbiamo identificato l’estensione della resezione e l’atipia nucleare sulla patologia come predittori indipendenti di recidiva precoce sulla modellazione di regressione logistica binaria (Tabella 5). La RPA ha rivelato allo stesso modo l’importanza dell’estensione della resezione nella stratificazione del rischio per i pazienti con recidiva precoce (Figura 2C). È interessante notare che ha anche evidenziato l’aumento del rischio associato alla localizzazione falx/parasagittale del tumore, corrispondente ai risultati di Budohoski et al. (26). L’unico predittore significativo di recidiva post-mediana del tumore sulla modellazione di regressione logistica binaria era l’indice MIB-1, anche se la posizione della fossa posteriore del tumore si avvicinava alla significatività. Questo è stato ulteriormente dimostrato su RPA (Figura 2B). Sorprendentemente, l’estensione della resezione non era un predittore indipendente di recidiva post-mediana, poiché la maggior parte delle recidive post-mediane era stata sottoposta a una GTR. Le recidive post-mediane possono evidenziare una categoria di meningioma di grado I dell’OMS che è molecolarmente più aggressiva e recidiva nonostante la GTR, dato il loro elevato indice MIB-1 e la posizione della fossa posteriore. Le recidive precoci sono significativamente più influenzate dall’estensione della resezione e, di conseguenza, probabilmente rappresentano la crescita continua del tumore residuo rispetto alla recidiva del precedente tumore completamente resecato, come visto nelle recidive post-mediane. Quindi, i nostri risultati rappresentano potenzialmente due diversi sottotipi di meningioma di grado I dell’OMS. Tuttavia, studi futuri con coorti di pazienti più grandi e dati molecolari del tumore sono necessari per indagare ulteriormente le differenze sottostanti nelle alterazioni molecolari tra recidive precoci e post-mediane.
Limitazioni
Le limitazioni del nostro studio includono la sua natura retrospettiva e la bassa incidenza di recidiva. Il nostro studio include anche pazienti che iniziano nel 2007 e, di conseguenza, abbraccia entrambi gli schemi di classificazione WHO CNS del 2007 e del 2016. Tuttavia, l’unico cambiamento significativo tra le due classificazioni è stata l’aggiunta dell’invasione cerebrale come unico criterio per lo stato di grado II dell’OMS. Solo due dei pazienti inclusi nella nostra coorte avevano un’invasione cerebrale notata sull’analisi patologica, e nessuno dei due pazienti si è ripresentato. Di conseguenza, non crediamo che l’inclusione dei pazienti classificati secondo lo schema di classificazione del 2007 abbia avuto un impatto significativo sui nostri risultati. Inoltre, il nostro studio si basa sui rapporti patologici dopo la resezione iniziale, senza una revisione centrale dei vetrini patologici. Questo può portare a una maggiore variabilità nelle variabili patologiche, come l’atipia nucleare e altri risultati patologici simili che possono dimostrare una variabilità interosservatore (27, 28). Tuttavia, il MIB-1 è una misura relativamente oggettiva con una minore variabilità inter-osservatore tra patologi che utilizzano lo stesso metodo all’interno di un laboratorio di patologia (29). Anche i modelli di pratica relativi al test MIB-1 sono cambiati durante il periodo dello studio, passando dalla preferenza del singolo patologo, che variava a seconda del patologo, al test in tutti i pazienti. I fattori considerati dai patologi quando hanno deciso di effettuare il test MIB-1 hanno incluso le caratteristiche atipiche incluse nel nostro studio, riducendo così il loro potenziale impatto sui nostri risultati. Inoltre, tutti i meningiomi inclusi nel nostro studio sono WHO Grade I. Di conseguenza, crediamo che qualsiasi bias introdotto nello studio basato su questi cambiamenti nei modelli di pratica sia minimo. Infine, mentre includiamo caratteristiche cliniche e patologiche dettagliate, la nostra coorte di pazienti manca di informazioni riguardanti i cambiamenti genetici e molecolari del tumore, che hanno dimostrato di avere un impatto significativo sugli esiti del tumore (15, 30-32). Pertanto, rimane la necessità di ulteriori grandi studi multi-istituzionali con dati molecolari/genetici in aggiunta alle tradizionali variabili patologiche e cliniche nel predire la recidiva globale dei meningiomi di grado I dell’OMS. Questo include la considerazione di prognosticatori molecolari/genetici, come i modelli di metilazione genome-wide (33, 34), mutazioni del promotore TERT (35), e ulteriori dati molecolari del tumore. Dati i nostri risultati, le indagini future sui predittori genetici/molecolari, clinici e patologici unici di recidive precoci e successive sono garantite anche, dato il potenziale impatto sul processo decisionale terapeutico da parte dei medici.
Nonostante, il nostro studio fornisce una visione dettagliata dei predittori clinici e istopatologici di recidiva, in particolare nei meningiomi di grado I dell’OMS. Inoltre, identifichiamo i pazienti con un MIB-1 >4,5% come ad alto rischio di recidiva dopo GTR. Sfruttiamo anche i nostri dati per fornire informazioni sulle differenze tra le recidive di meningioma di grado I dell’OMS precoce e post-mediano, identificando potenzialmente diversi sottogruppi molecolari di meningioma di grado I dell’OMS. I nostri risultati suggeriscono che i pazienti con un indice MIB-1 elevato e un’atipia nucleare all’analisi patologica, la posizione della fossa posteriore del loro tumore e la STR sono a più alto rischio di recidiva e dovrebbero essere considerati per un follow-up più attento o anche per una radioterapia adiuvante. Inoltre, i pazienti con un MIB-1 superiore al 4,5% sono a rischio di recidiva simile a quelli che hanno subito una STR dei loro tumori e dovrebbero anche essere potenzialmente considerati per una radioterapia adiuvante.
Conclusione
Si riscontra una scarsità di letteratura sui predittori specifici di recidiva nei meningiomi di grado I dell’OMS. I risultati di questo studio evidenziano la localizzazione del tumore nella fossa posteriore, l’indice MIB-1, l’atipia nucleare e l’estensione della resezione come indipendentemente associati alla recidiva dei meningiomi di grado I. Dimostriamo anche che i pazienti con un MIB-1 >4,5% e GTR hanno un rischio di recidiva simile ai pazienti con una STR. Infine, l’analisi differenziale delle recidive precoci e post-mediane ha rivelato l’associazione dell’indice MIB-1 e della localizzazione della fossa posteriore nelle recidive post-mediane, mentre le recidive precoci erano più significativamente influenzate dall’estensione della resezione. Sono necessari ulteriori studi che convalidino i nostri risultati e includano dati molecolari/genetici per identificare ulteriori predittori di recidiva nei meningiomi di grado I dell’OMS. Tali studi potrebbero fornire un quadro più accurato per stratificare il rischio dei pazienti e aiutare il processo decisionale terapeutico, compreso il potenziale per la radioterapia adiuvante.
Data Availability Statement
I dati grezzi che supportano le conclusioni di questo articolo saranno resi disponibili dagli autori, senza indebite riserve.
Ethics Statement
Gli studi che coinvolgono partecipanti umani sono stati esaminati e approvati dal UCSF Institutional Review Board. Il consenso informato scritto per la partecipazione non è stato richiesto per questo studio in conformità con la legislazione nazionale e i requisiti istituzionali.
Contributi degli autori
AH: concettualizzazione, metodologia, analisi formale, indagine, scrittura-bozza originale, scrittura-revisione e modifica, e visualizzazione. JY: concettualizzazione, metodologia, e scrittura-revisione ed editing. IK e SS: indagine. J-SC: visualizzazione e analisi formale. DR e MM: revisione scritta e editing. SM: revisione scritta e editing, concettualizzazione e metodologia. MA: revisione scritta, editing e supervisione. Tutti gli autori hanno contribuito all’articolo e hanno approvato la versione presentata.
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di qualsiasi relazione commerciale o finanziaria che potrebbe essere interpretata come un potenziale conflitto di interessi.
Il revisore BB ha dichiarato una co-autorità passata con gli autori DR, MM, e SM all’editore di gestione.
1. Ostrom QT, Cioffi G, Gittleman H, Patil N, Waite K, Kruchko C, et al. Rapporto statistico CBTRUS: cervello primario e altri tumori del sistema nervoso centrale diagnosticati negli Stati Uniti nel 2012-2016. Neuro Oncol. (2019) 21:v1-100. doi: 10.1093/neuonc/noz150
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Karsy M, Guan J, Cohen A, Colman H, Jensen RL. Gestione medica dei meningiomi. Stato attuale, trattamenti falliti e orizzonti promettenti. Neurosurg Clin N Am. (2016) 27:249-60. doi: 10.1016/j.nec.2015.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Brastianos PK, Galanis E, Butowski N, Chan JW, Dunn IF, Goldbrunner R, et al. Advances in multidisciplinary therapy for meningiomas. Neuro Oncol. (2019) 21:I18-31. doi: 10.1093/neuonc/noy136
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. Il 2016 World Health Organization classificazione dei tumori del sistema nervoso centrale: una sintesi. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Pettersson-Segerlind J, Orrego A, Lönn S, Mathiesen T. Follow-up a lungo termine 25 anni di meningiomi parasagittali trattati chirurgicamente. Mondo Neurosurg. (2011) 76:564-71. doi: 10.1016/j.wneu.2011.05.015
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Van Alkemade H, De Leau M, Dieleman EMT, Kardaun JWPF, Van Os R, Vandertop WP, et al. sopravvivenza ridotta e problemi neurologici a lungo termine nel meningioma benigno. Neuro Oncol. (2012) 14:658-66. doi: 10.1093/neuonc/nos013
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Buerki RA, Horbinski CM, Kruser T, Horowitz PM, James CD, Lukas RV. Una panoramica dei meningiomi. Futur Oncol. (2018) 14:2161-77. doi: 10.2217/fon-2018-0006
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Rogers L, Barani I, Chamberlain M, Kaley TJ, McDermott M, Raizer J, et al. Meningiomi: base di conoscenza, risultati del trattamento e incertezze. Una revisione RANO. J Neurosurg. (2015) 122:4-23. doi: 10.3171/2014.7.JNS131644
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Marciscano AE, Stemmer-Rachamimov AO, Niemierko A, Larvie M, Curry WT, Barker FG, et al. Meningiomi benigni (WHO Grade I) con caratteristiche istologiche atipiche: correlazione delle caratteristiche istopatologiche con esiti clinici. J Neurosurg. (2016) 124:106-14. doi: 10.3171/2015.1.JNS142228
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Baumgarten P, Gessler F, Schittenhelm J, Skardelly M, Tews DS, Senft C, et al. invasione del cervello in meningiomi altrimenti benigni non predice la recidiva del tumore. Acta Neuropathol. (2016) 132:479-81. doi: 10.1007/s00401-016-1598-1
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gousias K, Schramm J, Simon M. Il simpson grading rivisitato: chirurgia aggressiva e il suo posto nella gestione moderna del meningioma. J Neurosurg. (2016) 125:551-60. doi: 10.3171/2015.9.JNS15754
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Matsuno A, Fujimaki T, Sasaki T, Nagashima T, Ide T, Asai A, et al. Analisi clinica e istopatologica dei potenziali proliferativi dei meningiomi ricorrenti e non ricorrenti. Acta Neuropathol. (1996) 91:504-10. doi: 10.1007/s004010050458
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Oya S, Kawai K, Nakatomi H, Saito N. Significato del sistema di classificazione Simpson nella moderna chirurgia del meningioma: integrazione del grado con l’indice di etichettatura MIB-1 come chiave per prevedere la recidiva dei meningiomi WHO Grade I – articolo clinico. J Neurosurg. (2012) 117:121-8. doi: 10.3171/2012.3.JNS111945
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Yuzawa S, Nishihara H, Tanaka S. Paesaggio genetico di meningioma. Brain Tumor Pathol. (2016) 33:237-47. doi: 10.1007/s10014-016-0271-7
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Karsy M, Azab MA, Abou-Al-Shaar H, Guan J, Eli I, Jensen RL, et al. Potenziale clinico di intuizioni genomiche meningioma: una revisione pratica per neurochirurghi. Neurosurg Focus. (2018) 44:E10. doi: 10.3171/2018.2.FOCUS1849
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Patel AJ, Wan YW, Al-Ouran R, Revelli JP, Cardenas MF, Oneissi M, et al. Profilo molecolare predice recidiva meningioma e rivela la perdita di repressione complesso DREAM in tumori aggressivi. Proc Natl Acad Sci USA. (2019) 116:21715-26. doi: 10.1073/pnas.1912858116
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Spille DC, Heß K, Sauerland C, Sanai N, Stummer W, Paulus W, et al. Invasione cerebrale nei meningiomi: incidenza e correlazioni con variabili cliniche e prognosi. World Neurosurg. (2016) 93:346-54. doi: 10.1016/j.wneu.2016.06.055
PubMed Abstract | CrossRef Full Text | Google Scholar
18. PiŽem J, Velnar T, Prestor B, Mlakar J, Popović M. Invasione cerebrale valutabilità in meningiomi è legato alla dimensione del meningioma e il grado, e può essere migliorata da un ampio campionamento del campione meningioma rimosso chirurgicamente. Clin Neuropathol. (2014) 33:354-63. doi: 10.5414/NP300750
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Maillo A, Orfao A, Espinosa AB, Sayagués JM, Merino M, Sousa P, et al. Le recidive precoci in istologicamente benigni / grado I meningiomi sono associati con grandi tumori e la coesistenza di monosomia 14 e del (1p36) nel clone cellulare tumorale ancestrale. Neuro Oncol. (2007) 9:438-46. doi: 10.1215/15228517-2007-026
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Youngblood MW, Duran D, Montejo JD, Li C, Omay SB, Özduman K, Sheth AH, et al. Correlazioni tra sottogruppo genomico e caratteristiche cliniche in una coorte di più di 3000 meningiomi. J Neurosurg. (2019). doi: 10.3171/2019.8.jns191266. .
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Chen WC, Magill ST, Wu A, Vasudevan HN, Morin O, Aghi MK, et al. Caratteristiche istopatologiche predittive di controllo locale del meningioma atipico dopo chirurgia e radioterapia adiuvante. J Neurosurg. (2019) 130:443-50. doi: 10.3171/2017.9.JNS171609
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Perry A, Stafford SL, Scheithauer BW, Suman VJ, Lohse CM. Il significato prognostico di MIB-1, p53 e citometria di flusso del DNA in meningiomi primari completamente resecati. Cancer. (1998) 82:2262-9. doi: 10.1002/(SICI)1097-0142(19980601)82:11<2262::AID-CNCR23>3.0.CO;2-R
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Ohba S, Kobayashi M, Horiguchi T, Onozuka S, Yoshida K, Ohira T, et al. Risultato chirurgico a lungo termine e fattori prognostici biologici in pazienti con meningiomi della base cranica: articolo clinico. J Neurosurg. (2011) 114:1278-87. doi: 10.3171/2010.11.JNS10701
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Soyuer S, Chang EL, Selek U, Shi W, Maor MH, DeMonte F. Radioterapia dopo chirurgia per meningioma cerebrale benigno. Radiother Oncol. (2004) 71:85-90. doi: 10.1016/j.radonc.2004.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Park S, Cha YJ, Suh SH, Lee IJ, Lee KS, Hong CK, et al. Radioterapia adiuvante adattata al gruppo di rischio per il meningioma della base cranica di grado WHO I e II. J Cancer Res Clin Oncol. (2019) 145:1351-60. doi: 10.1007/s00432-019-02891-6
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Budohoski KP, Clerkin J, Millward CP, O’Halloran PJ, Waqar M, Looby S, et al. Predittori di progressione precoce di meningiomi atipici trattati chirurgicamente. Acta Neurochir. (2018) 160:1813-22. doi: 10.1007/s00701-018-3593-x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. De La Monte SM, Flickinger J, Linggood RM. Caratteristiche istopatologiche che predicono la recidiva di meningiomi dopo la resezione subtotale. Am J Surg Pathol. (1986) 10:836-43. doi: 10.1097/00000478-198612000-00002
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Backer-Grøndahl T, Moen BH, Torp SH. Lo spettro istopatologico dei meningiomi umani. Int J Clin Exp Pathol. (2012) 5:231-42.
PubMed Abstract | Google Scholar
29. Rezanko T, Akkalp AK, Tunakan M, Sari AA. Metodi di conteggio MIB-1 nei meningiomi e accordo tra i patologi. Anal Quant Cytol Histol. (2008) 30:47-52.
PubMed Abstract | Google Scholar
30. Pérez-Magán E, Campos-Martín Y, Mur P, Fiaño C, Ribalta T, García JF, et al. Alterazioni genetiche associate alla progressione e alla recidiva nei meningiomi. J Neuropathol Exp Neurol. (2012) 71:882-93. doi: 10.1097/NEN.0b013e31826bf704
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Linsler S, Kraemer D, Driess C, Oertel J, Kammers K, Rahnenführer J, et al. Determinazioni biologiche molecolari di progressione e recidiva del meningioma. PLoS ONE. (2014) 9:e94987. doi: 10.1371/journal.pone.0094987
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Barbera S, Miguel TS, Gil-Benso R, Muñoz-Hidalgo L, Roldan P, Gonzalez-Darder J, et al. cambiamenti genetici con valore prognostico in meningiomi istologicamente benigni. Clin Neuropathol. (2013) 32:311-7. doi: 10.5414/NP300580
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Gao F, Shi L, Russin J, Zeng L, Chang X, He S, et al. Metilazione del DNA nella trasformazione maligna dei meningiomi. PLoS ONE. (2013) 8:e54114. doi: 10.1371/journal.pone.0054114
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Vengoechea J, Sloan AE, Chen Y, Guan X, Ostrom QT, Kerstetter A, et al. Marcatori di metilazione del potenziale maligno nei meningiomi. J Neurosurg. (2013) 119:899-906. doi: 10.3171/2013.7.JNS13311
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Lu VM, Goyal A, Lee A, Jentoft M, Quinones-Hinojosa A, Chaichana KL. Il significato prognostico delle mutazioni del promotore TERT nel meningioma: una revisione sistematica e meta-analisi. J Neurooncol. (2019) 142:1-10. doi: 10.1007/s11060-018-03067-x
PubMed Abstract | CrossRef Full Text | Google Scholar