Introduction
Heart rate variability (HRV) analysis provides insights into autonomic regulation and the interactions between sympathetic and parasympathetic nervous systems. La HRV descrive le variazioni della frequenza cardiaca nel tempo che si verificano naturalmente negli stati di salute. Queste variazioni riflettono la capacità dell’organismo di adattarsi continuamente agli eventi interni ed esterni, al fine di mantenere l’omeostasi. È interessante notare che Chrousos e Gold (1992, p. 1245) hanno definito lo stress come uno “stato di omeostasi minacciata”. Pertanto, nel corso degli anni si è supposto che una diminuzione della HRV rifletta un aumento dello stress e l’analisi della HRV è stata sempre più riconosciuta come una delle metodologie per misurare lo stress.
Una delle misure più semplici della HRV (SDNN) quantifica la deviazione standard della durata degli intervalli RR normali, cioè come varia nel tempo l’intervallo tra i picchi R normali (sinusali) di QRS consecutivi sull’elettrocardiogramma (ECG). Ciononostante, nel corso degli anni sono state sviluppate numerose metriche matematiche e approcci all’analisi HRV per estrarre informazioni sempre più accurate dalla HRV (Shaffer e Ginsberg, 2017).
L’analisi HRV nel dominio del tempo si concentra sulla variazione degli intervalli NN (cioè, gli intervalli RR normali) nel tempo. Oltre alla SDNN, gli studi HRV esaminano spesso il quadrato medio della radice delle differenze successive (RMSSD) o la percentuale di intervalli che differiscono dal precedente di più di 50 ms (pNN50) o 20 ms (pNN20). Per tutte queste metriche HRV nel dominio del tempo, i valori più alti riflettono una maggiore variabilità, che è più prevalente negli stati di salute.
L’analisi HRV non lineare o geometrica può essere eseguita tracciando gli intervalli NN su un grafico di Poincaré, dove ogni intervallo NN è tracciato in relazione all’intervallo NN precedente (Golińska, 2013) e la deviazione standard del gruppo principale di punti dati è misurata trasversalmente (SD1) o in lunghezza (SD2). Metriche come il Cardiac Sympathetic Index (CSI) e il Cardiac Vagal Index (CVI) sono state sviluppate per riflettere le interazioni tra SD1 e SD2 (Toichi et al., 1997). Il CSI si comporta in opposizione al CVI, quindi, a differenza della maggior parte delle altre metriche HRV, un CSI più alto è associato a una minore variabilità, cioè a un maggiore stress. Altre metriche geometriche includono l’indice triangolare (TINN) e l’indice HRV. Come la SDNN, questi due parametri indicano una misura della variabilità complessiva durante il periodo di registrazione. Il TINN misura la larghezza normalizzata della base dell’istogramma degli intervalli NN (in relazione al valore più alto dell’istogramma NN) e l’indice HRV è un rapporto tra il numero di tutti gli intervalli NN e il numero di intervalli NN nel punto più alto dell’istogramma NN (normalizzato a una frequenza di campionamento di 128 valori al secondo).
Nell’analisi nel dominio della frequenza, vengono analizzate diverse bande dello spettro di potenza ECG e le loro interazioni (tra bande e in relazione alla potenza totale). Negli adulti, studi precedenti hanno definito quattro bande di frequenza di interesse: Ultra-bassa frequenza (ULF), frequenza molto bassa (VLF), bassa frequenza (LF) e alta frequenza (HF), ognuna delle quali si ritiene abbia diverse origini fisiologiche. La ULF è stata associata alle oscillazioni circadiane della temperatura corporea e alla regolazione della renina-angiotensina; la VLF è stata associata alla regolazione a lungo termine della termoregolazione e ai meccanismi ormonali; la LF è stata associata a un mix di attività simpatica e vagale e all’attività dei barocettori e la HF è stata associata all’attività vagale (Pomeranz et al., 1985). Tuttavia, la definizione e il significato di ULF e VLF nei bambini è poco documentato e, pertanto, non è incluso in questo rapporto. Anche se le quantificazioni assolute della potenza nelle bande HF e LF possono aumentare/diminuire, in condizioni di normale conduttività cardiaca ci aspettiamo che LFn e HFn (che sono LF e HF normalizzate alla potenza totale) si comportino in direzioni opposte nella maggior parte dei casi. Pertanto, mentre HFn (che rappresenta l’attività parasimpatica) dovrebbe essere maggiore quando lo stress fisiologico è basso, LFn dovrebbe essere maggiore quando lo stress è alto. Queste associazioni sono, tuttavia, controverse (von Rosenberg et al., 2017; Adjei et al., 2019) e l’interpretazione dei risultati di LF e HF in scenari di vita reale richiede cautela.
L’analisi della variabilità della frequenza cardiaca è stata ampiamente accettata come metodo per misurare la compromissione autonomica e sempre più esaminata per quanto riguarda il suo valore nella stratificazione delle malattie (Ahmad et al., 2009; Lees et al., 2018; Oliveira et al., 2018). Sebbene studi precedenti abbiano descritto valori di riferimento normativi di HRV per i neonati nei primi giorni (Mehta et al., 2002; Longin et al., 2005; Doyle et al., 2009; Makarov et al., 2010; Lucchini et al., 2019), mancano indagini sulla HRV durante le prime ore dopo la nascita. Questi studi hanno per lo più registrato solo pochi minuti di ECG durante il primo giorno o iniziano solo oltre le 12 h di età e nessuno ha descritto tendenze continue dell’HRV durante le prime 24 h di vita.
Nonostante, per alcune condizioni, in particolare quelle che si verificano a causa di complicazioni della nascita e che richiedono decisioni sensibili al tempo, come l’encefalopatia neonatale, è importante descrivere valori di riferimento normali dell’HRV subito dopo la nascita e le loro tendenze durante le prime 24 h. Tali tendenze precoci possono fornire informazioni preziose su come un bambino ha recuperato da qualsiasi complicazione legata alla nascita. Il nostro obiettivo primario era quello di descrivere i valori di riferimento standard per le tendenze della HRV nelle prime 24 ore di vita postnatale in neonati sani a termine. Come obiettivo secondario, abbiamo studiato quali (se esistono) caratteristiche cliniche o fattori di rischio esercitano un impatto maggiore sulla HRV.
Materiali e metodi
Popolazione dello studio
Abbiamo reclutato prospetticamente e consecutivamente 150 neonati sani a termine dal centro nascita, dal reparto travaglio o dal reparto postnatale del Queen Charlotte’s and Chelsea Hospital tra agosto 2017 e gennaio 2019. Abbiamo incluso bambini sani nati a 36 settimane di età gestazionale o più, a seguito di gravidanze non complicate, che sono nati in buone condizioni con un peso alla nascita compreso tra il 9° e il 91° centile. I bambini sono stati esclusi se hanno richiesto qualsiasi farmaco o fototerapia, se c’era piressia materna perinatale durante o entro 48 ore dall’inizio del travaglio, se hanno richiesto la rianimazione alla nascita o dopo la nascita (intubazione o compressioni cardiache o qualsiasi farmaco) o se c’era qualsiasi complicazione intrapartum (emorragia materna, abruptio placentare, pre-eclampsia o prolasso del cordone). Il nostro studio ha incluso solo i bambini che stavano bene alla nascita e, quindi, sono rimasti sempre con le loro madri.
Assistenza intrapartum e nel primo periodo postnatale
I bambini inclusi nel nostro studio sono nati o al centro nascita o nel reparto travaglio, in base alle preferenze materne. Le donne che preferivano un parto più naturale e meno medicalizzato hanno optato per l’assistenza guidata dall’ostetrica nel centro nascita. Una piscina calda, aromaterapia, musica, protossido d’azoto e varie attrezzature sono disponibili per aiutare queste donne ad affrontare il dolore del travaglio. Le donne che hanno optato per l’analgesia epidurale hanno ricevuto un’assistenza guidata dall’ostetrica nel reparto travaglio. In entrambi gli ambienti, la temperatura della stanza era fissata a 24-25°C. Secondo le linee guida nazionali, i bambini nati in buone condizioni sono dati alla madre subito dopo la nascita e messi sul loro petto/addome per la cura pelle a pelle. Possono essere puliti delicatamente mentre sono sul petto della madre, e l’allattamento al seno o al biberon è iniziato entro 1 ora dalla nascita.
Acquisizione ECG
Le registrazioni dell’elettrocardiogramma sono state iniziate appena possibile dopo la nascita, dopo il consenso informato scritto dei genitori, che poteva essere ottenuto prima o dopo la nascita. Questo studio è stato approvato da un Comitato Etico Nazionale di Ricerca (REC17/LO/0956) e dal dipartimento locale di Ricerca & Sviluppo. Le registrazioni sono state continuate per almeno 6 ore ma potevano essere interrotte prima se richiesto dai genitori o se il bambino veniva dimesso. Abbiamo usato un registratore ECG portatile da 2 pollici (Faros 180, Bittium, Oulu, Finlandia) con configurazione toracica a tre elettrodi e una frequenza di campionamento di 500 Hz (Figura 1), che avevamo precedentemente testato. Una volta completata la registrazione, il file ECG è stato caricato su CardiscopeTM HRV Analysis Software (Hasiba Medical, Graz, Austria) per l’analisi ECG e HRV.
Figura 1. Registratore ECG portatile e configurazione toracica. Tre elettrodi ECG sono stati alimentati attraverso un manicotto di allineamento per ridurre la distanza tra i fili ECG e prevenire artefatti induzione magnetica sul segnale ECG grezzo (500 Hz con rilevamento automatico R-picco).
Analisi HRV
Metriche di variabilità della frequenza cardiaca nel tempo (lineare e non lineare) e domini di frequenza sono stati calcolati per ogni segmento 5-min dell’ECG (finestre non sovrapposte). Abbiamo usato una validità minima del QRS del 90%, il che significa che tutti i segmenti di 5 minuti con meno del 90% di QRS consecutivi di buona qualità sono stati esclusi dall’analisi. Data la mancanza di raccomandazioni internazionali per l’analisi HRV specificamente per i neonati, i nostri metodi e le metriche scelte si basavano su un adattamento delle linee guida internazionali disponibili (Task Force della Società Europea di Cardiologia e della Società Nord Americana di Pacing ed Elettrofisiologia, 1996; Schwartz et al., 2002) più le recenti raccomandazioni per la ricerca HRV (Laborde et al., 2017) e una revisione degli studi HRV rilevanti nei neonati durante i primi giorni di vita (Doyle et al., 2009; Goulding et al., 2015; Temko et al., 2015). Le 16 metriche HRV che abbiamo scelto di analizzare erano basate su questi riferimenti. L’analisi della frequenza è stata fatta con la trasformata di Fourier (Welch Periodogram) e abbiamo usato serie temporali di intervallo RR detrended e interpolate (spline cubiche). Sulla base della letteratura di cui sopra, abbiamo usato una banda LF di 0,04-0,20 Hz e una banda HF di 0,20-2,0 Hz. Abbiamo poi analizzato LF e HF normalizzate, cioè la proporzione di potenza in questi intervalli in relazione alla potenza spettrale totale. L’elenco delle metriche HRV riportate in questo studio e il loro significato sono descritti nella tabella 1.

Tabella 1. Metriche HRV: abbreviazioni e significato.
Analisi statistica
Abbiamo usato Stata 15 (StataCorp, Austin, TX, Stati Uniti) per le analisi statistiche. Abbiamo descritto le tendenze temporali dell’HRV con mediane orarie e intervalli interquartili e calcolato le medie individuali per le prime 6 e 24 ore di vita. Poiché le registrazioni ECG potevano iniziare e terminare in momenti diversi, i nostri dati erano sbilanciati, cioè non avevamo esattamente lo stesso numero di misurazioni per tutti i partecipanti, i cambiamenti della HRV nel tempo sono stati analizzati con regressione a effetti misti multilivello con covarianza autoregressiva o utilizzando test a coppie se si confrontavano sei medie orarie. Anche la rilevanza delle variabili cliniche è stata testata con la regressione a effetti misti multilivello con covarianza autoregressiva e i confronti tra sottogruppi sono stati eseguiti utilizzando test di confronto proporzionale/media per le variabili cliniche significative. Poiché la maggior parte delle tendenze non erano lineari e avevano almeno una flessione, abbiamo usato un termine quadratico per la variabile tempo nel modello di regressione. Abbiamo log-trasformato le variabili HRV che non erano normalmente distribuite per garantire residui normali.
Risultati
Tra settembre 2017 e gennaio 2019, abbiamo sottoposto a screening 511 bambini di cui 360 erano idonei e 151 no. Di questi 360 bambini, 201 madri/padri ci hanno chiesto di tornare più tardi o in un altro momento conveniente, che alla fine ha superato la finestra massima di reclutamento o è diventato impossibile da reclutare a causa di attrezzature in uso. Su 159 madri/padri che sono state pienamente informate sullo studio, 9 hanno rifiutato e 150 hanno dato il consenso informato scritto. Di questi 150 partecipanti, 7 hanno iniziato la registrazione dell’ECG dopo 24 ore. Le caratteristiche del campione sono riportate nelle tabelle 2 e 3. In totale, abbiamo ottenuto 1858 h e 55 min di registrazione ECG a partire da un’età mediana (IQR) di 2 h 46 min (3 h 6 min), minimo 1 min dopo la nascita, massimo 52 h 23 min. Non tutti i bambini hanno iniziato la registrazione ECG nello stesso momento né tutte le registrazioni hanno avuto la stessa durata. La figura 2 presenta il numero di registrazioni valide e di neonati per tempo.

Tabella 2. Caratteristiche del campione I (variabili continue).

Tabella 3. Caratteristiche del campione II (variabili categoriche).
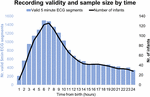
Figura 2. Validità della registrazione e dimensione del campione in base al tempo.
Valori HRV nel tempo
Durante le prime 6 h di età postnatale, i valori mediani (IQR) erano HR 122 (15,9), SDNN 27,5 (13,2), RMSSD 18,32 (11,42), SD1 13.6 (7,7), SD2 36,2 (17,8), SDSD 18,8 (11,4), CVI 2,7 (0,4), CSI 2,6 (1,2), pNN20 14,8 (15,2), pNN50 1,7 (2.5) HFn 40,4 (16,9) LFn 57,7 (17,8) Potenza totale 751 (835), TINN 226 (144) HRV Index 5,9 (2,3) Parseval 0,7 (0,2). Nove di queste metriche HRV (compresa la frequenza cardiaca) sono cambiate significativamente nel tempo (HR p < 0,01; SDNN p = 0,01; SD2 p < 0,01; CSI p < 0,01; HFn p = 0,03; LFn p < 0,01; Potenza totale p < 0,01; HRV Index p = 0,01; Parseval Index p = 0,03), aggiustato per variabili cliniche rilevanti. Una variazione più pronunciata è stata osservata durante le prime 6 ore di vita postnatale. Solo la frequenza cardiaca e LFn è cambiata tra 6 e 12 h di età e solo la frequenza cardiaca è cambiata tra 12 e 18 h di età (p-valori aggiustati Bonferroni: 0,03, < 0,01 e < 0,01, rispettivamente). Queste metriche hanno mostrato un HRV crescente durante le prime 6 ore seguito da una leggera diminuzione fino a 12 ore da cui HRV è rimasto stabile (Tabella 4). Le tendenze orarie espresse dalla mediana e dagli intervalli interquartili sono presentate nella Figura 3. Le tendenze HRV nel tempo sono state indipendentemente influenzate dall’età gestazionale, dai movimenti fetali ridotti, dalla classificazione della cardiotocografia (CTG), dalla malattia materna cronica o indotta dalla gravidanza e dal verificarsi di complicazioni del parto. Abbiamo esaminato le interdipendenze di tutte le metriche HRV con una matrice di correlazione (Figura 4), dove si evidenzia (a) la somiglianza tra le metriche del dominio del tempo e (b) la tendenza alla simmetria tra HFn e LFn e CSI e CVI.
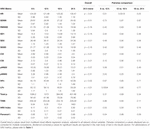
Tabella 4. Medie HRV su sei ore e confronti a coppie.
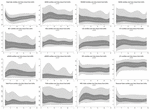
Figura 3. Centili HRV durante le prime 24 ore di vita. Aree grigio chiaro: 5°-25° centile e 75°-95° centile. Aree grigio scuro: 25°-75° centile. La linea bianca centrale corrisponde alla mediana. I p-valori riportati risultano dalla regressione a effetti misti multilivello per misurare il cambiamento nel tempo. Tutti i centili levigati con spline cubiche.

Figura 4. Matrice di correlazione: tutte le metriche HRV. Per le abbreviazioni delle metriche HRV, fare riferimento alla tabella 1. Notiamo in particolare (a) la concordanza tra RMSSD, SDSD e SD1, che è stata precedentemente descritta; (b) il comportamento delle diverse metriche HRV in relazione all’HR che evidenzia quante informazioni aggiuntive può fornire l’analisi HRV; (c) l’interdipendenza di HFn e LFn e CVI e CSI, evidenziando l’interazione tra influenze simpatiche e parasimpatiche.
Effetto dei fattori clinici
Oltre all’età (tempo di nascita), la regressione univariabile a effetti misti multilivello ha mostrato che le metriche HRV erano influenzate dall’età gestazionale, dai movimenti fetali ridotti, dal CTG, dalla malattia materna e dalle complicazioni del parto. Dopo l’aggiustamento per queste variabili, la variazione nel tempo delle suddette sette metriche HRV è rimasta statisticamente significativa. Anche l’HFn e l’indice Parseval hanno mostrato cambiamenti significativi. Sebbene la parità non fosse un fattore predittivo indipendente nell’analisi di regressione univariabile, nel sottogruppo dei parti vaginali spontanei, abbiamo osservato una tendenza costante verso una HRV più alta per le primipare rispetto alle pluripare.
Mobili fetali ridotti
I movimenti fetali ridotti erano coerentemente associati a valori HRV più bassi per tutte le metriche tranne che per CSI (che si comporta nella direzione opposta, cioè, il risultato è concordante). Tali differenze tra i sottogruppi erano solo statisticamente significativi per CSI (p = 0,001), pNN20 (p = 0,045) e Parseval Index (p = 0,047) tendenze. La Figura 5 presenta le tendenze di queste tre metriche nel tempo, rispetto alla frequenza cardiaca. Questo nonostante non ci siano differenze significative tra i sottogruppi, a parte la gravidità media, che non ha predetto indipendentemente l’HRV (Tabella 5). Le associazioni con CSI e pNN20 sono rimaste significative dopo l’aggiustamento per l’età gestazionale, il tempo dalla nascita, la classificazione CTG, la presenza di malattie croniche materne o complicazioni del parto (Tabella 6). Il sottogruppo con movimenti fetali ridotti aveva una HRV media più bassa durante le prime 6 ore, anche se queste differenze non erano statisticamente significative.
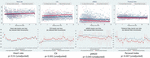
Figura 5. Cambiamenti della HRV nei bambini le cui madri hanno riferito movimenti fetali ridotti. Per le abbreviazioni delle metriche HRV, fare riferimento alla tabella 1. I pannelli superiori presentano la dispersione dei dati HRV nel tempo e le linee di tendenza lineare per la frequenza cardiaca (comparativa) e le tre metriche HRV che sono state significativamente associate alle segnalazioni materne di movimenti fetali ridotti. Le linee rosse rappresentano i bambini le cui madri hanno riferito una riduzione dei movimenti fetali e quelle blu i bambini le cui madri non l’hanno fatto. I pannelli inferiori presentano le medie e gli intervalli di confidenza al 95% per queste metriche.
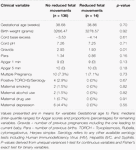
Tabella 5. Confronto tra sottogruppi – bambini con e senza movimenti fetali ridotti.

Tabella 6. Correlazione non aggiustata e aggiustata tra metriche HRV e movimenti fetali ridotti.
Cardiotocografia
C’era un’associazione significativa tra i risultati CTG e le tendenze HRV nel tempo per CSI (p = 0,03), LFn (0,01), e HFn (p = 0,02), che è rimasto statisticamente significativo dopo la regolazione per movimenti fetali ridotti, età gestazionale, tempo dalla nascita, presenza di malattia cronica materna o gravidanza indotta o complicazioni di consegna. Tuttavia, dato il piccolo numero di eventi in ogni classificazione CTG, abbiamo anche confrontato la media di 6 ore in questi sottogruppi. CSI nel sottogruppo bradicardia era significativamente diverso dai gruppi “normale”, “decelerazione variabile” e “altro” (valori p aggiustati per Bonferroni: 0,02, 0,03 e 0,04, rispettivamente), ma nessun’altra differenza di gruppo era statisticamente significativa. HFn era diverso solo tra i sottogruppi “bradicardia” e “decelerazione variabile” (p = 0,03) e LFn non variava tra i diversi sottogruppi CTG.
Malattia materna cronica o indotta dalla gravidanza
Nel nostro campione, 104 (69%) donne non avevano malattie croniche né malattie indotte dalla gravidanza, 20 (13%) avevano diabete mellito isolato o diabete gestazionale, 7 (3%) avevano malattie della tiroide, 1 (0,7%) aveva ipertensione e il resto aveva altre condizioni, comprese le combinazioni di quanto sopra (Tabella 3). La malattia materna cronica o indotta dalla gravidanza era significativamente associata alle tendenze HRV non aggiustate, anche se questo rimaneva statisticamente significativo solo per l’indice di Parseval (p = 0,03) dopo aver aggiustato i confonditori clinici. All’analisi binaria, i bambini di madri con gravidanza/malattia cronica non hanno avuto indici di Parseval medi diversi né durante le prime 6 ore (p = 0,98) né durante il periodo di 24 ore (p = 0,29). Il gruppo di malattie con l’indice di Parseval più basso era la malattia della tiroide.
Eventi durante il travaglio e il parto
Tutti i bambini del nostro studio sono nati dopo gravidanze e parti senza complicazioni e sono nati in buone condizioni. Tuttavia, ci sono state 13 nascite che hanno avuto uno dei seguenti eventi: liquor macchiato di meconio (11), cordone cervicale circolare (1), secondo stadio di travaglio prolungato (1) e distocia di spalla (1, oltre al meconio). L’andamento del CSI nelle 24 ore era significativamente associato alla presenza di qualsiasi evento di travaglio e parto prima (p = 0,04) ma non dopo la regolazione per i confondenti (p = 0,42).
Anche se la modalità di consegna non ha predetto indipendentemente i valori HRV, i bambini nati tramite parto strumentale avevano un HFn più basso e un CSI più alto nelle 24 ore rispetto ai bambini nati tramite parto vaginale naturale. Questo nonostante non ci fossero differenze significative tra le altre variabili cliniche rilevanti, tranne il punteggio Apgar a 1 minuto e la molteplicità della gestazione che non predicevano indipendentemente l’HRV (Tabella 7).
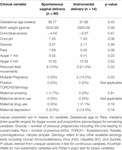
Tabella 7. Confronto tra sottogruppi – bambini nati con un normale parto vaginale rispetto al parto strumentale.
Discussione
Questo è il primo studio che descrive le tendenze dell’HRV continua postnatale in bambini sani a termine nell’immediato periodo postnatale. Identificare queste soglie e tendenze è stato importante perché ora sappiamo che l’analisi e l’interpretazione della HRV nel primo periodo postnatale dipende dal tempo, cioè, ciò che è normale a 1-6 h di età può non essere normale a 12-18 h di età. Questo permetterà ai medici e ai ricercatori di esaminare più accuratamente le differenze di HRV tra neonati sani e malati nell’immediato periodo postnatale. Avere valori di riferimento accurati per l’immediato periodo postnatale significa anche che ora siamo meglio attrezzati per sviluppare sistemi di allarme precoce basati sull’analisi HRV.
Ci sono alcune possibili ragioni per i cambiamenti che abbiamo osservato nelle prime 6 ore dopo la nascita. Poiché la nascita è stata precedentemente descritta come un evento stressante per i bambini (Peebles et al., 1994; Aldrich et al., 1996), è possibile che il miglioramento dell’HRV nelle prime ore rifletta la fine dell’effetto dello stressor (cioè, la fine della nascita). Questo rimbalzo parasimpatico potrebbe verificarsi perché il sistema nervoso simpatico può sopprimere temporaneamente l’attività parasimpatica che cessa una volta che il periodo di stress è finito. Da un altro punto di vista, Reyes-Lagos et al., 2015 hanno riportato una HRV materna più alta durante il travaglio che durante il terzo trimestre e Musa et al., 2017 hanno descritto un aumento di LFn e HFn per dilatazione cervicale durante il travaglio. Se l’HRV fetale segue l’HRV materna, questo suggerirebbe invece che la nascita può rappresentare un periodo di HRV particolarmente elevato che riflette il buon adattamento alle sfide fisiologiche, nei bambini sani. Infine, è anche possibile che i cambiamenti della HRV osservati durante le prime ore siano una parziale espressione della maturazione della HRV che avviene con l’età (Fyfe et al., 2015).
Abbiamo esaminato i risultati della HRV riportati in altri studi neonatali e fetali con l’intento di confrontare tali valori con quelli del nostro studio, ma date le differenze di metrica e di acquisizione e durata delle registrazioni, questo è stato molto impegnativo. I valori HRV che abbiamo osservato nelle prime 6-12 h erano paragonabili (leggermente superiori) a quelli riportati da Doyle et al. (2009) nel sonno attivo durante le prime 12 h di vita e Lucchini et al., 2019 a 12-84 ore e inferiori a quelli riportati in età più avanzata, cioè 24-168 h (da Mehta et al., 2002; Longin et al., 2005; Makarov et al., 2010). I neonati nel nostro studio avevano valori SDNN durante le prime 6 h di età che erano paragonabili (leggermente superiori) a quelli nei feti a termine (Brändle et al., 2015; Schneider et al., 2018), che era previsto, data la durata più lunga della registrazione e l’aumento dell’età gestazionale. Avere un HRV simile prima e dopo la nascita supporta la teoria che la nascita, in bambini sani, è associata a una buona stabilità dell’HRV.
Abbiamo osservato più variabilità inter-soggetto che entro il soggetto in tutte le metriche HRV. Questo sottolinea che l’analisi HRV deve essere interpretata non solo in base ai valori di riferimento, ma anche prendendo in considerazione i cambiamenti e i progressi rispetto alle linee di base individuali. Infatti, mentre abbiamo potuto osservare cambiamenti orari dell’HRV durante le prime 6 ore di vita, potremmo non essere in grado di rilevare tale variazione se ci fossimo impegnati ad analizzare solo un singolo punto temporale o una media. Il monitoraggio di tali tendenze può fornire ulteriori informazioni su come un neonato si riprende dalla nascita in caso di un parto complicato o di un intervento di emergenza. Infatti, il fatto che le metriche HRV fossero significativamente associate a movimenti fetali ridotti, CTG anormale, malattia materna cronica o indotta dalla gravidanza e complicazioni del parto evidenzia il valore dell’analisi HRV come misura del benessere generale.
L’associazione tra HRV e movimenti fetali è stata precedentemente riportata da Brändle et al. (2015) utilizzando la biomagnetografia fetale. Nel loro studio di valutazione dello stato di comportamento basato sui movimenti che includeva feti sani da 24 a 41 settimane, le metriche HRV (ma non Entropia) erano in aumento dal sonno tranquillo al sonno attivo e dal sonno attivo allo stato di veglia, per tutte le età gestazionali. In effetti, Nijhuis et al. (1982) avevano già proposto una classificazione del movimento fetale basata su HRV fetale, movimento degli occhi e movimento del corpo.
Autori precedenti hanno trovato differenze nei valori HRV attraverso diverse modalità di parto. Kozar et al. (2018) hanno riportato HFn più basse e LFn più alte nei bambini nati con taglio cesareo rispetto ai bambini nati per via vaginale. È possibile che la loro scoperta sia legata all’uso di Thiopental per l’anestesia generale (GA) in tutti i loro tagli elettivi (Riznyk et al., 2005; Tsuchiya et al., 2006) piuttosto che alla modalità di parto, mentre nel nostro studio non c’era uso di alcuna GA. La nostra interpretazione è che l’HRV indicherà una differenza tra le modalità di parto se c’è una differenza di benessere, quindi, nel nostro studio, questo sarebbe stato associato all’uso di strumenti durante il parto a causa della difficile estrazione.
Limitazioni
Non abbiamo esaminato gli stati di sonno dei neonati reclutati durante le prime 24 h dopo la nascita. È improbabile che i bambini abbiano stabilito un circadiano entro poche ore dalla nascita e spesso i neonati seguono invece ritmi ultradiani (Mirmiran et al., 2003). Tuttavia, è possibile che la tendenza leggermente in calo che abbiamo osservato nella seconda metà delle registrazioni di 24 ore rifletta una maggiore proporzione di bambini che dormono o sono in uno stato più tranquillo. Abbiamo incluso nel nostro studio alcuni bambini sani le cui madri avevano alcune malattie croniche o indotte dalla gravidanza. Si potrebbe sostenere che l’inclusione di questi casi compromette la nostra definizione di neonato sano e di HRV neonatale sana. Il fatto che non ci fossero associazioni significative tra qualsiasi metrica HRV e il pH o l’eccesso di basi o il punteggio Apgar evidenzia che il nostro campione era effettivamente sano, poiché tutti i bambini nel nostro studio sono nati in buone condizioni e non hanno richiesto alcun tipo di indagine o trattamento. Il nostro obiettivo era quello di rappresentare l’intero spettro di parti considerati e gestiti clinicamente come “sani” da un punto di vista pragmatico (cioè, tutti i “bassi rischi” e “non complicati”). Quindi, includere questi bambini è stato un passo importante per affrontare le possibili “variazioni della normalità” e per arricchire il nostro set di dati. Allo stesso modo, abbiamo esplorato le possibili differenze di HRV in diversi sottogruppi (secondo le variabili cliniche come descritto nella tabella 2). È importante chiarire che il nostro studio non era finalizzato o alimentato per affrontare in dettaglio le possibili differenze tra questi sottogruppi e occorre cautela nell’interpretare i nostri risultati. Ciononostante, crediamo che l’esame di queste associazioni sarà di interesse per i team sanitari nelle cure ostetriche e perinatali/neonatali.
Conclusione
Abbiamo descritto i valori di riferimento postnatali precoci per le metriche HRV nei neonati sani a termine, che non erano stati raggiunti in precedenza. La HRV cambia significativamente durante il primo giorno di vita, in particolare durante le prime 6 ore, durante le quali sembra mostrare un breve aumento seguito da una normalizzazione. Le correlazioni significative tra la HRV e le variabili di rischio clinico supportano l’ipotesi che la HRV sia un buon indicatore del benessere generale di un bambino e che sia sensibile per cogliere lo stress legato alla nascita e monitorare la sua risoluzione nel tempo.
Disponibilità dei dati
I dati grezzi che supportano le conclusioni di questo manoscritto saranno resi disponibili dagli autori, senza indebite riserve, a qualsiasi ricercatore qualificato.
Dichiarazione etica
Questo studio è stato condotto in conformità con le raccomandazioni della United Kingdom Health Research Authority e la GCP ICH con consenso informato scritto da tutti i soggetti. Tutti i soggetti hanno dato il consenso informato scritto in conformità con la Dichiarazione di Helsinki. Il protocollo è stato approvato dal London Chelsea Research Ethics Committee.
Contributi degli autori
VO ha progettato lo studio, raccolto, analizzato e interpretato i dati, scritto la prima bozza e guidato lo sviluppo del manoscritto. WvR ha contribuito all’analisi e all’interpretazione dei dati e ha fornito input critici per lo sviluppo del manoscritto. PM e TA hanno contribuito all’interpretazione dei dati e hanno fornito input critici per lo sviluppo del manoscritto. JM ha contribuito al disegno dello studio e all’interpretazione dei dati, ha reclutato i pazienti e ha acquisito i dati. VS ha contribuito alla gestione dello studio e al reclutamento. DM ha supervisionato tutti gli aspetti dell’analisi e dell’interpretazione dell’HRV e ha fornito input critici per lo sviluppo del manoscritto. ST ha concepito l’idea e progettato lo studio, ha supervisionato tutti gli aspetti dello studio e ha guidato lo sviluppo del manoscritto.
Finanziamento
VO è stato finanziato dal NIHR ICA Doctoral Research Fellowship. PM è stato finanziato dalla MRC Doctoral Research Fellowship. Le opinioni espresse sono quelle dell’autore/i e non necessariamente quelle del NIHR o del Dipartimento della Salute.
Dichiarazione di conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di qualsiasi relazione commerciale o finanziaria che potrebbe essere interpretata come un potenziale conflitto di interessi.
Riconoscimenti
Vorremmo ringraziare tutti i genitori che hanno acconsentito alla partecipazione dei loro bambini in questo studio e il signor Paul Basset (statistico medico) per il suo supporto nell’analisi statistica dei dati inclusi in questo manoscritto.
Adjei, T., Rosenberg, W., Von, Nakamura, T., e Chanwimalueang, T. (2019). Il framework classA : valutazione basata su HRV delle dinamiche SNS e PNS senza controversie LF-HF. Fronte. Physiol. 10:505. doi: 10.3389/fphys.2019.00505
PubMed Abstract | CrossRef Full Text | Google Scholar
Ahmad, S., Tejuja, A., Newman, K. D., Zarychanski, R., e Seely, A. J. E. (2009). Revisione clinica: una revisione e un’analisi della variabilità della frequenza cardiaca e la diagnosi e la prognosi dell’infezione. Crit. Care 13, 1-7. doi: 10.1186/cc8132
PubMed Abstract | CrossRef Full Text | Google Scholar
Aldrich, C. J., D’Antona, D., Spencer, J. A. D., Delpy, D. T., Reynolds, E. O. R., and Wyatt, J. S. (1996). Variazioni della frequenza cardiaca fetale e ossigenazione cerebrale misurate con la spettroscopia nel vicino infrarosso durante la prima fase del travaglio. Eur. J. Obstet. Gynecol. Reprod. Biol. 64, 189-195. doi: 10.1016/0301-2115(95)02284-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Brändle, J., Preissl, H., Draganova, R., Ortiz, E., Kagan, K. O., Abele, H., et al. (2015). Parametri di variabilità della frequenza cardiaca e movimento fetale completano la rilevazione degli stati comportamentali fetali tramite magnetografia per monitorare lo sviluppo neurovegetativo. Front. Hum. Neurosci. 9:147. doi: 10.3389/fnhum.2015.00147
PubMed Abstract | CrossRef Full Text | Google Scholar
Chrousos, G., e Gold, P. (1992). I concetti di stress e disturbi del sistema di stress – panoramica dell’omeostasi fisica e comportamentale. JAMA 267, 1244-1252. doi: 10.1001/jama.267.9.1244
PubMed Abstract | CrossRef Full Text | Google Scholar
Doyle, O. M., Korotchikova, I., Lightbody, G., Marnane, W., Kerins, D., and Boylan, G. B. (2009). Variabilità della frequenza cardiaca durante il sonno in neonati sani a termine nel primo periodo postnatale. Physiol. Meas. 30, 847-860. doi: 10.1088/0967-3334/30/8/009
PubMed Abstract | CrossRef Full Text | Google Scholar
Fyfe, K. L., Yiallourou, S. R., Wong, F. Y., Odoi, A., Walker, A. M., e Horne, R. S. C. (2015). L’effetto dell’età gestazionale alla nascita sulla maturazione post-termine della variabilità della frequenza cardiaca. Sleep 38, 1635-1644. doi: 10.5665/sleep.5064
PubMed Abstract | CrossRef Full Text | Google Scholar
Golińska, A. K. (2013). Trame di Poincaré nell’analisi di segnali biomedici selezionati. Stud. Logica Gramm. Rhetor. 35, 117-127. doi: 10.2478/slgr-2013-0031
CrossRef Full Text | Google Scholar
Goulding, R. M., Stevenson, N. J., Murray, D. M., Livingstone, V., Filan, P. M., and Boylan, G. B. (2015). Variabilità della frequenza cardiaca in encefalopatia ischemica ipossica: correlazione con il grado EEG e 2-y esito del neurosviluppo. Pediatr. Res. 77, 681-687. doi: 10.1038/pr.2015.28
PubMed Abstract | CrossRef Full Text | Google Scholar
Kozar, M., Tonhajzerova, I., Mestanik, M., Matasova, K., Zibolen, M., Calkovska, A., et al. (2018). La variabilità della frequenza cardiaca nei neonati a termine sani è correlata alla modalità di consegna: uno studio osservazionale prospettico. BMC Pregnancy Childbirth 18:264. doi: 10.1186/s12884-018-1900-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Laborde, S., Mosley, E., and Thayer, J. F. (2017). Variabilità della frequenza cardiaca e tono vagale cardiaco nella ricerca psicofisiologica – raccomandazioni per la pianificazione dell’esperimento, l’analisi dei dati e la segnalazione dei dati. Front. Psychol. 8:1-18. doi: 10.3389/fpsyg.2017.00213
PubMed Abstract | CrossRef Full Text | Google Scholar
Lees, T., Shad-Kaneez, F., Simpson, A. M., Nassif, N. T., Lin, Y., and Lal, S. (2018). Variabilità della frequenza cardiaca come biomarcatore per la previsione di ictus, complicazioni post-ictus e funzionalità. Biomark. Insights 13:117727191878693. doi: 10.1177/1177271918786931
PubMed Abstract | CrossRef Full Text | Google Scholar
Longin, E., Schaible, T., Lenz, T., e König, S. (2005). Variabilità della frequenza cardiaca a breve termine in neonati sani: dati normativi e osservazioni fisiologiche. Early Hum. Dev. 81, 663-671. doi: 10.1016/j.earlhumdev.2005.03.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Lucchini, M., Burtchen, N., Fifer, W., and Signorini, M. (2019). Analisi cardiorespiratoria multiparametrica in neonati late-preterm, early-term e full-term alla nascita. Med. Biol. Eng. Comput. 57, 99-106. doi: 10.1007/s11517-018-1866-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Makarov, L., Komoliatova, V., Zevald, S., Schmidt, G., Muller, A., e Serebruany, V. (2010). Dinamicità del QT, alternanze microvolt delle onde T e variabilità della frequenza cardiaca durante il monitoraggio dell’elettrocardiogramma ambulatoriale di 24 ore nel neonato sano dal primo al quarto giorno di vita. J. Electrocardiol. 43, 8-14. doi: 10.1016/j.jelectrocard.2009.11.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Mehta, S. K., Super, D. M., Connuck, D., Salvator, A., Singer, L., Fradley, L. G., et al. (2002). Variabilità della frequenza cardiaca in neonati sani. Am. J. Cardiol. 89, 50-53. doi: 10.1016/S0002-9149(01)02162-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Mirmiran, M., Maas, Y. G. H., e Ariagno, R. L. (2003). Sviluppo del sonno fetale e neonatale e dei ritmi circadiani. Sleep Med. Rev. 7, 321-334. doi: 10.1053/smrv.2002.0243
CrossRef Full Text | Google Scholar
Musa, S. M., Adam, I., Hassan, N. G., Rayis, D. A., and Lutfi, M. F. (2017). Variabilità della frequenza cardiaca materna durante la prima fase del travaglio. Front. Physiol. 8:1-6. doi: 10.3389/fphys.2017.00774
CrossRef Full Text | Google Scholar
Nijhuis, J., Prescht’l, H., and Martin, C. (1982). Ci sono stati comportamentali nel feto umano? Early Hum. Dev. 6, 177-195. doi: 10.1016/0378-3782(82)90106-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Oliveira, V., Martins, R., Liow, N., Teiserskas, J., Von Rosenberg, W., Adjei, T., et al. (2018). Accuratezza prognostica dell’analisi della variabilità della frequenza cardiaca nell’encefalopatia neonatale: una revisione sistematica. Neonatologia 115, 59-67. doi: 10.1159/000493002
PubMed Abstract | CrossRef Full Text | Google Scholar
Peebles, D. M., Spencer, J. A. D., Edwards, A. D., Wyatt, J. S., Reynolds, E. O., Cope, M., et al. (1994). Relazione tra la frequenza delle contrazioni uterine e la saturazione di ossigeno cerebrale fetale umana studiata durante il travaglio mediante spettroscopia nel vicino infrarosso. Br. J. Obstet. Gynaecol. 101, 44-48. doi: 10.1111/j.1471-0528.1994.tb13008.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Pomeranz, B., Macaulay, R. J., Caudill, M. A., Kutz, I., Adam, D., Gordon, D., et al. Valutazione della funzione autonomica nell’uomo mediante analisi spettrale della frequenza cardiaca. Am. J. Physiol. 248, H151-H153. doi: 10.1152/ajpheart.1985.248.1.H151
PubMed Abstract | CrossRef Full Text | Google Scholar
Reyes-Lagos, J. J., Echeverría-Arjonilla, J. C., Peña-Castillo, M. Á, García-González, M. T., Ortiz-Pedroza Mdel, R., Pacheco-López, G., et al. (2015). Un confronto della variabilità della frequenza cardiaca nelle donne al terzo trimestre di gravidanza e durante il travaglio a basso rischio. Physiol. Behav. 149, 255-261. doi: 10.1016/j.physbeh.2015.05.041
PubMed Abstract | CrossRef Full Text | Google Scholar
Riznyk, L., Fijałkowska, M., e Przesmycki, K. (2005). Effetti di thiopental e propofol sulla variabilità della frequenza cardiaca durante l’induzione di anestesia generale basata su fentanyl. Pharmacol. Rep. 57, 128-134. doi: 10.1103/PhysRevB.69.052404
PubMed Abstract | CrossRef Full Text | Google Scholar
Schneider, U., Bode, F., Schmidt, A., Nowack, S., Rudolph, A., Doelcker, E. M., et al. (2018). Pietre miliari dello sviluppo del sistema nervoso autonomo rivelato attraverso il monitoraggio longitudinale della variabilità della frequenza cardiaca fetale. PLoS One 13:1-13. doi: 10.1371/journal.pone.0200799
PubMed Abstract | CrossRef Full Text | Google Scholar
Schwartz, P. J., Garson, A., Paul, T., Stramba-Badiale, M., Vetter, V. L., Villain, E., et al. (2002). Linee guida per l’interpretazione dell’elettrocardiogramma neonatale: una task force della società europea di cardiologia. Eur. Heart J. 23, 1329-1344. doi: 10.1053/euhj.2002.3274
PubMed Abstract | CrossRef Full Text | Google Scholar
Shaffer, F., and Ginsberg, J. P. (2017). Una panoramica delle metriche e delle norme di variabilità della frequenza cardiaca. Front. Public Heal. 5:1-17. doi: 10.3389/fpubh.2017.00258
PubMed Abstract | CrossRef Full Text | Google Scholar
Task Force della Società Europea di Cardiologia, e la Società Nord Americana di Pacing ed Elettrofisiologia. (1996). Variabilità della frequenza cardiaca – standard di misurazione, interpretazione fisiologica e uso clinico. Eur. Heart J. 17, 354-381. doi: 10.1161/01.CIR.93.5.1043
CrossRef Full Text | Google Scholar
Temko, A., Doyle, O., Murray, D., Lightbody, G., Boylan, G., e Marnane, W. (2015). Predittore multimodale di esito del neurosviluppo nei neonati con encefalopatia ipossico-ischemica. Comput. Biol. Med. 63, 169-177. doi: 10.1016/j.compbiomed.2015.05.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Toichi, M., Sugiura, T., Murai, T., e Sengoku, A. (1997). Un nuovo metodo di valutazione della funzione autonoma cardiaca e il suo confronto con l’analisi spettrale e il coefficiente di variazione dell’intervallo R-R. J. Auton. Nerv. Syst. 62, 79-84. doi: 10.1016/S0165-1838(96)00112-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Tsuchiya, S., Kanaya, N., Hirata, N., Kurosawa, S., Kamada, N., Edanaga, M., et al. Effetti di tiopental su indice bispettrale e variabilità della frequenza cardiaca. Eur. J. Anaesthesiol. 23, 454-459. doi: 10.1017/S0265021506000159
PubMed Abstract | CrossRef Full Text | Google Scholar
von Rosenberg, W., Chanwimalueang, T., Adjei, T., Jaffer, U., Goverdovsky, V., and Mandic, D. P. (2017). Risolvere le ambiguità nel rapporto LF/HF: LF-HF scatter plot per la categorizzazione dello stress mentale e fisico da HRV. Front. Physiol. 8:360. doi: 10.3389/fphys.2017.00360
PubMed Abstract | CrossRef Full Text | Google Scholar