Introduzione
Il riso ha una complessa architettura radicale con un mix di radici embrionali e post-embrionali. La radichetta emerge per prima durante la germinazione, seguita subito dopo dalle radici coronarie embrionali (Rebouillat et al., 2009; Coudert et al., 2010). Le prime radici avventizie post-embrionali risultanti dall’attività del meristema apicale del germoglio appaiono pochi giorni dopo la germinazione della piantina. Le radici avventizie sono anche chiamate radici coronarie o di corona e sono prodotte durante tutta la vita di una pianta.
L’anatomia interna delle radici del riso è ben descritta, in particolare negli stadi di semina (Rebouillat et al., 2009). Diversi tessuti concentrici (dalla periferia alla stele) sono situati tra l’epidermide e i tessuti vascolari (Figura 1). Questi tessuti, indicati collettivamente come “tessuto di terra”, sono talvolta indicati anche come “corteccia” (Lux et al., 2004). Qui, manteniamo il termine generico, cioè, tessuto di terra, per descrivere i tessuti esodermico, sclerenchima, corticale ed endodermico. Ci riferiamo alla “corteccia” come al tessuto situato tra l’endoderma e lo sclerenchima.
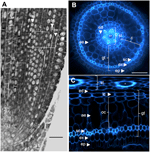
Figura 1. Anatomia di una radichetta di Nipponbare di 6 giorni. (A) Sezione longitudinale di una radichetta fissata e paraplast incorporata. Bar = 100 μm. (B) Sezione trasversale di una radichetta fresca osservata sotto la luce UV. Bar = 50 μm. (C) vista polare trasformata di B. Strati di tessuti sono etichettati come segue: stele (st), tessuto di terra (gt) composto da diversi strati cellulari: uno strato di endoderma (ed), diversi strati di corteccia (c), uno strato di sclerenchyma (sc), e uno strato di esoderma (ex). Gli strati endodermico (ed) ed esodermico (ex) sono facilmente identificabili dall’assenza/riduzione della fluorescenza nei centri della parete cellulare di queste cellule. La radichetta è protetta da uno strato di epidermide (ep). Due tipi di strati corticali possono essere identificati: corteccia interna (ic), che è vicina all’endoderma (ed), e corteccia esterna (oc), che alla fine formerà l’aerenchima (ae). Nella stele, si noti la presenza di un grande metaxylem centrale (cx) circondato da 6 vasi metaxylem (x).
Il tessuto terrestre è composto da diversi strati di tessuti che hanno la stessa origine parenchimatosa ma diverse caratteristiche specifiche che svolgono vari e importanti ruoli strutturali e funzionali nelle radici. Per esempio, l’esoderma e l’endoderma sono barriere apoplastiche che controllano il trasporto radiale di acqua e nutrienti dal suolo agli organi fotosintetici, una caratteristica fornita principalmente dalla deposizione di lamelle di suberina e dalla differenziazione della parete cellulare secondaria (Gregory, 2006). Gli sclerenchima sono cellule lignificate che rappresentano una barriera critica per alcuni metalli e probabilmente svolgono un ruolo di supporto meccanico (Huang et al., 2012). In contrasto con questi tre tessuti monostrato, il tessuto corticale nella radichetta di riso è composto da quattro o cinque strati. Questo tessuto, chiamato anche mid-cortex o mesoderma, è caratterizzato dalla formazione schizogena di spazi, che porta alla formazione di aerenchima nel riso (Justin e Armstrong, 1991; Kawai et al., 1998). L’aerenchima gioca un ruolo importante nella tolleranza alle condizioni di inondazione e assicura un flusso continuo di ossigeno dal germoglio alla radice, permettendo la crescita delle radici in condizioni anossiche. La corteccia ha una funzione importante ma variabile nella fisiologia delle radici di numerose specie ed è coinvolta nello stoccaggio, nella tolleranza alle inondazioni o nelle interazioni simbiotiche (Lux et al., 2004).
La radichetta e le radici della corona producono tre tipi di radici laterali: piccole radici laterali (SLR) e due tipi di grandi radici laterali (Kawata e Shibayama, 1965; Kono et al., 1972; Rebouillat et al., 2009). Questa divisione si basa su (i) il diametro della radice: Le SLR sono le più piccole (50-60 μm) e le L-LLR sono le più grandi (120-150 μm), (ii) le ramificazioni, che si osservano solo sulle LLR, (iii) la presenza di un vaso metaxylem centrale solo nelle LLR e (iv) la presenza di uno strato sclerenchyma solo nelle L-LLR (Kono et al., 1972; Kawata et al., 1977; Rebouillat et al., 2009). Nonostante questa classificazione, l’identità dei tessuti radicali interni nelle radici laterali, in particolare nelle SLR, rimane incerta. Infatti, Rebouillat et al. (2009) e Kawata et al. (1977) hanno entrambi affermato che il tessuto radicale delle SLR era composto da endoderma, sclerenchima ed esoderma (dall’interno verso l’esterno), mentre in Kono et al. (1972), lo strato cellulare sclerenchimatoso della corteccia interna era descritto come assente nei SLR e nei T-LLR.
Per risolvere questo dilemma, e per studiare lo sviluppo e la funzione di particolari tessuti in generale, è necessario l’uso di marcatori di identità. La maggior parte dei marcatori tissutali utilizzati finora sono marcatori morfologici o macchie istochimiche, che hanno fornito un modo utile per caratterizzare l’identità cellulare. La berberina rivela la presenza di suberina nelle pareti cellulari, che si trova quasi esclusivamente nelle strisce di Casparian che circondano ogni singola cellula di endoderma ed è quindi un buon marcatore indiretto di identità endodermica (Brundett et al., 1988). In A. thaliana, i marcatori tessuto-specifici sono stati sviluppati anche utilizzando promotori tessuto-specifici fusi a geni reporter (GUS e/o GFP) in piante geneticamente modificate. Per esempio, il promotore SCARECROW è usato come marcatore di identità endodermica (Sugimoto et al., 2010). Anche le linee QC25 e QC46 enhancer trap GUS (Sabatini et al., 2003) e QHB nel riso (Kamiya et al., 2003) sono state identificate come marcatori del centro quiescente (QC) sulla base della loro espressione QC-specifica. Nonostante l’interesse per questi marcatori, solo pochi sono disponibili e quasi esclusivamente in A. thaliana. Hanno anche degli svantaggi. Per esempio, l’idoneità di utilizzare il promotore SCARECROW (SCR) come un marcatore “endoderma” è discutibile quando si affrontano questioni specifiche sui ruoli SCR e SHORT ROOT (SHR) nella differenziazione dei tessuti di terra. Infatti, i geni SCR e SHR sono coinvolti di per sé nella formazione dell’endoderma/corteccia (Wu e Gallagher, 2014). In A. thaliana, gli unici marcatori di corteccia radicale disponibili sono i promotori Co2 e Co3 (Heidstra et al., 2004; Ten Hove et al., 2010). Nel riso, questi marcatori della corteccia non sono ancora utilizzati perché non ci sono ortologhi chiari per i geni Co2 e Co3. Solo marcatori morfologici indiretti sono stati usati finora nel riso, come la formazione di aerenchima per l’identità corticale (Rebouillat et al., 2009).
Un’altra classe di marcatori è costituita da anticorpi disponibili in commercio diretti contro le pareti cellulari delle piante (http://www.plantprobes.net/index.php). Questi marcatori sono stati usati poco in passato, ma la loro efficienza è stata dimostrata. Per esempio, gli anticorpi contro la parete cellulare CCRC-M2 e JIM13 sono stati usati in A. thaliana per mostrare che il singolo strato di tessuto interno presente nel mutante shr aveva identità corticale mentre lo strato di tessuto terrestre del mutante scr esibiva identità multiple (Di Laurenzio et al., 1996; Helariutta et al., 2000). Questi marcatori hanno molti vantaggi: la loro semplicità e la possibilità di combinare anticorpi secondari accoppiati a fluorocromi diversi per limitare la sovrapposizione con auto-fluorescenza, non richiedono la trasformazione genetica e possono essere utilizzati per integrare altre classi di marcatori.
In questo lavoro, abbiamo prima descrivere un semplice medio-throughput protocollo per immunolabeling sezioni di tessuto fresco vibratome. Usando questo protocollo, abbiamo esaminato sezioni radiali di radichette di riso con una grande libreria di 174 anticorpi della parete cellulare. Tra questi, abbiamo identificato otto marcatori specifici della corteccia e dimostrato che il riso possiede due tipi di tessuti corticali con identità distinta. Abbiamo chiamato questi strati corteccia interna ed esterna in base alla loro rispettiva posizione anatomica nelle sezioni della radice. Per dimostrare l’utilità di questi marcatori specifici della corteccia, abbiamo chiarito le identità dei tessuti di terra delle radici laterali usando tre di questi anticorpi. Nelle radici laterali, in particolare, dimostriamo che lo strato di tessuto interno ha un’identità corticale esterna. Il nostro protocollo è abbastanza generico da essere utilizzato per lo sviluppo di marcatori di tessuto in qualsiasi specie senza la necessità di generare piante transgeniche. Questo protocollo può essere facilmente adattato con germogli freschi, foglie, radici o qualsiasi tessuto in altre piante e rappresenta un modo semplice e facile per identificare i marcatori tessuto-specifici. Inoltre, questi marcatori possono essere utilizzati in combinazione con altri marcatori molecolari.
Risultati
Immunoprofiling di anticorpi della parete cellulare in sezioni radiali della radice di riso rivela anticorpi specifici per strati corticali
Con l’obiettivo di identificare marcatori basati su anticorpi per le cellule corticali, abbiamo prima stabilito un protocollo per immunolabeling medio throughput di sezioni radiali di radici di riso fresco (vedi Materiali e metodi e Figura supplementare 1 per i dettagli). Poi, abbiamo eseguito uno screening con anticorpi monoclonali sollevati contro i componenti della parete cellulare (dal Complex Carbohydrate Research Center (CarboSource Services, Athens Georgia, USA) e Paul Knox Cell Wall lab (università di Leeds, UK), vedi Materiali e metodi per i dettagli)) per identificare i marcatori della corteccia. Dai 174 anticorpi testati, solo 12 sono stati mantenuti come putativamente specifici della corteccia. Abbiamo testato la loro ripetibilità eseguendo due ulteriori esperimenti e concluso che otto anticorpi visualizzati profili simili e robusti tra i tre replicati (Figura 2). Cinque anticorpi (JIM7, M14, M38, M130, e M131) fornito lo stesso modello immunolabeling nella corteccia. Solo le pareti cellulari non adiacenti sono stati etichettati, con conseguente singolare “forma di diamante” etichettatura di tutte le cellule corticali. Per gli altri tre anticorpi (LM5, M133 e M107), l’etichettatura è stata rilevata nella corteccia e talvolta nelle cellule dello sclerenchima, in particolare con gli anticorpi LM5 e M107. Il segnale era omogeneo sulla parete cellulare della corteccia, ma era molto più debole negli strati interni della corteccia (lo strato di corteccia adiacente allo strato endodermico) che negli strati esterni della corteccia. Quindi, tutti questi anticorpi con profili complementari ai tessuti corticali sono marcatori specifici che possono essere utilizzati per analizzare l’identità delle cellule corticali. Inoltre, le due diverse etichette corticali, che definiscono due aree sottocorticali, suggeriscono che gli strati esterni e interni hanno un’identità molecolare distinta che è stata rivelata da questi anticorpi.
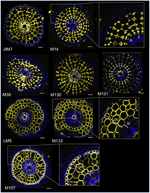
Figura 2. Identificazione di otto anticorpi specifici corteccia (JIM7, M14, M38, M130, M131, LM5, M133, e M107) tra i 174 schermati dalla libreria di anticorpi monoclonali parete cellulare. Per ogni anticorpo, le immagini fuse di sezioni trasversali sono state ottenute al microscopio confocale dopo l’etichettatura immunoistologica: in giallo, il modello dell’anticorpo a 561 nm, e in blu, l’autofluorescenza della parete cellulare alla luce UV. Cinque anticorpi (JIM7, M14, M38, M130, e M131) mostrano un profilo simile all’interno di tutti gli strati cellulari corticali colorati (rombi). Tre anticorpi (LM5, M133, e M107) omogeneamente etichettato pareti cellulari corticali. Si noti che per questi anticorpi, gli strati corticali interni (ic) non sono macchiati rispetto agli strati corticali esterni (oc). Gli inserti sono primi piani delle immagini corrispondenti. Barre = 20 μm.
Alcune caratteristiche specifiche di questi due strati sottocorticali sono state evidenziate quando il plugin “trasformatore polare” del software ImageJ (http://imagej.nih.gov/ij/) è stato utilizzato per visualizzare le immagini delle sezioni di radice (Figure 1B,C; Schneider et al., 2012; Lartaud et al., 2014). Le cellule interne erano caratterizzate da una parete cellulare spessa rispetto alle cellule esterne, che presentavano varie cavità contenenti aria derivanti dalla fusione della parete cellulare. Le cellule corticali interne mostravano anche una forma appiattita che ricordava le cellule endodermiche, in contrasto con le cellule esterne, che erano più rotonde. In questa immagine trasformata, la parete cellulare radiale che è parete che corre dal lato interno della cellula al lato esterno, l’autofluorescenza delle cellule endodermiche ed esodermiche non sono visibili, presumibilmente a causa della presenza di strisce di Casparian. Allo stesso modo, ma in misura minore, piccoli fori esenti da autofluorescenza erano anche visibili sulle pareti cellulari radiali delle cellule corticali interne.
Tutti i tipi di radici laterali possiedono solo tessuto corticale esterno
Per dimostrare l’utilità dei marcatori della corteccia e per caratterizzare l’identità delle cellule, abbiamo marcato i tre tipi di radici laterali di riso (L-LLR, T-LLR e SLR) con tre di questi anticorpi (M107, M133 e M14). Per questo esperimento, poiché le L-LLR non si sviluppano spesso su piastre di Petri, le radici laterali sono state raccolte da piantine di riso coltivate in condizioni idroponiche per 2 settimane. Abbiamo prima analizzato l’organizzazione del tessuto di terra di ogni tipo di radice laterale osservando l’autofluorescenza delle pareti cellulari nelle viste trasversali e polari delle sezioni della radice (Figura 3). Questa prima analisi ha rivelato un’anatomia radiale interna leggermente distinta per i tre tipi di radici laterali. Simile alle sezioni di radice viste sotto la luce UV, i tessuti endodermici ed esodermici possono essere identificati dall’estinzione della fluorescenza al centro delle pareti cellulari radiali. Questi due tessuti erano presenti in tutte le radici laterali. Tra l’endoderma e l’esoderma, diversi strati di tessuto erano presenti nelle L-LLR e nelle T-LLR, mentre le SLR possedevano solo un singolo strato cellulare (non identificato). L’anatomia delle L-LLR assomigliava alle radici seminali e all’esterno dell’endoderma, diversi strati di tessuto corticale erano facilmente identificabili quando si formava il tessuto aerenchima. Inoltre, è stato osservato anche uno strato di sclerenchima formato da cellule strettamente imballate con ampie pareti cellulari. A seconda dell’esperimento, questo strato cellulare non era sempre completamente sviluppato. Nelle sezioni T-LLR, lo strato esterno assomigliava al tessuto corticale e lo strato interno assomigliava al singolo strato SLR (non identificato).
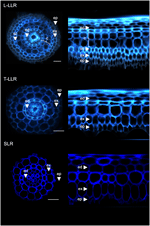
Figura 3. Composizione del tessuto dei tipi di grandi radici laterali (Large-LLR e Thin-LLR) e delle piccole radici laterali (SLR). Le piantine sono state coltivate in condizioni idroponiche per 2 settimane. Autofluorescenza della parete cellulare di sezioni trasversali e vista polare trasformata sotto la luce UV. I tessuti sono etichettati come segue: epidermide (ep), esoderma (ex), corteccia (c), endoderma (ed). Si noti che l’epidermide (ep) era spesso frammentato nel corso dell’esperimento. Barre = 20 μm.
Per identificare gli strati cellulari presenti nei tessuti di terra SLR e T-LLR e per confermare l’identità corticale nelle L-LLR, abbiamo immunolabeled sezioni radice laterale con tre anticorpi specifici corteccia (M107, M133 e M14; Figura 4). Gli anticorpi M107 e M133 hanno etichettato tutti gli strati cellulari situati tra l’endoderma e l’esoderma in tutte le radici laterali. Sulla base della colorazione delle radiche per questi anticorpi, questa osservazione ha indicato che questi strati cellulari potrebbero avere identità sclerenchima o corticale. Tuttavia, il fatto che M14 ha anche immunizzato questi strati, in particolare nelle sezioni SLR, dimostra chiaramente che questi strati avevano identità corticale esterna.

Figura 4. Immagini fuse dei tipi di grandi radici laterali (Large-LLR e Thin-LLR) e delle sezioni di piccole radici laterali (SLR) immunomarcate con M107, M133 e M14. Le piantine sono state coltivate in condizioni idroponiche per 2 settimane. In giallo, etichettatura anticorpo a 561 nm, e in blu, autofluorescenza sotto la luce UV. I tessuti sono etichettati come segue: epidermide (ep), esoderma (ex), corteccia (c), endoderma (ed). Si noti che l’epidermide (ep) era spesso frammentata nel corso dell’esperimento. Barre = 20 μm.
Variazioni nel numero di strati cellulari corticali esterni (uno nei SLR, due nei T-LLR, tre nei L-LLR e da quattro a cinque nella radichetta) giocano un ruolo importante nei diametri delle radici di riso (Figura 5).
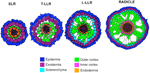
Figura 5. Rappresentazione schematica dei tessuti della radice laterale e della radichetta.
Conclusioni
Diversi termini sono già stati usati per qualificare le aree subcorticali nelle piante. Per esempio, la presenza di uno strato corticale “interno” lignificato, paragonabile a quello studiato qui, è già stato descritto nel riso selvatico (Yang et al., 2014). Nel mais, i due domini corticali sono definiti diversamente (Baluška et al., 1993). Il dominio “interno” forma l’aerenchima, che qui corrisponde alla corteccia esterna, e la corteccia “medio-esterna” è un tessuto di supporto lignificato, che potrebbe essere lo sclerenchima. In Arabidopsis, è stato descritto anche uno strato di cellule della “corteccia media”, situato tra il monostrato corticale e l’endoderma (Baum et al., 2002; Paquette e Benfey, 2005). Risultati recenti suggeriscono che questo strato corticale, la cui formazione è regolata da GA, stress ossidativo, e SHR e SCR tra gli altri, svolge un ruolo nella tolleranza abiotica (Paquette e Benfey, 2005; Cui e Benfey, 2009; Pauluzzi et al., 2012; Wu e Gallagher, 2014). È interessante notare che questo strato è anche descritto come uno strato elicoidale con una forma tipica (Baum et al., 2002). Questo strato di “corteccia media” dell’Arabidopsis potrebbe essere funzionalmente e strutturalmente simile allo strato di corteccia interna della radichetta di riso? Nelle sezioni longitudinali e trasversali del riso, lo strato corticale interno forma solitamente un’elica, suggerendo che questi due strati di tessuto potrebbero essere comparabili. In Arabidopsis, lo strato di “corteccia media” deriva da una divisione endodermica periclinale, che appare lontano dal QC tra 7 e 14 giorni dopo la germinazione (Paquette e Benfey, 2005). Nuovi strumenti saranno necessari per verificare questi importanti parametri nel riso. Per esempio, finora non è stato descritto nessun mutante che influenzi i tempi di formazione di questo strato. Inoltre, sono necessari anche progressi tecnici nell’imaging del QC del riso. Tuttavia, i nostri marcatori specifici per la corteccia offrono un nuovo strumento per confrontare la funzione e la rete molecolare coinvolta nella corteccia interna (riso) rispetto alla formazione della “corteccia media” (Arabidopsis). Il lavoro è in corso nel nostro laboratorio per identificare i determinanti molecolari della formazione della corteccia interna ed esterna, con gli ortologhi del riso SCR e SHR come primi candidati per la regolazione della formazione della corteccia nelle radici del riso (Pauluzzi et al., 2012).
Materiali e metodi
Materiale vegetale
Semi di sei giorni
Semi di Oryza sativa L. ssp. japonica Nipponbare sono stati coltivati verticalmente in piastre Petri sterili (Corning, 431301; 20 × 20 cm) in condizioni controllate (ritmo giorno/notte: 12/12 h, 28/25°C, intensità luminosa: 500 μE m-2 s-1). In primo luogo, i semi sono stati sterilizzati in superficie risciacquando in etanolo al 70% per ~1 min. Poi, l’etanolo è stato sostituito da una soluzione composta da candeggina 40% in acqua distillata contenente tre gocce di tween 80 (Sigma-Aldrich P4780-500 mL). I semi sono stati immersi in questa soluzione per 30 minuti con una leggera agitazione, e poi risciacquati almeno quattro volte con acqua distillata sterile. Caldo (~50°C) sterilizzato in autoclave metà forza Murashige e Skoog (MS/2) media (250 mL) è versato in piastre di Petri, e lasciare solidificare per ~ 45 min. Il mezzo solido MS/2 è composto da 2,15 g.L-1 di miscela di sale basale MS medium (Duchefa Biochemie, M0221), 75 mg.L-1 di miscela di vitamine MS (Duchefa Biochemie, M0409), e 8 g.L-1 di agarosio tipo II (Sigma-Aldrich, A6877). I semi sterili sono stati poi spinti nel terreno MS/2 solidificato con la radichetta orientata verso il basso. Le radici sono state raccolte dopo 6 giorni di crescita.
Piante di quattro settimane
Dopo 3 giorni di germinazione in acqua, le piantine sono state trasferite in un sistema idroponico in condizioni controllate (ritmo giorno/notte: 12/12 h, 28/25°C, intensità luminosa: 500 μE m-2 s-1, umidità relativa: 55%). Il sistema idroponico consiste in una scatola di plastica da 50 L contenente 30 L di soluzione idroponica su cui è posato un materasso di schiuma spesso 1 cm. Il materasso di schiuma è forato con degli spazi vuoti per mantenere le basi degli steli delle piantine. Il mezzo idroponico è composto da (NH4)2SO4 (0,5 mM), MgSO4.7H2O (1,6 mM), Ca(NO3)2.4H2O (1,2 mM), KNO3 (0,7 mM), FeSO4 (0,1 mM), Na2EDTA (0,1 mM), MnSO4. H2O (1,7 μM), (NH4)6Mo7O24.4H2O (0,2 μM), ZnSO4.7H2O (0,2 μM), CuSO4.5H2O (0,2 μM), H3BO3 (1,4 μM), e KH2PO4 (0,6 mM). La soluzione è aerata da una pompa posta sul fondo della scatola di plastica e cambiata ogni 10 giorni. Il pH è stato regolato e mantenuto a 5.4 ± 0.2.
Sezionamento delle radici fresche
Le punte delle radichette in crescita o delle radici laterali (2 cm) sono state tagliate con una lama affilata e messe parallele tra loro per allineare le punte delle radici (Figure supplementari 1A,B). Sono stati incorporati in una goccia di agarosio fuso al 3% (50°C; Figura supplementare 1C). Le patch contenenti le punte delle radici sono stati inseriti in un 3 × 1 × 1-cm pozzo riempito con 3% di agarosio fuso (Figura supplementare 1D). Dopo la solidificazione, i blocchi sono stati ridimensionati e incollati su una piastra vibratome per essere affettato. Il vibratome (Hm650v (Thermo Scientific Microm)) i parametri erano velocità 30, frequenza 70, ampiezza 0,8, e spessore 60 micron (Figura supplementare 1E). Sezioni sono stati trasferiti sia su vetrini da camera (Lab-teak 177402) per immunostaining (Figura supplementare 1F), o su vetrini umidificati con 1X tampone fosfato alcalino (PBS, Sigma-Aldrich P3813) per l’osservazione.
Immunolocalizzazione
Le sezioni poste sui vetrini da camera (tre per camera) sono stati prima sciacquati in glicina 0,1 M integrato con 1X PBS e poi due volte in 1X PBS, ciascuno per 10 minuti. I tessuti sono stati poi immersi in una soluzione PBS contenente 5% di siero fetale bovino (soluzione bloccante, Thermo Fisher 37520) a 4°C per una notte sotto agitazione. Gli anticorpi primari, diluiti 1/10 in questa soluzione bloccante, sono stati applicati per una notte a 4°C sotto agitazione. Le sezioni sono state poi sciacquate 3 volte in PBS 1X per 10 minuti. Le sezioni di radice sono state incubate per 2 ore con l’anticorpo secondario diluito 500 volte in soluzione bloccante sotto agitazione. Questi anticorpi sono stati accoppiati a un fluoroforo, Alexa 546 anticorpo anti-ratto (Invitrogen A11081) o Alexa 546 anticorpo anti-topo (Invitrogen A11060). Poi, le sezioni sono state risciacquate di nuovo tre volte in 1X PBS sotto agitazione, per 10 minuti ciascuna. Le camere sono state rimosse e sono state aggiunte alcune gocce di mezzo di montaggio mowiol (Sigma-Aldrich 81381). Un vetrino coprioggetto è stato posto sulle sezioni di radice, che sono state lasciate asciugare per 36 ore a 4°C al buio.
Fissazione paraplast
I radicchi cresciuti su piastre Petri per 6 giorni sono stati fissati in paraformaldeide 4% (in PBS 1X) durante la notte a 4°C e sciacquati due volte usando PBS 1X (Jackson, 1991). I tessuti fissati sono stati disidratati in etanolo, puliti in Histochoice Clearing Agent (HistoClear, Sigma Aldrich), e incorporati in Paraplast (Fisher). I tessuti sono stati sezionati (6 μm di spessore) su un microtomo Leica RM2255 e montati su vetrini SuperfrostPlus (Fisher).
Microscopia
Le osservazioni in campo chiaro e in autofluorescenza sono state effettuate utilizzando un microscopio Leica DM4500. Per l’autofluorescenza, le immagini sono state prese con il cubo del filtro “A” (campo di eccitazione: UV; filtro di eccitazione: BP 340-380; filtro di soppressione: LP 425). Le sezioni immunocolorate sono state osservate con microscopi confocali: Zeiss LSM 510 o Leica SP8. Le pareti cellulari sono state prima visualizzate usando l’autofluorescenza. L’anticorpo secondario è stato visualizzato utilizzando un laser Elio/Neon a 543 o 561 nm rispettivamente. Le immagini sono state scattate con una fotocamera a colori Retiga 2000R (QIMAGING, Canada) con il software di acquisizione immagini Volocity (Improvision, UK).
Contributi degli autori
SH, FD, MB, CB: acquisizione dei dati; SH, CP, AD analisi dei dati; SH, EG, CP, AD: redazione del manoscritto.
Dichiarazione di conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Ringraziamo MRI (Montpellier RIO Imaging plateform), PHIV e La Gaillarde Plateforms per il loro supporto tecnico per immunolocalizzazione e/o imaging confocale e multifotone. SH è supportato da una borsa di dottorato CIRAD.
Materiale supplementare
Il materiale supplementare per questo articolo può essere trovato online su: https://www.frontiersin.org/article/10.3389/fpls.2015.01139
Abbreviazioni
ae, aerenchima; c, corteccia; ed, endoderma; ep, epidermide; ex, esoderma; gt, tessuto di terra; ic, corteccia interna; L-LLR, Large-type Large Lateral Root; oc, outer cortex; sc, sclerenchyma; SLR, Small Lateral Root; st, stele; T-LLR, Thin-type Large Lateral Root; x, xylem.
Baluška, F., Brailsford, R. W., Hauskrecht, M., Jackson, M. B., e Barlow, P. W. (1993). Dimorfismo cellulare nella corteccia radicale del mais: coinvolgimento di microtubuli, etilene e gibberellina nella differenziazione del comportamento cellulare nelle zone di crescita postmitotica. Bot. Acta 106, 394-403. doi: 10.1111/j.1438-8677.1993.tb00766.x
CrossRef Full Text | Google Scholar
Baum, S. F., Dubrovsky, J. G., and Rost, T. L. (2002). Organizzazione apicale e maturazione della corteccia e cilindro vascolare in Arabidopsis thaliana (Brassicaceae) radici. Am. J. Bot. 89, 908-920. doi: 10.3732/ajb.89.6.908
PubMed Abstract | CrossRef Full Text | Google Scholar
Brundett, M. C., Enstone, D. E., and Peterson, C. A. (1988). Una procedura di colorazione fluorescente blu di berberina-anilina per suberina, lignina e callosità nei tessuti vegetali. Protoplasma 146, 133-142. doi: 10.1007/BF01405922
CrossRef Full Text | Google Scholar
Coudert, Y., Périn, C., Courtois, B., Khong, N. G., e Gantet, P. (2010). Controllo genetico dello sviluppo delle radici nel riso, il cereale modello. Trends Plant Sci. 15, 219-226. doi: 10.1016/j.tplants.2010.01.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., e Benfey, P. N. (2009). Interazione tra SCARECROW, GA e LIKE HETEROCHROMATIN PROTEIN 1 nel patterning del tessuto di terra nella radice di Arabidopsis. Plant J. 58, 1016-1027. doi: 10.1111/j.1365-313X.2009.03839.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Laurenzio, L., Wysocka-Diller, J., Malamy, J. E., Pysh, L., Helariutta, Y., Freshour, G., et al. Il gene SCARECROW regola una divisione cellulare asimmetrica che è essenziale per generare l’organizzazione radiale della radice di Arabidopsis. Cell 86, 423-433. doi: 10.1016/S0092-8674(00)80115-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Gregory, P. J. (2006). Radici delle piante: Growth, Activity, and Interaction with Soils. Oxford; Ames, IA: Blackwell Pub.
Google Scholar
Heidstra, R., Welch, D., and Scheres, B. (2004). Analisi a mosaico con attivazione marcata e cloni di delezione dissecano l’azione di Arabidopsis SCARECROW nella divisione cellulare asimmetrica. Genes Dev. 18, 1964-1969. doi: 10.1101/gad.305504
PubMed Abstract | CrossRef Full Text | Google Scholar
Helariutta, Y., Fukaki, H., Wysocka-Diller, J., Nakajima, K., Jung, J., Sena, G., et al. Il gene SHORT-ROOT controlla il patterning radiale della radice di Arabidopsis attraverso la segnalazione radiale. Cell 101, 555-567. doi: 10.1016/S0092-8674(00)80865-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, C. F., Yamaji, N., Ono, K., and Ma, J. F. (2012). Un gene leucina-ricco ripetere recettore-come kinasi è coinvolto nella specificazione degli strati cellulari esterni in radici di riso. Plant J. 69, 565-576. doi: 10.1111/j.1365-313X.2011.04824.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Jackson, D. (1991). “Ibridazione in situ nelle piante” in Molecular Plant Pathology: A Practical Approach, eds D. J. Bowles, M. McPherson, and S. J. Gurr (Totowa, NJ: Humana Press), 163-174.
Google Scholar
Justin, S. H. F. W., and Armstrong, W. (1991). Prove del coinvolgimento dell’etilene nella formazione dell’aerenchima nelle radici avventizie del riso (Oryza sativa L.). New Phytol. 118, 49-62. doi: 10.1111/j.1469-8137.1991.tb00564.x
CrossRef Full Text | Google Scholar
Kamiya, N., Nagasaki, H., Morikami, A., Sato, Y., and Matsuoka, M. (2003). Isolamento e caratterizzazione di un gene omeobox di tipo WUSCHEL del riso che è specificamente espresso nelle cellule centrali di un centro quiescente nel meristema apicale della radice. Plant J. 35, 429-441. doi: 10.1046/j.1365-313X.2003.01816.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kawai, M., Samarajeewa, P. K., Barrero, R. A., Nishiguchi, M., e Uchimiya, H. (1998). Dissezione cellulare del modello di degradazione della morte delle cellule corticali durante la formazione dell’aerenchima delle radici del riso. Planta 204, 277-287. doi: 10.1007/s004250050257
CrossRef Full Text | Google Scholar
Kawata, S., Sasaki, O., and Yamazaki, K. (1977). Sulla struttura della radice della corona e della radice laterale, e la connessione dei vasi tra di loro, nelle piante di riso. Jpn. J. Crop. Sci. 46, 569-579. doi: 10.1626/jcs.46.569
CrossRef Full Text | Google Scholar
Kawata, S., and Shibayama, B. (1965). Sulla formazione di primordi di radici laterali nelle radici della corona della pianta di riso. Proc. Crop Sci. Soc. Jpn. 33, 423-431. doi: 10.1626/jcs.33.423
CrossRef Full Text | Google Scholar
Kono, Y., Igeta, M., e Yamada, N. (1972). Studi sulla fisiologia dello sviluppo delle radici laterali nelle radici seminali del riso. Jpn. J. Crop. Sci. 41, 192-204. doi: 10.1626/jcs.41.192
CrossRef Full Text
Lartaud, M., Perin, C., Courtois, B., Thomas, E., Henry, S., Bettembourg, M., et al. (2014). PHIV-RootCell: uno strumento di analisi delle immagini supervisionato per la quantificazione dei parametri anatomici delle radici di riso. Fronte. Plant Sci. 5:790. doi: 10.3389/fpls.2014.00790
PubMed Abstract | CrossRef Full Text | Google Scholar
Lux, A., Luxova, M., Abe, J., and Morita, S. (2004). Corteccia radicale: variabilità strutturale e funzionale e risposte allo stress ambientale. Root Res. 13, 117-131. doi: 10.3117/rootres.13.117
CrossRef Full Text | Google Scholar
Paquette, A. J., e Benfey, P. N. (2005). Maturazione del tessuto di terra della radice è regolata da gibberellina e SCARECROW e richiede SHORT-ROOT. Plant Physiol. 138, 636-640. doi: 10.1104/pp.104.058362
PubMed Abstract | CrossRef Full Text | Google Scholar
Pauluzzi, G., Divol, F., Puig, J., Guiderdoni, E., Dievart, A., e Périn, C. (2012). Navigare lungo la rete di geni del tessuto terrestre della radice. Dev. Biol. 365, 14-22. doi: 10.1016/j.ydbio.2012.02.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Rebouillat, J., Dievart, A., Verdeil, J., Escoute, J., Giese, G., Breitler, J., et al. (2009). Genetica molecolare dello sviluppo delle radici del riso. Rice 2, 15-34. doi: 10.1007/s12284-008-9016-5
CrossRef Full Text | Google Scholar
Sabatini, S., Heidstra, R., Wildwater, M., e Scheres, B. (2003). SCARECROW è coinvolto nel posizionamento della nicchia delle cellule staminali nel meristema radicale dell’Arabidopsis. Genes Dev. 17, 354-358. doi: 10.1101/gad.252503
PubMed Abstract | CrossRef Full Text | Google Scholar
Schneider, C. A., Rasband, W. S., e Eliceiri, K. W. (2012). NIH Image a ImageJ: 25 anni di analisi delle immagini. Nat. Methods 9, 671-675. doi: 10.1038/nmeth.2089
PubMed Abstract | CrossRef Full Text | Google Scholar
Sugimoto, K., Jiao, Y., e Meyerowitz, E. M. (2010). Arabidopsis rigenerazione da più tessuti si verifica attraverso un percorso di sviluppo della radice. Dev. Cell 18, 463-471. doi: 10.1016/j.devcel.2010.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Ten Hove, C. A., Willemsen, V., de Vries, W. J., Van Dijken, A., Scheres, B., e Heidstra, R. (2010). SCHIZORIZA codifica un fattore nucleare che regola l’asimmetria delle divisioni delle cellule staminali nella radice di Arabidopsis. Curr. Biol. 20, 452-457. doi: 10.1016/j.cub.2010.01.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., e Gallagher, K. L. (2014). Il movimento del fattore di trascrizione non-cellula-autonomo, SHORT-ROOT si basa sul sistema endomembrana. Plant J. 80, 396-409. doi: 10.1111/tpj.12640
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, C., Zhang, X., Li, J., Bao, M., Ni, D., e Seago, J. L. (2014). Anatomia e istochimica di radici e germogli in riso selvatico (Zizania latifolia Griseb.). J. Bot. 2014, 9. doi: 10.1155/2014/181727
CrossRef Full Text | Google Scholar