US Pharm. 2012;37(5):HS-2-HS-7.
Il dolore è il motivo più comune per cui le persone cercano assistenza medica.1Uno studio recente stima che il dolore colpisce decine di milioni di americani e costa agli Stati Uniti 635 miliardi di dollari all’anno a causa dell’aumento del consumo di cure mediche e dei costi indiretti dei giorni di lavoro mancati e della perdita di produttività.2 La gestione del dolore cronico con farmaci come gli oppioidi è una strategia comune, ma il dolore cronico può persistere o peggiorare nonostante una terapia oppioide aggressiva. Questo articolo mira a far luce sul fenomeno degli oppioidi che vengono prescritti per trattare il dolore ma causano un nuovo o paradossale peggioramento del dolore.Questa condizione è chiamata iperalgesia indotta da oppioidi (OIH). OIH può essere più formalmente definito come aumento della sensibilizzazione nocicettiva causata dall’esposizione agli oppioidi.3OIH differisce distintamente dalla tolleranza, dipendenza, dipendenza, anddisease progressione. La prevalenza clinica di OIH è sconosciuta.4
Diagnosi e presentazione
Uno dei principali problemi nella corretta diagnosi di OIH è la stretta somiglianza della condizione alla tolleranza agli oppioidi. Tolleranza e OIHshare la caratteristica di ridotta risposta analgesica alla dose di oppioidi, e probabilmente condividere molti degli stessi meccanismi cellulari.5Tolleranza può essere superato aumentando la dose di oppioidi, mentre thesame aumento in un paziente con risultati OIH in dolore peggiorato.4 Inoltre, la tolleranza tende a sviluppare lentamente nel tempo, mentre theincreased dolore derivante dal trattamento con oppioidi nel paziente OIH si verificarelatively rapidamente. Spesso, l’OIH differisce dalla tolleranza in quanto l’intensità del dolore è più forte di quanto inizialmente riportato.6
Il dolore sottotrattato è un’altra possibilità che dovrebbe essere esclusa. Se la terapia oppioide è subottimale, l’aumento della dose dovrebbe portare ad un sollievo dal dolore; se è presente l’OIH, dovrebbe essere vero il contrario. Per una diagnosi accurata di OIH, il dolore deve risolvere una volta che il trattamento con l’oppioide incriminato viene interrotto.6 Per complicare ulteriormente le cose, l’iperalgesia derivante dalla sospensione degli oppioidi è un fenomeno ben documentato.7 Come tale, la risoluzione del dolore dalla sospensione degli oppioidi in OIH non sarà immediata e richiederà pazienza. Questo pone le proprie sfide sia al clinico che al paziente.
L’OIH tende a presentarsi con altre caratteristiche distinte (TABELLA 1). Il dolore associato all’OIH tende ad essere più diffuso e di minore qualità, e gli stimoli nocivi tendono ad essere più dolorosi di quanto ci si aspetterebbe normalmente. Nell’OIH, il dolore si manifesta spesso in aree che si estendono oltre la regione della lesione o del danno tissutale. Il dolore può persistere nell’OIH despiteremo la fonte originale del dolore o la guarigione del tessuto danneggiato. Nell’OIH, con il progredire del trattamento con oppioidi, il dolore può dare l’illusione di peggiorare rispetto a quanto originariamente riportato nonostante il tempo, il riposo e altre misure che normalmente permetterebbero una quantità clinicamente rilevante di guarigione.5 Inoltre, l’allodinia è stata dimostrata in un certo numero di studi umani e animali sull’OIH.8

Eziologia
Ci sono diverse teorie sulla causa dell’OIH. La teoria che è stata più studiata e che attualmente riceve più attenzione è il modello neuroeccitatorio. Si ritiene che certi oppioidi e i loro metaboliti agonizzino il recettore N-metil-D-aspartato (NMDA). L’attivazione del recettore NMDA provoca un afflusso di calcio che aumenta notevolmente l’eccitabilità del neurone. Quando il recettore NMDA e i neuroni corrispondenti sono più attivi, possono trasmettere più facilmente gli impulsi dolorosi iniziati dalla sostanza circolante Por altri stimoli nocivi. Il glutammato è il principale agonista endogeno del recettore NDMA.9
A sostegno di questa teoria della pronocicezione modulata dall’attivazione del recettore NMDA ci sono studi che mostrano il sollievo della OIH dopo la somministrazione di antagonisti del recettore NMDA. Questi antagonisti si legano in modo non competitivo al sito della fenciclidina sul canale NMDA e bloccano l’afflusso di calcio che si verificherebbe quando il recettore lega il glutammato o un altroagonista.10 Studi animali e umani hanno dimostrato che i soggetti con OIH a cui è stata somministrata la ketamina, un antagonista del recettore NMDA, hanno ottenuto risultati migliori durante il test dello stimolo del dolore controllato. In uno studio, ai ratti sono state somministrate iniezioni intratecali di morfina per diversi giorni fino a quando hanno visualizzato OIH che era sensibile al calore. La somministrazione di dizocilpina, un inibitore NMDA, è stata efficace nell’invertire almeno parzialmente l’iperalgesia termica.5 Altri antagonisti del recettore NMDA, come il destrometorfano, hanno dimostrato una certa evidenza di alleviare gli stati iperalgesici attraverso l’inibizione del recettore NMDA.
Gli oppioidi, come la codeina, l’idromorfone e la morfina, subiscono una serie di biotrasformazioni come parte del normale processo metabolico.La codeina viene metabolizzata in morfina dall’enzima CYP2D6. La morfina è metabolizzata in un certo numero di molecole, ma è metabolizzata principalmente attraverso la glucuronizzazione in morfina-3-glucuronide (M3G) e, in misura minore, morfina-6-glucuronide (M6G) (FIGURA 1).11
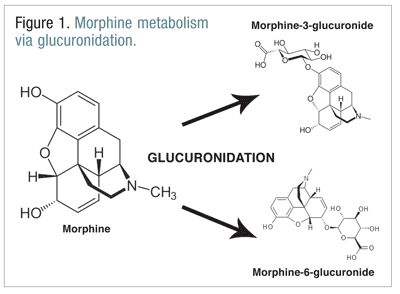
M6G è un metabolita terapeuticamente importante. Ha un’affinità di legame al recettore mu simile a quella della morfina ed è capace di produrre analgesia, depressione respiratoria e altri effetti simili a quelli della morfina. M3G, tuttavia, non è un agonista del recettore mu, e ha poca affinità per il recettore mu rispetto alla morfina. A differenza di morfina, M6G e altri oppioidi, M3G è un agonista NMDA. Throughglucuronidation, M3G è convertito ad un tasso circa sei volte maggiore di quello di M6G.12 Altri oppioidi sono stati implicati nell’avere attività NMDA agonista e paradossali effetti neuroeccitatori.6
A sostegno della teoria che OIH è causato da attività di recettori oltre il recettore oppioide mu è la prova che OIH non è alleviato dalla somministrazione di un antagonista oppioide (ad esempio, naloxone). In pazienti che sperimentano l’OIH mentre sono in terapia con oppioidi ad alte dosi, la somministrazione di naloxone ha causato un peggioramento del dolore.13 Spostando l’oppioide dal recettore mu, il naloxone ha impedito all’oppioide di fornire l’analgesia che era possibile attraverso l’attivazione del recettore mu, mentre contemporaneamente l’iperalgesia è rimasta incontrastata.14
Anche la dinorfina può essere coinvolta nello sviluppo dell’OIH.15La dinorfina è un peptide oppioide endogeno che si lega principalmente al recettore oppioidekappa e, in misura minore, ai recettori oppioide mu e NMDA. Si ritiene che l’agonismo della dinorfina del recettore oppioide kappa e del recettore NMDA abbia un ruolo nella pronocicezione dell’OIH nonostante la presenza di agonisti puri del recettore mu. Gli studi hanno dimostrato che l’inversione della dinorfina può ripristinare gli effetti analgesici della morfina quando ai soggetti viene dato un antisiero della dinorfina. Inoltre, dynorphinis noto per aumentare durante la somministrazione prolungata di oppioidi. Dynorphinalso provoca il rilascio di neuropeptidi eccitatori all’interno di diverse posizioni nel sistema nervoso centrale.
Opzioni di trattamento
Una volta che la diagnosi di OIH è stata fatta, ci sono un certo numero di opzioni di trattamento da cui scegliere attentamente. A condizione che la lesione dolorosa iniziale o il danno tissutale si sia risolto e che il dolore persista nonostante e a causa del trattamento con oppioidi, l’approccio più diretto è quello di interrompere l’oppioide incriminato. Questo dovrebbe essere fatto gradualmente per ridurre al minimo gli effetti negativi dell’astinenza. Va notato che l’iperalgesia può probabilmente peggiorare all’inizio del processo di sospensione.16 Questo presenta una situazione etica impegnativa in cui il medico può avere difficoltà a convincere il paziente che il farmaco prescritto per trattare il dolore può essere stato causa o peggiorare il dolore e che il dolore può peggiorare ancora prima che alla fine si risolva.17
Se il dolore legittimo persiste e una certa quantità di analgesia con oppioidi è richiesto, altre strategie oltre la totale sospensione degli oppioidi dovrebbe essere esplorato. I pazienti che sperimentano l’OIH possono ottenere sollievo riducendo la dose di oppioidi.4 Ci sono rapporti di pazienti che trovano un equilibrio accettabile di analgesia e sollievo dall’iperalgesia con la riduzione della dose di oppioidi.
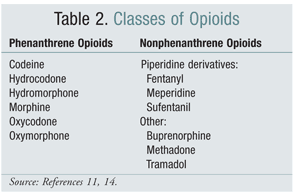
Il passaggio da una classe strutturale di oppioidi a un’altra è stata un’opzione efficace per mitigare l’OIH in alcuni studi. Gli studi condotti finora hanno dimostrato che l’OIH è più fortemente associata agli oppioidi della classe dei fenantrene (TABELLA 2).4 La titolazione dell’oppioide fenantrene e la conversione ad un altro possono fornire la risoluzione dell’OIH. La codeina, l’idromorfone, la morfina e gli oppioidi strutturalmente simili subiscono la glucuronizzazione come parte del loro metabolismo. Evitare un metabolita glucuronide attivante il recettore NMDA è possibile passando a un oppioide che è strutturalmente unico, come il fentanyl. Al momento in cui scriviamo, l’OIH non è stato dimostrato in studi che coinvolgono l’oxymorphone.4
Integrare la terapia oppioide con un inibitore della ciclo-ossigenasi 2 (COX-2) è un’altra strategia che ha qualche supporto. Riducendo la sintesi delle prostaglandine, gli inibitori COX-2 possono diminuire la sensibilizzazione dei neuroni pronocicettivi. I farmaci antinfiammatori non steroidei (FANS) e gli inibitori COX-2 sembrano avere effetti analgesici indipendenti dalla loro capacità di sopprimere la sintesi di prostaglandine a livello periferico.9 Gli inibitori COX-2 hanno anche dimostrato la capacità di antagonizzare il recettore NMDA. A livello centrale, i FANS sono in grado di antagonizzare il recettore NMDA bloccando il glutammato, la sostanza P e altri aminoacidi eccitatori. Indipendentemente da questo, l’attivazione del recettore NMDA può aumentare l’espressione della COX-2.18
Data l’attenzione che il recettore NMDA ha ricevuto per il suo ruolo nell’OIH, antagonizzare questo recettore sembrerebbe essere una strategia di trattamento ragionevole. La ketamina è stata molto studiata, ma i suoi effetti avversi possono essere gravi. Mentre antagonizza NMDA e fornisce un effetto anestetico che promuoverebbe l’analgesia, gli effetti collaterali sono comuni, diversi e gravi.19 Questi effetti includono tachiaritmia, ipertensione, disturbi cognitivi e reazioni psicomimetiche, compresi i cambiamenti di umore, sogni vividi, delirio, allucinazioni e sedazione. La ketamina è efficace nell’invertire l’iperalgesia e nell’aumentare gli effetti degli oppioidi nei pazienti che ricevono grandi dosi, ma i suoi effetti avversi le impediscono di essere una valida opzione di trattamento.
Il destrometorfano è un altro antagonista del recettore NMDA che è stato studiato per il trattamento dell’OIH. È stato studiato un prodotto di combinazione contenente una miscela 1:1 di morfina e destrometorfano.20 Gli studi non sono riusciti a dimostrare che la terapia di combinazione potrebbe raggiungere un’analgesia superiore rispetto alla morfina da sola. Simili fallimenti della terapia si sono verificati in uno studio che ha utilizzato una miscela 2:1 degli stessi agenti. Gli studi sono stati criticati per avere una quantità insufficiente di destrometorfano per antagonizzare adeguatamente il recettore NMDA.21Ciò che rimane sconosciuto è la dose di destrometorfano necessaria per aumentare l’analgesia di un oppioide o prevenire l’OIH causata dall’attivazione del recettore NMDA.
Il metadone è un oppioide con qualità uniche che lo rendono un’opzione convincente per il trattamento del dolore nel paziente con OIH. Oltre ai suoi effetti analgesici attraverso il legame al recettore degli oppioidi mu, il metadone è un debole antagonista del recettore NMDA.4 È stato riportato che l’aggiunta anche di una bassa dose di metadone è stata efficace per ridurre l’iperalgesia. In un caso, l’aggiunta di metadone a basso dosaggio (10 mg due volte al giorno) ha migliorato notevolmente i rapporti sul dolore, con una riduzione della dose totale di oppioidi dal 40% al 50%.22 Il passaggio dall’oppioide incriminato al metadone è stata una strategia di trattamento popolare. Il tramadolo e la meperidina hanno anche una certa attività antagonista del recettore NMDA.
Un’altra modalità di trattamento che ha un certo potenziale per il trattamento dell’OIH è la buprenorfina.23,24 La buprenorfina è un agonista parziale degli oppioidi sul recettore mu e ha anche attività antagonista del recettore kappa.4 La dinorfina, un agonista del recettore kappa, è nota per aumentare durante il trattamento con oppioidi. L’attivazione del recettore kappa antagonizza ampiamente gli effetti mediati dal recettore mu degli oppioidi.25 L’utilità clinica della buprenorfina nel trattamento dell’OIH deve ancora essere completamente spiegata.
Conclusione: Guardando avanti
Molto lavoro resta da fare prima che si possa dichiarare che l’OIH è stata compresa. L’esatto meccanismo cellulare e le vie di segnalazione responsabili di questo fenomeno non sono definiti. A complicare il tutto, ci sono rapporti contrastanti sul fatto che componenti specifici giochino un ruolo chiave, o un qualsiasi ruolo. La maggior parte della ricerca sulla delucidazione della fisiopatologia dell’OIH ha coinvolto il modello animale. Questo ha un certo valore, ma le informazioni dal modello umano sono scarse.
Una debole comprensione della causa di una condizione genera un armamentario incerto di opzioni di trattamento. La migliore strategia disponibile è la sospensione totale dell’oppioide problematico, ma questo è di scarsa utilità per il paziente che richiede un sollievo dal dolore di tipo oppioide.Sono state esplorate diverse altre modalità di trattamento, ma tutte beneficerebbero di ulteriori studi. La maggior parte degli studi condotti sugli esseri umani coinvolge pazienti peri-operatori, tossicodipendenti in fase di recupero e modelli sperimentali di dolore. Questi studi non sono senza valore, ma queste popolazioni non rispecchiano la popolazione del dolore cronico. Altre limitazioni delle opzioni di trattamento disponibili includono risultati poco brillanti, eccessiva tossicità nonostante il successo moderato, e piccoli studi che producono conclusioni deboli.
Al momento della scrittura, un certo numero di studi clinici che utilizzano l’antagonista del recettore NMDA memantina per trattare l’OIH sono in corso o in programma.26 Ancora, ci sono rapporti contrastanti sul ruolo esatto dei recettori NMDA in OIH. Ulteriori ricerche devono essere fatte per determinare i recettori chiave responsabili e i meccanismi presenti nell’OIH. Espandere la dimensione del campione degli studi aiuterà a sostenere le conclusioni già fatte su quali agenti di trattamento sono responsabili dell’OIH ed efficaci per il suo trattamento. Condurre studi che si concentrano sul dolore cronico, piuttosto che su modelli di dolore acuto, può portare informazioni clinicamente rilevanti al professionista.
Chapman e colleghi hanno sollevato domande specifiche che devono essere affrontate prima che la diagnosi di OIH e un trattamento efficace possano essere forniti.27 Quali sono le relazioni tra la dose e la durata degli oppioidi e l’OIH? Con quale tipo di dolore, o in quale tipo di paziente, è più probabile che si sviluppi l’OIH? Queste sono le domande che devono guidare la ricerca clinica futura.
1. Parselis Kelly J, Cook SF, Kaufman DW, et al. Prevalenza e caratteristiche dell’uso di oppioidi nella popolazione adulta statunitense. Dolore. 2008;138:507-513.
2. Istituto di medicina. Alleviare il dolore in America: A Blueprint for Transforming Prevention, Care, Education, and Research. Washington, DC: The National Academies Press; 2011.
3. Chu LF, Angst MS, Clark D. Opioid-induced hyperalgesia negli esseri umani: meccanismi molecolari e considerazioni cliniche. Clin J Pain. 2008;24:479-496.
4. Lee M, Silverman SM, Hansen H, et al. A comprehensive review of opioid-induced hyperalgesia. Medico del dolore. 2011;14:145-161.
5. Mao J. Sensibilità al dolore anormale indotta da oppioidi: implicazioni nella terapia clinica degli oppioidi. Dolore. 2002;100:213-217.
6. Raffa RB, Pergolizzi JV Jr. Iperalgesia indotta da oppioidi: è clinicamente rilevante per il trattamento dei pazienti con dolore? Pain Manage Nurs. 2011;1-17.
7. Li X, Clark JD. Iperalgesia durante l’astinenza da oppioidi: mediazione di glutammato e sostanza P. Anesth Analg. 2002;95:979-984.
8. Pud D, Cohen D, Lawental E, Eisenberg E. oppioidi e anormale painperception: nuove prove da uno studio di tossicodipendenti oppioidi cronici e soggetti sani. Droga Alcol Dipendenza. 2006;82:218-223.
9. Malmberg AB, Yaksh TL. Iperalgesia mediata dal recettore spinale della sostanza P del glutammato o bloccato dall’inibizione della cicloossigenasi spinale. Scienza. 1992;257:1276 -1279.
10. Fisher K, Coderre TJ, Hagen NA. Targeting del recettore N-metil-D-aspartato per la gestione del dolore cronico. Studi preclinici su animali, recente esperienza clinica e future direzioni di ricerca. J Pain Symptom Manage. 2000;20:358-373.
11. Lötsch J. Metaboliti degli oppioidi. J Pain Symptom Manage. 2005;29:S10-S24.
12. Skarke C, Lötsch J. Metaboliti della morfina: implicazioni cliniche. Semin Anesth, Perioperative Med Dolore. 2002;21:258-264.
13. Juni A, Klein G, Kest B. L’iperalgesia da morfina nei topi non è correlata all’attività oppioide, all’analgesia o alla tolleranza: evidenza di molteplici sistemi iperalgesici diversi. Brain Res. 2006;1070:35-44.
14. Angst M, Clark JD. Iperalgesia indotta da oppioidi: una revisione sistematica qualitativa. Anesthesiology. 2006;104:570-587.
15. Vanderah TW, Gardell LR, Burgess SE, et al. Dynorphin promuove il dolore anormale e spinale tolleranza antinocicettivo oppioide. J Neurosci. 2000;20:7074-7079.
16. Hooten WM, Mantilla CB, Sandroni P, Townsend CO. Associationsbetween percezione del dolore da calore e la dose di oppioidi tra i pazienti con dolore cronico sottoposti a tapering oppioide. Pain Med. 2010;11:1587-1598.
17. Silverman S. Iperalgesia indotta da oppioidi: implicazioni cliniche per il professionista del dolore. Medico del dolore. 2009;12:679-684.
18. Li SQ, Xing YL, Chen WN, et al. Attivazione del recettore NMDA è associato con up-regolazione dell’espressione COX-2 nel dorsale spinale durante gli ingressi nocicettivi nei ratti. Neurochem Res. 2009;34:1451-1463.
19. Okon T. Ketamina: un’introduzione per il medico del dolore e della medicina palliativa. Medico del dolore. 2007;10:493-500.
20. Galer BS, Lee D, Ma T, et al. MorphiDex (combinazione idrobromuro di morfinesolfato/ destrometorfano) nel trattamento del dolore cronico: tre studi clinici multicentrici, randomizzati, in doppio cieco, controllati non riescono a dimostrare una maggiore analgesia oppioide o una riduzione della tolleranza. Dolore. 2005;115:284-295.
21. Wiesenfeld-Hallin Z. Terapie combinate oppioidi-NMDA antagonista.Quali vantaggi offrono per il controllo delle sindromi del dolore? Farmaci. 1998;55;1-4.
22. Vorobeychik Y, Chen L, Bush MC, Mao J. Miglioramento dell’effetto analgesico degli oppioidi dopo la riduzione della dose di oppioidi. Pain Med. 2008;9:724-727.
23. Baron MJ, McDonald PW. Significativa riduzione del dolore in pazienti con dolore cronico dopo la disintossicazione da oppioidi ad alte dosi. J Opioid Manag. 2006;2:277-282.
24. Koppert W, Ihmsen H, Körber N, et al. Diversi profili di analgesia indotta da buprenorfina e anti-iperalgesia in un modello di dolore umano. Pain. 2005;118:15-22.
25. Pan ZZ. Azioni mu-oppositive del recettore kappa-opioide. Trends Pharmacol Sci. 1998;19:94-98.
26. Ballantyne JC, Mao J. Terapia oppioide per il dolore cronico. N Engl J Med. 2003;349:1943-1953.
27. Chapman CR, Lipschitz DL, Angst MS, et al. Opioid pharmacotherapyfor chronic non-cancer pain in the United States: a research guidelinefor developing an evidence-base. J Pain. 2010;11:807-829.