Definizione di legame idrogeno
Il legame idrogeno è una forza di attrazione tra un idrogeno parzialmente carico positivo e un atomo parzialmente carico negativo (ossigeno e azoto). Si tratta di un legame molto debole e la forza del legame a idrogeno (5-10 Kcal per legame) è molto inferiore alla forza del legame covalente. I legami a idrogeno sono di solito mostrati come linee tratteggiate tra due atomi. Per esempio il legame a idrogeno tra due molecole d’acqua è mostrato qui sotto:
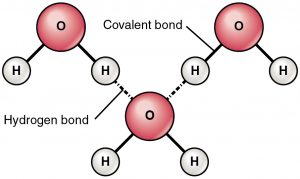
Ragione del legame a idrogeno
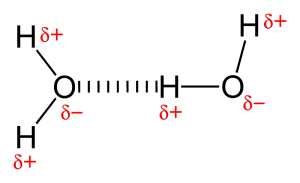
A causa della presenza di atomi molto elettronegativi come ossigeno o azoto, la coppia di elettroni condivisa tra ossigeno e idrogeno è tirata verso l’atomo più elettronegativo. Questa distribuzione ineguale della coppia di elettroni porta alla formazione di due dipoli parziali. L’idrogeno parzialmente caricato positivamente è quindi attratto dall’altro ossigeno o azoto parzialmente caricato negativamente ed è noto come legame a idrogeno.
Tipi di legame a idrogeno
Il legame a idrogeno può avvenire tra due atomi della stessa molecola o tra due atomi di molecole diverse. A seconda di ciò il legame a idrogeno è di due tipi:
- Collegamento a idrogeno intermolecolare
- Collegamento a idrogeno intramolecolare
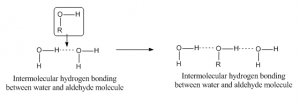
Collegamento a idrogeno intermolecolare
Quando il legame a idrogeno avviene tra due atomi di molecole diverse allora è chiamato legame a idrogeno intermolecolare. Per tale legame una molecola dovrebbe avere un idrogeno parzialmente positivo come atomo accettore e un’altra dovrebbe avere un atomo parzialmente negativo o donatore. Come per esempio, il legame a idrogeno tra l’aldeide e la molecola d’acqua è dato di seguito:
2. Legame a idrogeno intramolecolare
Quando il legame a idrogeno si verifica tra due atomi parzialmente carichi della stessa molecola, si chiama legame a idrogeno intramolecolare. Questo si verifica quando due gruppi funzionali sono presenti nella stessa molecola e sono in modo tale che possono attrarsi a vicenda per formare un legame a idrogeno. Per esempio, l’acido salicilico ha due gruppi funzionali alcol e acido carbossilico. Qui il legame a idrogeno intramolecolare si verifica tra l’atomo di idrogeno del gruppo alcool e l’atomo di ossigeno del gruppo acido carbossilico.
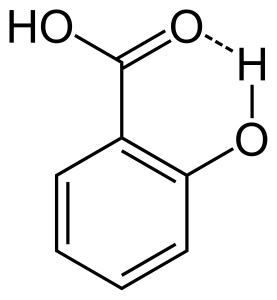
Effetti del legame a idrogeno
Sul punto di ebollizione
Si prevede che il punto di ebollizione di sostanze con peso molecolare uguale o simile dovrebbe avere un punto di ebollizione uguale o simile. Il punto di ebollizione dell’etere e dell’alcano di peso molecolare simile non sono molto distanti. Ma il punto di ebollizione degli alcoli è molto più alto dell’etere di peso molecolare simile. Questo può essere spiegato in termini di legami a idrogeno. A causa dei legami a idrogeno nell’alcool il punto di ebollizione sale. È necessaria un’energia extra per rompere il legame a idrogeno prima che bolla. Poiché non ci sono legami a idrogeno, alcano ed etere hanno un basso punto di ebollizione.

Sulla solubilità
Gli alcoli sono solubili in acqua ma gli alcani no. Questo perché i composti intermolecolari legati a idrogeno possono dissolversi in un solvente intermolecolare legato a idrogeno. Una molecola polare come l’alcol può entrare in due molecole d’acqua per formare un legame a idrogeno, mentre una sostanza non polare come gli alcani non può. Tuttavia, con l’aumento della catena di carbonio negli alcoli, la solubilità diminuisce perché la catena lunga ostacola la formazione del legame a idrogeno.
Sommario
- Il legame a idrogeno è una forza attrattiva tra un idrogeno parzialmente carico positivo e un atomo parzialmente carico negativo.
- Quando il legame a idrogeno si verifica tra atomi di molecole diverse, è chiamato legame a idrogeno intermolecolare.
- Quando il legame a idrogeno si verifica tra due atomi parzialmente carichi della stessa molecola che è chiamato legame a idrogeno intramolecolare.
- A causa del legame a idrogeno intermolecolare il punto di ebollizione dei composti polari sono più alti di quelli non polari con lo stesso a.
- A causa del legame a idrogeno tra composto organico e acqua, la solubilità è possibile in una certa misura.