Introduzione
L’infezione da virus dell’epatite B (HBV) è la causa più comune di cirrosi epatica e carcinoma epatocellulare nella maggior parte dell’Asia.1,2 La patogenesi dell’epatite cronica è mediata dall’interazione tra la reazione immunitaria dell’ospite e gli epatociti che presentano gli antigeni dell’HBV.3,4 Studi precedenti hanno dimostrato che l’espressione degli antigeni dell’HBV da parte degli epatociti è importante in relazione allo stadio e all’attività della malattia epatica cronica. Nella fase di tolleranza immunitaria, gli antigeni del nucleo dell’epatite B (HBcAg) si trovano principalmente nel nucleo e sono correlati alla replicazione dell’HBV mentre, nella successiva fase di clearance immunitaria, si verifica uno spostamento intraepatico degli HBcAg dal nucleo al citoplasma ed è associato alle attività istologiche dell’epatite cronica.5,6 Nei casi di espressione intraepatica dell’antigene di superficie dell’epatite B (HBsAg), sono stati riportati tre modelli: tipo omogeneo, tipo I di epatociti di vetro smerigliato (GGH) e tipo II GGH. I modelli omogenei in presentazioni raggruppate, discrete o deboli sono stati osservati in pazienti con viremia elevata o epatite attiva. I GGH di tipo I sono tipicamente sparsi singolarmente nei lobuli epatici con un’espressione omogenea densa simile a un’inclusione, mentre i GGH di tipo II esprimono antigeni di superficie alla periferia degli epatociti, che si raggruppano, e sono generalmente presenti durante la fase di bassa replicazione e diventano prevalenti dall’epatite attiva alla cirrosi epatica e al carcinoma epatocellulare.7-10 Quindi, entrambe le espressioni intraepatiche di HBcAg e HBsAg sono strettamente legate al corso naturale dell’infezione e della replicazione dell’HBV.
Tra le fasi dell’epatite cronica B, la fase di immunizzazione o denominata epatite cronica B HBeAg-positiva si è spesso verificata in una popolazione più giovane, ha esibito attività istologiche meno gravi e ha ospitato un minor numero di mutazioni precore A1896 e del promotore del nucleo basale (BCP) T1762/A1764 rispetto all’epatite cronica B HBeAg-negativa.11-14 Il decorso dell’epatite cronica B è dinamico e deriva dall’interazione tra la replicazione virale e il sistema immunitario dell’ospite. Di conseguenza, la diversità delle caratteristiche cliniche o delle attività istologiche è comunemente osservata nei pazienti HBeAg positivi. Per esempio, dal 34 al 55% dei pazienti presenta fibrosi bridging o cirrosi nell’istologia epatica, mentre i rimanenti pazienti presentano una fibrosi lieve.15,16 È stato dimostrato che l’accumulo di HBsAg negli epatociti si associa a specifiche mutazioni virali ed è correlato alle attività della malattia.8,9 È interessante studiare le caratteristiche dell’espressione intraepatica di HBsAg in pazienti con istologia epatica di gravità diversa.
I mutanti virali si sono solitamente evoluti sotto la pressione della sorveglianza immunitaria dell’ospite. Tra i mutanti naturali dell’HBV, le mutazioni BCP T1762/A1764 sono diventate prevalenti con la progressione della malattia e sono state frequentemente associate alla malattia epatica avanzata e al carcinoma epatocellulare.17,18 Anche i modelli di espressione intraepatica dell’HBsAg sono cambiati durante il corso naturale dell’epatite cronica B. L’associazione delle mutazioni BCP T1762/A1764 e l’espressione intraepatica dell’HBsAg è ancora sconosciuta e resta da studiare.
Quindi, lo scopo di questo studio è stato quello di valutare le caratteristiche dell’espressione intraepatica dell’HBsAg e di analizzare l’associazione con l’istologia epatica, i marcatori di replicazione virale e i mutanti dell’HBV nell’epatite cronica B positiva all’HBeAg.
Materiale e metodiPazienti
In totale 181 pazienti positivi all’epatite B e antigene (HBeAg) naïve al trattamento che soddisfacevano i criteri di inclusione sono stati arruolati retrospettivamente in questo studio. I criteri di inclusione erano un’età superiore a 18 anni e inferiore a 70 anni, HBsAg sierico positivo da più di 6 mesi e livello di HBV DNA sierico ≥ 100.000 copie/mL, livello anormale di alanina aminotransferasi nel siero, nessun’altra eziologia spiegabile di epatite cronica, incluso l’alcol, l’epatite autoimmune o i marcatori del virus dell’epatite C, del virus dell’epatite D o dell’infezione da virus dell’immunodeficienza umana, e la mancanza di una storia di trattamento anti-HBV e di un campione di biopsia epatica disponibile per la valutazione istologica. Il siero e la biopsia epatica di tutti i pazienti sono stati campionati prima dei trattamenti antivirali, e i campioni sono stati conservati a -70 oC fino al test. Questo studio è stato approvato dall’Institutional Review Board del National Cheng Kung University Hospital (No: ER-99-398). È stato ottenuto il consenso informato, secondo la Dichiarazione di Helsinki.
I test virologici dell’HBV
La genotipizzazione dell’HBV è stata eseguita mediante la reazione a catena della polimerasi multipla, come descritto altrove.19 Il livello di HBV DNA nel siero è stato misurato utilizzando il test COBAS Amplicor HBV Monitor (COBAS-AM assay, Roche Diagnostics, Branchburg, NJ). Il livello di HBsAg nel siero è stato quantificato con Abbott Architect HB-sAg QT (Abbott Diagnostics, Rungis, Francia) con un range dinamico di 0,05-250,0 IU/mL. I campioni con livelli di HBsAg >250 IU/mL sono stati ritestati a diluizioni di 1:20 e 1:1000.
Reazione a catena della polimerasi e sequenziamento delle regioni precore e BCP
Il DNA di HBsAg è stato estratto da 50 μl di siero usando Blood and Tissue Genomic Mini Kit (VIOGENE, Taipei, Taiwan). La PCR first-round è stata eseguita nelle seguenti condizioni: 96 oC per 2 min, 94 oC per 1 min, 54 oC per 1 min, e 72 oC per 2 min con i primer 5′-ACCTCTGCACGTAGCATGG (avanti) e 3′-GGATTAAAGACAGGTACAGTAGAAG (indietro). Il secondo round di PCR è stato eseguito nelle stesse condizioni con i primer 5′-ATGTCAACGACCGACCTTGA (forward) e 3′-TTCCCACCTTATGAGTCCAAG (reverse). I prodotti PCR purificati sono stati poi sequenziati direttamente utilizzando un sequenziatore automatico di DNA ABI 310 e il kit ABI PRISM Big Dye Terminator Cycle Sequencing Ready Reaction (Applied Biosystems) con il primer forward che è stato utilizzato durante il secondo round PCR.
Istologia del fegato
L’istologia del fegato è stata valutata da un singolo patologo che non era a conoscenza dei background dei pazienti. La necroinfiammazione e la fibrosi sono state valutate in base al grado di necroinfiammazione di Knodell (da 0 a 18)20 e allo stadio di fibrosi di Ishak (da 0 a 6),21 rispettivamente.
La colorazione immunoistochimica è stata eseguita come descritto altrove.22 In breve, sezioni deparaffinate di 5 μm di spessore sono state incubate con anticorpi monoclonali di topo anti-HBsAg (clone 3E7, Dako Corp., Carpinteria, USA) e anti-HBcAg (Novocastra Laboratories, Newcastle, UK) per una notte a 4°C. La diluizione ottimale di anti-HBsAg o anti-HBcAg è stata determinata utilizzando tessuto epatico da portatore di HBV come controllo positivo. Il kit StrAviGen Super Sensitive MultiLink (BioGenex) è stato utilizzato per rilevare il complesso immunitario risultante. L’attività della perossidasi è stata visualizzata con un kit di substrato di carbazolo aminoetilico (Zymed Laboratory, Inc, San Francisco, CA). Infine, le sezioni sono state controcolorate con ematossilina. Come controllo negativo, l’immunoglobulina di topo non immune è stata sostituita all’anticorpo primario nell’incubazione. Sono stati registrati i modelli di espressione dell’HBcAg nel nucleo, nel citoplasma o in entrambi. I modelli di espressione dell’HBsAg sono stati classificati come omogenei, GGH di tipo I, GGH di tipo II.22 Gli epatociti macchiati in modo omogeneo sono stati identificati come epatociti con colorazione citoplasmatica omogenea da moderata a forte; i GGH di tipo I sono stati identificati come epatociti con colorazione globulare densa o “a inclusione”, e i GGH di tipo II sono stati identificati come epatociti con colorazione dell’antigene di superficie ai margini delle cellule o alla periferia.6,22 Le GGH di tipo I si disperdono singolarmente o si raggruppano nei lobuli epatici, mentre le GGH di tipo II si raggruppano costantemente nei noduli. I livelli di espressione di HBcAg e HBsAg sono stati valutati in modo semiquantitativo in base alla proporzione di cellule immunomarcate, su una scala da 0 a 4+, corrispondente alla positività in 0, 1-10, 11-25, 25-50% e più del 50% degli epatociti esaminati.
Le analisi statistiche
I dati sono stati espressi come media ± deviazione standard. Le variabili continue sono state confrontate usando il test Mann-Whitney U o Kruskal-Wallis ANOVA per l’analisi univariata. Le variabili categoriche sono state analizzate usando il test χ2 o il test esatto di Fisher. I fattori indipendenti che erano associati ai livelli di espressione intraepatica dell’HBsAg sono stati eseguiti utilizzando l’analisi di regressione logistica multivariata. La gestione dei dati e le analisi statistiche sono state eseguite utilizzando il software SPSS per Windows, versione 17.0 (SPSS Inc., Chicago, IL).
RisultatiCaratteristiche dei pazienti arruolati
La tabella 1 elenca le caratteristiche demografiche dei 181 pazienti arruolati. La maggior parte dei pazienti erano maschi (69,1%) e il 63,0% di essi presentava il genotipo C dell’HBV. La mutazione precore A1896 è stata rilevata in 20 pazienti (11,0%) e le mutazioni BCP T1762/A1764 sono state rilevate in 38 pazienti (21,0%). Dei 181 pazienti, la colorazione HB-sAg positiva è stata rilevata in 105 pazienti (58,0%). I pazienti con colorazione dell’HBsAg presentavano un HBsAg sierico significativamente più elevato (P
Caratteristiche cliniche, virologiche e istologiche dei 181 pazienti.
| Caratteristiche | Valore | |||
|---|---|---|---|---|
| Espressione di HBsAg | Valore P | |||
| Tutti i pazienti (n = 181) | Negativi (n = 76) | Positivi (n = 105) | ||
| Età (anni) ± SD | 36.4 ± 10.5 | 34.2 ± 9.2 | 38.0 ± 11.2 | 0.009 |
| Gender (male/female) | 125/56 | 50/26 | 75/30 | 0.418 |
| Livello medio AST (U/L) ± SD | 59.7 ± 51.2 | 58.7 ± 42.5 | 60.5 ± 56.8 | 0.634 |
| Livello medio di ALT (U/L) ± SD | 116.3 ± 124.2 | 120.2 ± 100.8 | 113.5 ± 139.1 | 0,282 |
| Genotipo HBV (B/C) | 114/67 | 66/10 | 48/57 | |
| Precore: G1896/A1896 | 20/161 | 13/63 | 7/98 | 0.027 |
| BCP:* mutante/selvatico | 38/143 | 12/64 | 26/79 | 0.144 |
| HBV DNA (copie log/mL) | 8.4 ± 1.1 | 4.0 ± 0.7 | 4.3 ± 0.7 | |
| Livello HBsAg ((log IU/mL) | 4.2 ± 0.7 | 8.1 ± 1.0 | 8.6 ± 1.1 | 0.003 |
| Grado medio di necroinfiammazione Knodell ± SD | 5.0 ± 3.0 | 5.3 ± 2.8 | 4.7 ± 3.0 | 0.128 |
| Stadio di fibrosi Ishak medio ± SD | 1.8 ± 1.6 | 1.7 ± 1.2 | 1.9 ± 1.7 | 0.703 |
Mutante, T1762 e A1764; selvaggio, A1762 e T1764. Il test χ2 è stato utilizzato per le variabili di sesso, genotipo HBV, mutazioni del promotore del core precore e basale, mentre il test Mann-Whitney U è stato utilizzato per le altre variabili. AST: aspartato aminotransferasi. ALT: alanina aminotransferasi. BCP: promotore del nucleo basale. HBV: virus dell’epatite B.
Modelli di distribuzione dell’espressione di HBsAg
Per quanto riguarda i 105 pazienti che hanno mostrato l’espressione di HBsAg, è stato rilevato un modello omogeneo (Figura 1A) in 34 (32.4%) pazienti, tipo I GGH (Figura 1B) è stato rilevato in quello di 50 (47,6%), tipo II GGH (Figura 1C) è stato rilevato in quello di sette (6,7%), e un modello misto è stato rilevato in quello di 14 (13,3%). Come indicato nella tabella 2, una maggiore prevalenza di mutazioni BCP T1762/A1764 è stata osservata nel tipo II GGH (P = 0,001) rispetto agli altri modelli. C’era una relazione reciproca tra l’espressione dell’HBsAg e i marcatori di replicazione virale nel siero. La figura 1D mostra che i pazienti con espressione GGH di tipo II avevano livelli più bassi di HBV DNA e titoli di HBsAg, ma livelli più alti di espressione intraepatica di HBsAg (Figura 1D). Inoltre, l’istologia epatica visualizzata di tipo II GGH mostrava attività di necroinfiammazione e fibrosi epatica significativamente più gravi e un livello più elevato di espressione intraepatica di HBsAg (Figura 1E).
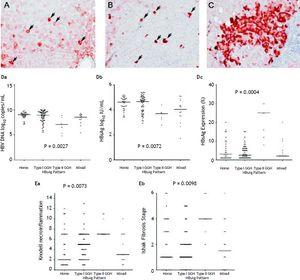
Modelli di presenza di HBsAg. A. Alcuni epatociti macchiati di HBsAg a citoplasma omogeneo da moderato a forte (frecce) in uno sfondo di epatociti debolmente macchiati. Il nucleo di ogni epatocita macchiato omogeneamente era situato al centro della cellula. B. L’epatocita di vetro smerigliato di tipo I (GGH) con densa colorazione globulare o “inclusion-like” dell’HBsAg (frecce) era sparso nel parenchima epatico. C. Un gruppo di GGH di tipo II ha mostrato una colorazione di HBsAg al margine o alla periferia della cellula. Correlazioni tra i modelli di espressione di HBsAg e il livello di HBV DNA nel siero (Da), il livello di HBsAg nel siero (Db) e il livello di espressione intraepatica di HBsAg (Dc). L’associazione dei pattern di espressione dell’HBsAg con il grado di necroinfiammazione di Knodell (Ea) e lo stadio di fibrosi di Ishake (Eb). I confronti tra i gruppi sono stati analizzati da Kruskal-Wallis ANOVA.
Caratteristiche demografiche per modelli di distribuzione f espressione HBsAg.
| HBsAg Pattern (n = 105) | ||||||
|---|---|---|---|---|---|---|
| Misto (n = 14) | Homogenous | Tipo I GGH | Tipo II GGH | Valore P | ||
| (n = 34) | (n = 50) | (n = 7) | ||||
| Età (anni) ± SD | 36.3 ± 9.2 | 36.3 ± 10.0 | 39.2 ± 12.7 | 40.0 ± 7.9 | 0.104 | |
| Gender (maschio/femmina) | 11/3 | 26/11 | 35/15 | 6/1 | 0.720 | |
| Livello medio AST (U/L) ± SD | 64.9 ± 56.5 | 61.1 ± 38.6 | 49.9 ± 28.3 | 122.4 ± 168.7 | 0.474 | |
| Livello medio di ALT (U/L) ± SD | 116.7 ± 112.4 | 114.6 ± 91.1 | 91.5 ± 63.8 | 259.1 ± 447.6 | 0,651 | |
| Genotipo HBV (B/C) | 10/4 | 15/19 | 22/28 | 1/6 | 0,085 | |
| Precore: G1896/A1896 | 0/14 | 3/31 | 4/46 | 0/7 | 0.594 | |
| BCP:* mutante/selvatico | 4/10 | 4/30 | 12/38 | 6/1 | 0.001 | |
| HBV DNA (copie log/mL) | 3.9 ± 1.0 | 4.5 ± 0.5 | 4.4 ± 0.7 | 3.6 ± 0.5 | 0.001 | |
| Livello HBsAg ((log IU/mL) | 8.2 ± 1..1 | 8.9 ± 0.7 | 8.7 ± 1.1 | 6.9 ± 1.5 | ||
| Grado di necroinfiammazione knodell ± SD | 4.2 ± 2.9 | 4.2 ± 3.3 | 4.7 ± 2.7 | 8.6 ± 2.0 | 0.003 | |
| Stadio di fibrosi di Ishak ± SD | 1.9 ± 1.9 | 1.9 ± 1.9 | 1.5 ± 1.3 | 4.1 ± 1.5 | 0.007 |
Mutante, T1762 e A1764; selvaggio, A1762 e T1764. Il test χ2 è stato utilizzato per le variabili di sesso, genotipo HBV, mutazioni del promotore del core precore e basale, mentre il test Mann-Whitney U è stato utilizzato per le altre variabili. AST: aspartato aminotransferasi. ALT: alanina aminotransferasi. BCP: promotore del nucleo basale. HBV: virus dell’epatite B.
Livello di espressione HBsAg
La figura 2A a 2D mostra l’illustrazione della misurazione semiquantitativa dell’espressione HBsAg. In questo studio nessun paziente aveva una scala 4+ di espressione dell’HBsAg. È stata osservata una relazione reciproca tra replicazione virale e istologia epatica. I pazienti con scala 2+/3+ di espressione dell’HBsAg avevano livelli più bassi di titoli HBsAg e livelli di HBV DNA, ma un grado di necroinfiammazione e uno stadio di fibrosi significativamente gravi rispetto ai pazienti con scala 1+ di espressione HBsAg e colorazione HBsAg negativa (Figura 2E). I pazienti con grado di necroinfiammazione Knodell ≥ 5 o stadio di fibrosi Ishake ≥ 1 avevano percentuali significativamente più alte di espressione di HBsAg (Figura 3).
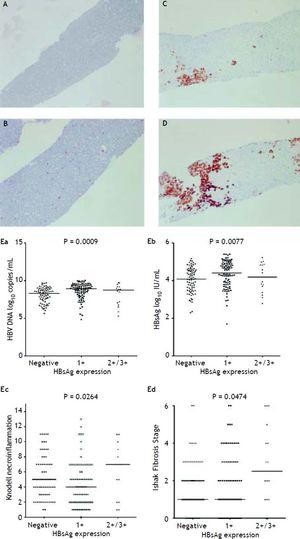
L’espressione di HBsAg misurata semiquantitativamente secondo la proporzione di cellule immunomarcate, su una scala da 0 a 3+, corrispondente alla positività in (A) 0% (0), (B) 1-10% (C) 11-25% (2+), e (D) 25-50% (3+) degli epatociti esaminati. Correlazioni tra il livello di espressione dell’HBsAg e i livelli sierici di HBV DNA (Ea) e HBsAg (Eb), il grado di necroinfiammazione di Knodell (Ec) e lo stadio di fibrosi di Ishak (Ed). I confronti tra i gruppi sono stati analizzati mediante Kruskal-Wallis ANOVA.

Correlazione dell’espressione dell’HBsAg intraepatico con il grado di necroinfiammazione di Knodell (A) e lo stadio di fibrosi di Ishak (B). I confronti tra i gruppi sono stati analizzati con il test U di Mann-Whitney.
Caratteristiche cliniche dell’espressione di HBsAg
In primo luogo, abbiamo esaminato l’associazione dei fattori virali e l’espressione di HBcAg/HBsAg. L’espressione dell’HBsAg, non quella dell’HBcAg, ha mostrato un livello significativamente più basso in presenza della mutazione precore (P = 0,001). I pazienti con genotipo C hanno mostrato un maggiore stadio di fibrosi epatica (P = 0,004). Nei pazienti con mutazioni BCP T1762/A1764, c’era un grado di necroinfiammazione e uno stadio di fibrosi significativamente maggiori, e una minore espressione di HBcAg sia nel citoplasma che nel nucleo. Tutte queste osservazioni indicavano un danno epatico attivo. Inoltre, i pazienti con mutazioni BCP T1762/A1764 hanno mostrato una maggiore espressione intraepatica di HBsAg (9,3 ± 8,0% vs. 4,3 ± 5,0%, P = 0,008) (Tabella 3). Inoltre, abbiamo esaminato i fattori che possono associarsi ai livelli di espressione di HB-sAg. Nella tabella 4, c’erano 16 pazienti che mostravano scale 2+/3+ di espressione di HBsAg e 1+ in quella di 89 pazienti. Un’analisi univariata ha mostrato che le scale 2+/3+ dell’espressione dell’HBsAg erano associate alle mutazioni BCP T1762/A1764 e a una necroinfiammazione e fibrosi epatica più gravi. Un’analisi di regressione multivariata ha rivelato che le mutazioni BCP T1762/A1764 erano il fattore indipendente associato a scale 2+/3+ di espressione intraepatica di HBsAg.
Caratteristiche cliniche, virologiche e istologiche dei pazienti con o senza mutanti virali.
| Mutazione del nucleo | P value | MutazioniBCP | P value | |||
|---|---|---|---|---|---|---|
| No (n = 98) | Sì (n = 7) | No (n = 79) | Sì (n = 26) | |||
| Età (anni) ± SD | 37.8 ±11.0 | 40.0 ± 13.7 | 0.541 | 36.0 ± 10.6 | 43.8 ±11.1 | 0.005 |
| Gender (male/female) | 70/28 | 5/2 | 1.000 | 54/25 | 21/5 | 0.318 |
| Livello medio AST (U/L) ± SD | 60.0 ± 58.3 | 71.3 ± 30.5 | 0.072 | 51.5 ± 32.1 | 87.3 ± 95.6 | 0.007 |
| Livello medio di ALT (U/L) ±SD | 112.2 ± 143.6 | 131.6 ± 39.1 | 0.031 | 98.2 ± 77.9 | 160.0 ± 242.0 | 0.080 |
| Genotipo HBV (B/C) | 45/53 | 3/4 | 1.000 | 44/35 | 4/22 | |
| Precore: G1896/A1896 | 6/73 | 1/25 | 0.678 | |||
| BCP:* mutante/wild | 25/73 | 1/6 | 0.678 | |||
| HBV DNA (copie log/mL) | 3.9 ± 1.0 | 4.5 ± 0.5 | 0,959 | 4,5 ± 0,6 | 3,7 ± 0,6 | |
| Livello HBsAg ((log IU/mL) | 8.2 ± 1.1 | 8.9 ± 0.7 | 0.892 | 8.8 ± 0.9 | 7.7 ± 1.4 | |
| Grado di necroinfiammazione Knodell ± SD | 4.6 ± 3.0 | 6.1 ± 3.1 | 0.142 | 3.9 ± 2.7 | 7.2 ± 2.7 | |
| Stadio di fibrosi Ishak ± SD | 1.8 ± 1.8 | 2.1 ± 0.9 | 0.286 | 1.3 ± 1.4 | 3.4 ± 1.6 | |
| HBcAg espressione citoplasmatica (%) | 53.6 ± 25.8 | 44.3 ± 30.5 | 0.402 | 56.3 ± 25.4 | 42.7 ± 25.8 | 0.018 |
| HBcAg espressione nucleare (%) | 13.5 ± 17.3 | 17.6 ± 31.6 | 0.800 | 17.6 ± 20.0 | 2.3 ±4.1 | |
| HBsAg espressione (%) | 5.8 ± 6.5 | 2.4 ± 1.5 | 0.274 | 4.3 ± 5.0 | 9.3 ± 8.0 | 0.003 |
Mutante, T1762 e A1764; selvaggio, A1762 e T1764. Il test χ2 è stato utilizzato per le variabili di sesso, genotipo HBV, mutazioni del promotore del core precore e basale, mentre il test Mann-Whitney U è stato utilizzato per le altre variabili. AST: aspartato aminotransferasi. ALT: alanina aminotransferasi. BCP: promotore del nucleo basale. HBV: virus dell’epatite B.
L’associazione di caratteristiche demografiche e gradi di espressione di HBsAg.
| Univariata | Multivariata | |||||
|---|---|---|---|---|---|---|
| espressione HBsAg, scala | 1+ (n = 89) | 2+/3+ (n = 16) | P value | Odds ratio (95% CI) | P value | |
| Age | 38.2 ±11.2 | 36.6 ±11.1 | 0.608 | 0.963 (0.903-1.026) | 0.242 | |
| Gender (male/female) | 63/26 | 12/4 | 1.000 | |||
| Livello diAST (U/L) | 55.0 ± 37.7 | 90.4 ± 113.2 | 0.234 | 1.026 (0.991∼1.063) | 0.142 | |
| LivelloALT (U/L) | 103.3 ± 84.4 | 170.1 ± 297.2 | 0.386 | 0.991 (0.978∼1.005) | 0.216 | |
| Genotipo HBV (B/C) | 42/47 | 6/10 | 0.589 | 0.994 (0.234∼4.231) | 0.994 | |
| Mutazione Precore A1896 (+/-) | 7/82 | 0/16 | 0.592 | 0.000 (0.000∼) | 0.999 | |
| BCP:*mutante/Wild | 17/72 | 9/7 | 0.003 | 6.356 (1.204∼33.356) | 0.029 | |
| Livello HBsAg (log10IU/mL) | 4.3 ± 0.7 | 4.2 ± 0.8 | 0.180 | 2.096 (0.598∼7.349) | 0.247 | |
| Serum HBV DNA (log10 copie/mL) | 8.6 ± 1.1 | 8.1 ± 1.4 | 0.135 | 0.731 (0.386∼1.383) | 0.335 | |
| gradazione della necroinfiammazione di Knodell | 4.4 ± 2.9 | 6.3 ± 3.3 | 0.027 | |||
| stadio della fibrosi di Ishak | 1.7 ± 1.6 | 2.9 ± 2.1 | 0.041 | |||
| HBcAg espressione citoplasmatica (%) | 53.1 ± 25.8 | 52.3 ± 28.5 | 0.915 | |||
| HBcAg espressione nucleare (%) | 14.4 ± 18.3 | 10.1 ± 19.3 | 0.389 | |||
Mutante, T1762 e A1764; selvatico, A1762 e T1764. Analisi univariata: il test χ2 è stato utilizzato per le variabili di sesso, genotipo HBV, mutazioni del promotore del nucleo precursore e basale, mentre il test Mann-Whitney U è stato utilizzato per le altre variabili. Analisi multivariata: Analisi di regressione logistica espressa come Odds ratio con intervallo di confidenza al 95% e valori P. AST: aspartato aminotransferasi. ALT: alanina aminotransferasi. BCP: promotore del nucleo basale. HBV: virus dell’epatite B.
Discussioni
L’espressione intraepatica dell’HBsAg è associata a diversi stadi replicativi e all’evoluzione della malattia nel corso naturale dell’epatite cronica B.7,10,23 Il GGH di tipo I si presenta prevalentemente nella fase attiva dell’epatite, mentre il GGH di tipo II si presenta principalmente nella fase inattiva o di cirrosi.8 In questo studio abbiamo dimostrato che il GGH di tipo II si associa a un’istologia epatica più grave, accompagnata da livelli sierici di HBV DNA e titoli di HBsAg significativamente più bassi e da livelli relativamente più elevati di espressione intraepatica di HBsAg. Questa relazione reciproca tra istologia epatica e replicazione dell’HBV ha indicato che la presenza di GGH di tipo II potrebbe essere un marcatore di malattia epatica avanzata durante l’evoluzione della malattia nell’epatite cronica B HBeAg positiva. È stato riportato che i modelli di espressione dell’HB-sAg sono correlati a mutazioni virali distinte che hanno un impatto sulla regolazione della replicazione dell’HBV e sul difetto di secrezione dell’antigene di superficie dagli epatociti.9,24 Il GGH di tipo II ha costantemente ospitato mutazioni di delezione Pre-S2 che hanno diminuito la sintesi delle proteine di superficie medie e quindi hanno portato all’accumulo di grandi proteine di superficie negli epatociti e al difetto di secrezione dell’HBsAg.25 In questo studio abbiamo eseguito la correlazione dell’HBsAg e dell’HBV DNA nel siero tra pazienti con o senza GGH di tipo II. Una moderata correlazione tra i due indicatori di replicazione dell’HBV è stata riscontrata nei pazienti senza GGH di tipo II (r = 0,686, P 26,27 La delezione di Pre-S potrebbe portare allo stress ER e attivare la trasduzione del segnale legata allo stress. Il danno ossidativo del DNA degli epatociti e i meccanismi di riparazione del DNA stimolati potrebbero provocare un’instabilità genomica che peggiora il danno epatico e predispone alla carcinogenesi.28
Oltre ai modelli di espressione dell’HBsAg, abbiamo scoperto che livelli di espressione più elevati si accompagnano a un’attività istologica epatica più grave e a un tasso più elevato di mutazioni BCP T1762/A1764. Le mutazioni BCP T1762/A1764 sono fortemente associate ad attività istologiche epatiche gravi e al cancro del fegato.29,30 A nostra conoscenza, esiste un forte legame tra il genotipo C e la presenza di mutazioni BCP T1762/ A1764.30 In questo studio, il genotipo C sembrava non avere alcun ruolo nel livello di espressione di HBsAg. Al contrario, le mutazioni BCP T1762/A1764 hanno mostrato una forte correlazione con l’espressione dell’HBsAg. Per quanto riguarda la mutazione virale, le mutazioni BCP T1762/A1764 possono fornire le basi per altre mutazioni dell’HBV tra cui la delezione pre-S e i mutanti complessi che si incontrano frequentemente in presenza di mutazioni BCP T1762/ A1764. I mutanti HBV complessi hanno mostrato difetti parziali o completi nell’espressione e, nel nucleo e nella secrezione delle proteine di superficie.31 La ridotta secrezione dell’antigene di superficie dell’epatite B è correlata alla localizzazione aberrante delle proteine di superficie nell’ER e ha portato a un’elevata espressione di HBsAg. Inoltre, la mutazione BCP T1762/A1764 è considerata una conseguenza della fitness virale a causa della pressione di selezione della sorveglianza immunitaria dell’ospite. Allo stesso modo, le mutazioni pre-S2, che si trovano nelle GGH di tipo II, coincidono con gli epitopi delle cellule T e B limitati dall’antigene leucocitario umano.32 Di solito non c’è necrosi cellulare o infiltrazione di linfociti T attorno alle GGH di tipo II, suggerendo che l’HBV con l’emergere della mutazione di delezione pre-S2 è anche un possibile nuovo mutante di fuga.33 Tuttavia, l’accumulo dell’antigene di superficie negli epatociti potrebbe avvenire senza portare nessuna delle note mutazioni virali nei genomi pre-S o S o nei promotori di superficie.31,34 Pertanto, l’espressione dell’HBsAg potrebbe essere una sequenza in associazione con o senza mutazioni virali.
Questo studio aveva diversi potenziali limiti. Le osservazioni di questo studio erano basate su un disegno retrospettivo trasversale, ma non è stato condotto un follow-up longitudinale. Il livello di espressione di HBsAg negli epatociti e la gravità istologica possono variare tra le varie parti del fegato in un singolo paziente; la biopsia epatica di per sé non può rappresentare esattamente nessun tessuto epatico ad eccezione del nucleo della biopsia.
In sintesi, i pazienti che hanno esibito il modello GGH di tipo II o livelli più elevati di espressione intraepatica di HBsAg hanno mostrato la relazione reciproca tra attività istologiche epatiche più gravi e minore capacità di replicazione di HBV. La forte associazione tra l’espressione intraepatica di HBsAg e le mutazioni BCP T1762/A1764 ha indicato che l’espressione di HBsAg potrebbe essere considerata la manifestazione istologica durante l’evoluzione genomica di HBV sotto la pressione immunitaria dell’ospite.
Abbreviazioni
- –
BCP: basal core promoter.
- –
GGH: epatocita di vetro smerigliato.
- –
HBcAg: antigene core dell’epatite B.
- –
HBeAg: antigene e dell’epatite B.
- –
HBsAg: antigene di superficie dell’epatite B.
- –
HBV: virus dell’epatite B.
Conflitti di interesse
T.-T. C. ha ricevuto finanziamenti per la ricerca da Gilead Sciences, Bristol-Myers Squibb Company, Glaxo-SmithKline, Merck Sharp & Dohme (I.A.) Corporation e Pfizer Inc. Non c’è conflitto di interessi per i restanti autori.