A Exelead, ci avviciniamo alla produzione a contratto con esperienza focalizzata sulle formulazioni liposomiali e PEGylated per trattare malattie rare e popolazioni piccole o poco servite. Siamo specializzati nello sviluppo e nella produzione di prodotti farmaceutici parenterali a base di lipidi e il nostro team ha più di 20 anni di esperienza di lavoro con una vasta gamma di clienti preclinici, clinici e commerciali di produzione a contratto.
Che cosa sono i liposomi e come vengono utilizzati nella consegna dei farmaci?
I liposomi sono veicoli di consegna specializzati che servono più ruoli nel migliorare le capacità degli ingredienti farmaceutici attivi (API). In primo luogo, possono schermare un farmaco dal rilevamento da parte del sistema immunitario del corpo, imitando le membrane biologiche e dando al farmaco più tempo per raggiungere la destinazione prevista. In secondo luogo, servono per aiutare a solubilizzare molecole di droga altamente lipofile o modulare la farmacocinetica e la biodistribuzione dell’API, contribuendo così a minimizzare gli effetti collaterali e a migliorare il profilo di sicurezza del prodotto.
I liposomi hanno una struttura vescicolare unica. Queste vescicole sono composte da un bilayer lipidico che si forma nella forma di una sfera cava che racchiude una fase acquosa. Come tale, qualsiasi carico di interesse può essere incapsulato all’interno dei liposomi sia nel compartimento acquoso (se è idrosolubile/idrofilo) o all’interno del bilayer lipidico (se liposolubile/lipofilo).
Alcuni dei lipidi primari usati per fare i liposomi sono fosfolipidi e sfingolipidi. Queste due categorie di lipidi sono uniche in termini di un gruppo di testa che ama l’acqua/idrofilo e un gruppo di coda che odia l’acqua/lipofilo. A causa della loro natura anfifila, queste molecole si auto-assemblano spontaneamente per formare liposomi e altre strutture 3D uniche quando vengono aggiunte a soluzioni acquose. La forma o la morfologia delle strutture 3D dipende da una varietà di fattori diversi – per esempio, la composizione dei lipidi, la temperatura, il pH o la presenza di altri tamponi, sali e zuccheri nell’acqua.

Fonte immagine: Chem Libre Texts
Come interagisce un farmaco con il corpo e diventa disponibile per l’uso quando è formulato come un prodotto farmaceutico liposomiale?
Negli ultimi anni, i liposomi hanno attirato un’attenzione significativa come una classe affidabile di veicoli di consegna dei farmaci. Le loro strutture auto-chiuse possono incapsulare più farmaci contemporaneamente, proteggendo il carico racchiuso dall’idrolisi e dalla rottura. Inoltre, le proteine di targeting e i ligandi funzionali di superficie sul guscio esterno del bilayer lipidico possono aggiungere una nuova funzionalità, permettendo l’ingresso mirato dei liposomi nelle cellule, sia tramite anticorpi o ligandi mirati ai recettori. Questi ligandi si attaccano ai recettori cellulari che sono sovraespressi in alcune cellule malate, permettendo l’ingresso del farmaco attraverso la membrana cellulare.
“I liposomi proteggono le molecole di droga caricate dalla degradazione esterna, e la loro somiglianza con le membrane biologiche fornisce opportunità uniche per consegnare molecole di droga nelle cellule o nei compartimenti subcellulari … Inoltre, varie proprietà fisico-chimiche dei liposomi – comprese le loro dimensioni, la carica e i ligandi funzionali di superficie – possono essere alterate, con il risultato di funzionalità che favoriscono specifici compiti di consegna del farmaco. Questi vantaggi hanno reso i liposomi una piattaforma leader per il rilascio di farmaci con una vasta gamma di usi nella clinica.”
– Nanostrutture simili a liposomi per il rilascio di farmaci | Gao W, Hu C-MJ, Fang RH, Zhang L 1
Tipo, i liposomi sono prodotti come iniettabili sterili per la consegna al flusso sanguigno, e il rilascio del farmaco avviene quando gli involucri lipidici si rompono, il che può avvenire in ambienti extracellulari o intracellulari.
Varie strategie sono state impiegate per progettare liposomi convenzionali con capacità di rilascio innescato, migliorando l’efficacia terapeutica inducendo i liposomi a rilasciare l’API incapsulato o “carico” basato su una risposta di stimolo. Questo rilascio è guidato dalla rottura convenzionale dei liposomi, o è guidato da stimoli attivi e spunti ambientali, tra cui l’energia termica, il gradiente di pH e lo stress di taglio.1
Le formulazioni orientate al rilascio in ambienti intracellulari possono includere lipidi sensibili al pH che cambiano la struttura liposomiale o si degradano all’interno di compartimenti acidi, consentendo il rilascio del farmaco incapsulato. In alternativa, componenti termosensibili o fotosensibili sono a volte inclusi per consentire la degradazione e la modulazione della struttura a causa di cambiamenti di temperatura o di reazione alla luce di determinate lunghezze d’onda.
I portatori di farmaci simili a liposomi possono essere di molte varietà diverse, che esibiscono una vasta gamma di proprietà biochimiche e biofisiche. Mentre questo è vantaggioso e permette a queste particelle a base di lipidi di assumere applicazioni utili in centinaia di impostazioni diverse, il numero di variazioni potenziali rende imperativo un controllo rigoroso della produzione.2
Exelead produce farmaci a base di lipidi dai primi anni ’90, iniziando con Abelcet. L’amfotericina B, il principio attivo di Abelcet, è contenuta in un complesso lipidico e si fonde selettivamente con le membrane fungine per colpire le cellule della malattia.
Liposomi contro nanoparticelle lipidiche
Liposomi e nanoparticelle lipidiche (LNPs) sono simili per design, ma leggermente diversi per composizione e funzione. Entrambi sono nanoformulazioni lipidiche ed eccellenti veicoli di consegna della droga, trasportando il carico di interesse all’interno di uno strato esterno protettivo di lipidi. In applicazione, tuttavia, gli LNP possono assumere una varietà di forme.
Le LNP sono strutture simili a liposomi particolarmente orientate all’incapsulamento di un’ampia varietà di acidi nucleici (RNA e DNA); e come tali, sono il sistema di consegna genica non virale più popolare. Exelead sviluppa e produce LNPs per incapsulare diversi tipi di payloads genetici tra cui siRNA, mRNA e saRNA.
I liposomi tradizionali includono uno o più anelli di bilayer lipidico che circondano una tasca acquosa, ma non tutti gli LNPs hanno un bilayer contiguo che li qualificherebbe come vescicole lipidiche o liposomi. Alcuni LNP assumono una struttura simile alle micelle, incapsulando le molecole di droga in un nucleo non acquoso.
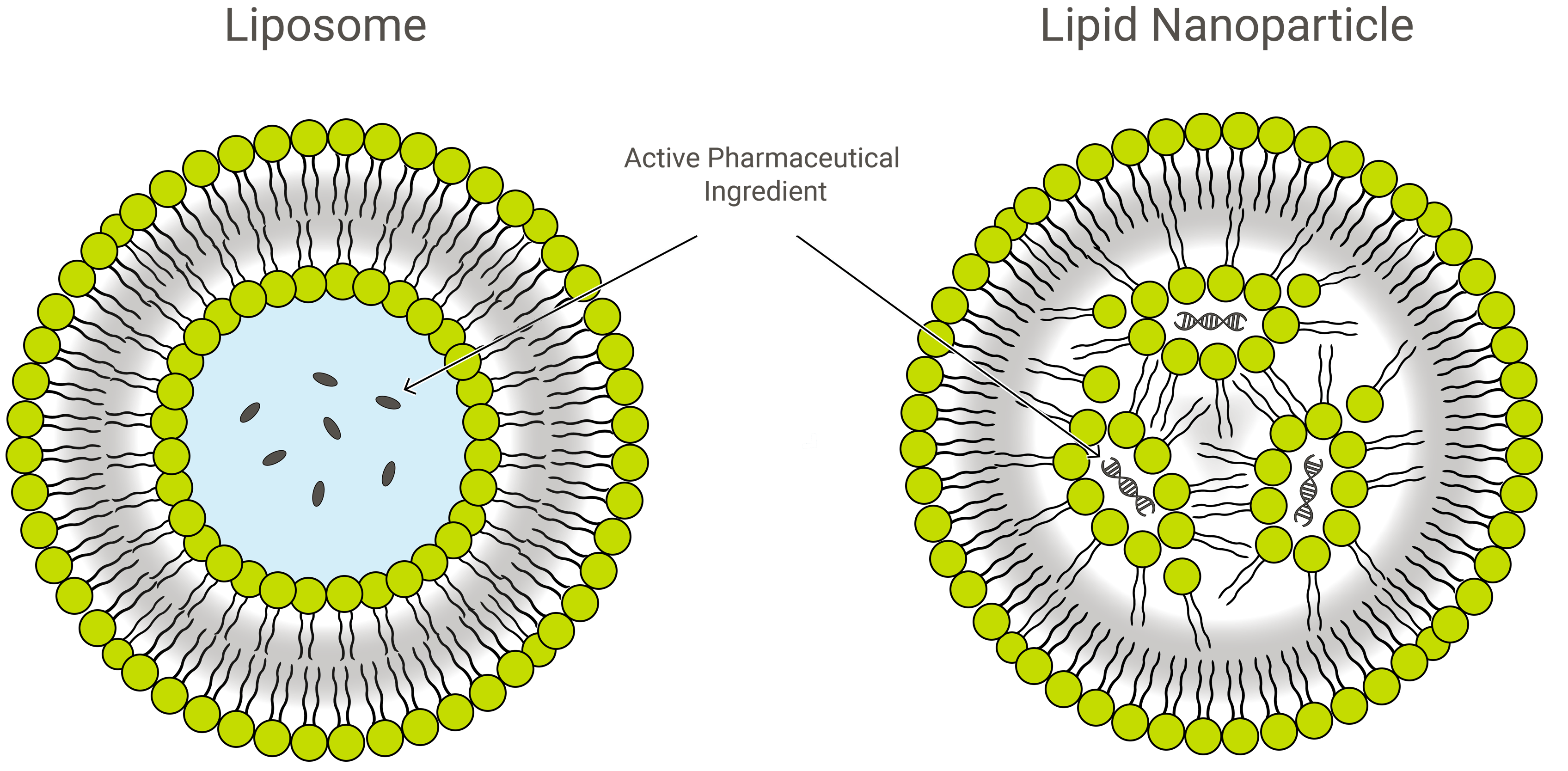
PEGilazione di LNP e strutture di consegna di droga simili ai liposomi
I LNP sono composti principalmente da lipidi cationici (vedi terapia genica sotto) insieme ad altri ingredienti lipidici. Questi includono tipicamente molecole di fosfolipidi neutri appartenenti alla classe della fosfatidilcolina (PC) e steroli, come il colesterolo. Un altro ingrediente lipidico comune è ciò che è noto come un fosfolipide PEGilato – un polimero di glicole polietilenico (PEG) covalentemente attaccato al gruppo di testa di un fosfolipide.

I fosfolipidi PEGilati sono usati in molti trasportatori di farmaci a base lipidica principalmente perché offrono ciò che è noto come un effetto stealth al prodotto farmaceutico mentre circola all’interno del corpo. Il sistema immunitario umano è spinto a proteggere il corpo da qualsiasi oggetto estraneo, e le nanoparticelle medicinali non fanno eccezione. Per aiutare l’efficienza della consegna e per permettere alle molecole di carico di raggiungere i siti di malattia previsti, il PEG viene aggiunto per proteggere queste nanoparticelle impedendo alle proteine del plasma sanguigno di assorbire la superficie del liposoma, aumentando la durata della circolazione sanguigna.1
Il secondo vantaggio della PEGilazione è un aumento della stabilità delle nanostrutture simili ai liposomi. I liposomi convenzionali, in particolare quelli più piccoli di 200 nm, possono essere instabili da soli e tendono a fondersi tra loro per ridurre la tensione superficiale. Questo può comportare la perdita del farmaco incapsulato o la miscelazione sfavorevole del carico di diverse vescicole. Un modo in cui i produttori di farmaci hanno imparato a superare questo problema è quello di coprire l’esterno dei liposomi con polimeri come il PEG.
Queste nanoparticelle equipaggiate in modo furtivo hanno portato a una nuova generazione di formulazioni liposomiche e a più prodotti approvati clinicamente. I liposomi PEGilati e gli LNP sono attualmente il nuovo paradigma per la maggior parte delle terapie contro il cancro.
LNPs nella terapia genica
Per molto tempo, il modo più efficace per consegnare alle cellule umane terapie basate sui geni è stato quello di usare un virus che era stato modificato per portare un carico medicinale piuttosto che geni dannosi e auto-replicanti. Questo metodo è usato ancora oggi occasionalmente e viene definito consegna genica virale. La consegna genica non virale, tuttavia, è diventata popolare negli ultimi 20 anni grazie a profili di sicurezza migliorati, tassi più bassi di reazioni immunogeniche avverse e facilità di produzione. Uno dei principali motori di questo movimento è stato lo sviluppo di vettori basati su lipidi e polimeri, di cui gli LNP sono i più popolari.
Le LNP usate per consegnare i geni sono principalmente sintetizzate usando lipidi cationici, o a carica positiva, che si associano ad acidi nucleici anionici, o a carica negativa. Altri componenti a base di lipidi possono anche essere aggiunti per modulare l’efficienza di consegna e il rilascio di posizione del carico genetico. Le LNP forniscono anche stabilità meccanica, morfologia controllata e distribuzione delle dimensioni ristretta.1
Materiali inorganici, materiali organici e idrogeli sono stati esplorati come nuclei per nanoparticelle liposomali, incapsulati all’interno di un numero variabile di strati lipidici che formano il guscio. Una delle varianti di maggior successo di queste nanoparticelle ibride incorpora polimeri PLA o PGLA all’interno di un monostrato lipidico. Questi due biopolimeri di base sono particolarmente utili nel drug delivery perché facilitano il rilascio controllato del farmaco.1

La formulazione delle nanoparticelle mostrata sopra è un ibrido lipide-polimero con un nucleo idrofobico PGLA e un guscio idrofilo lipide-PEG.
Un campo in espansione
“I liposomi hanno fatto molta strada per diventare una classe di portatori di farmaci convalidati … Una crescente varietà di nanostrutture simili ai liposomi sono in fase di sviluppo, ognuna con punti di forza unici adatti a specifici compiti di consegna dei farmaci. Nel frattempo, la comprensione delle interazioni tra queste nanostrutture e i sistemi biologici sta progredendo rapidamente. È stata ottenuta una quantità sostanziale di informazioni sul loro tempo di circolazione, l’accumulo nei tessuti e la potenziale tossicità. È certo che i nanocarrier simili ai liposomi giocheranno un ruolo più grande per la consegna dei farmaci nel prossimo futuro.”
– Nanostrutture simili ai liposomi per la consegna dei farmaci | Gao W, Hu C-MJ, Fang RH, Zhang L 1
Mentre c’è un lavoro significativo in corso nello sviluppo di rilascio controllato, agenti medicinali nano-compartimentati, liposomi e LNPs sono opzioni particolarmente promettenti. Queste strutture forniscono una morfologia unica, naturalmente stabile, simile a quella delle cellule per i nanomedicinali e sono pronti a progredire verso strategie terapeutiche più avanzate. Exelead sta affrontando tali sfide, compreso lo sviluppo di nanogel che incorporano una serie di biologici e piccole molecole.
Da quando i liposomi sono stati proposti per la prima volta come sistema di consegna dei farmaci alla fine degli anni ’60, sono emerse variazioni di struttura e funzionalità, fornendo preziosi progressi in termini di targeting delle malattie. I farmaci LNP sono spuntati in tutta l’industria farmaceutica come terapie progettate per fornire agenti anticancro, antibiotici, farmaci genici, anestetici e farmaci antinfiammatori.3
“Nelle applicazioni cliniche, i farmaci liposomiali si sono dimostrati più utili per la loro capacità di accumularsi ‘passivamente’ nei siti di maggiore permeabilità vascolare, quando il loro diametro medio è nella gamma ultrafiltrabile (<200 nm di diametro), e per la loro capacità di ridurre gli effetti collaterali dei farmaci incapsulati rispetto ai farmaci liberi. Questo ha portato a un aumento complessivo dell’indice terapeutico, che misura l’efficacia rispetto alla tossicità.”
– Sistemi di consegna dei farmaci liposomiali: dal concetto alle applicazioni cliniche | Allen TM, Cullis PR 3
Applicazioni nella medicina personalizzata – una nuova era nelle strategie terapeutiche
In contrasto con i tradizionali approcci di big-pharma al trattamento delle malattie, la medicina personalizzata prende in considerazione le differenze individuali nello stile di vita, nell’ambiente e nella biologia – inclusa la genetica del paziente.
Questo è estremamente applicabile per malattie come il cancro. Anche all’interno di un singolo tipo di cancro, i tipi di tumore differiscono da un paziente all’altro, e la comprensione della particolare mutazione genetica che un paziente ha sviluppato permette ai medici di impiegare trattamenti più specifici e precisi.4
Con l’avvento delle terapie genetiche personalizzate, medici e scienziati possono effettivamente adattare un ingrediente farmaceutico attivo – spesso RNA o DNA – al profilo specifico della malattia di un particolare paziente o piccolo gruppo di pazienti. Questo approccio al targeting iper-specifico della malattia aumenta l’efficacia e diminuisce gli effetti collaterali indesiderati per gruppi di pazienti simili.
LNPs come veicoli di consegna per oligonucleotidi
Perché gran parte del crescente campo della medicina personalizzata è focalizzato sulle terapie genetiche, le LNPs sono diventate particolarmente utili come piattaforma di consegna dei farmaci. Qualsiasi oligonucleotide potrebbe teoricamente essere incapsulato in un liposoma o LNP, ma i siRNA sono attualmente il carico più comune in questi tipi di prodotti farmaceutici.
In teoria, i segmenti di siRNA possono essere progettati per silenziare qualsiasi gene, che è un concetto eccitante sia per i medici che per i ricercatori. Sfortunatamente, la consegna di RNA libero e non incapsulato nelle cellule umane è difficile, poiché sono grandi, instabili nel siero e inclini alla degradazione da parte delle nucleasi.5
Mentre i ricercatori hanno fatto tentativi per stabilizzare il siRNA nel siero aggiungendo legami fosforotioati, sono necessarie dosi elevate per silenziare efficacemente i geni negli esseri umani. Gli LNP hanno fornito una soluzione a questo problema fornendo mezzi flessibili e facili di incapsulamento, proteggendo i segmenti di siRNA fino a raggiungere la destinazione prevista e facilitando la loro consegna nelle cellule bersaglio.5
“Gli LNP contenenti lipidi cationici ionizzabili hanno una serie di caratteristiche necessarie per la consegna sistemica di acidi polinucleici, tra cui piccole dimensioni, stabilità nel siero, bassi potenziali zeta di superficie a pH fisiologico e carica cationica a valori di pH acidi (ad esempio, negli endosomi). Inoltre, approfittando dei processi di targeting “endogeni” dovuti all’associazione con ApoE dopo la somministrazione, l’assorbimento altamente efficiente negli epatociti può essere raggiunto dopo la somministrazione i.v., portando a eccellenti capacità di silenziamento genico.”
– Sistemi di consegna di nanoparticelle lipidiche per terapie basate su siRNA | Wan C, Allen TM, Cullis PR 5
Minori lotti
I prodotti farmaceutici personalizzati sono spesso prodotti in piccoli lotti per singoli pazienti o piccole popolazioni e possono spesso risultare in meno di un litro di prodotto. Al contrario, i lotti di produzione tradizionali per i farmaci tradizionali spesso producono migliaia di litri di prodotto farmaceutico su scala. La medicina personalizzata richiede un approccio unico, e ogni lotto deve essere prodotto in condizioni cGMP rigorose.
Come la medicina personalizzata è diventata un obiettivo importante nello sviluppo dei farmaci, molte aziende dell’industria di produzione farmaceutica hanno adattato le loro pipeline per ospitare piccoli lotti destinati a piccoli gruppi di pazienti, oltre alla tradizionale produzione di farmaci su larga scala.
A Exelead, sono stati fatti grandi sforzi per accogliere questi piccoli lotti terapeutici, che spesso richiedono API costosi e tempi rapidi. I farmaci specifici per il paziente o per l’antigene non lasciano molto tempo dal momento in cui l’oligonucleotide viene sequenziato al momento in cui il prodotto deve essere formulato nel nostro sito. Queste previsioni a breve termine, a volte solo sei settimane, presentano sfide che siamo stati in grado di superare raffinando i nostri sistemi esistenti e incorporando tecniche di formulazione innovative.
Applicazioni diffuse
Mentre la medicina personalizzata ha il potenziale per trattare quasi tutte le malattie, la ricerca attuale si è concentrata principalmente su 1) immunoterapie, 2) terapie convenzionali aumentate attraverso la farmacogenomica e 3) trattamenti del cancro legati ai biomarcatori. I liposomi e gli LNP hanno un’applicazione come veicoli di consegna per ciascuna di queste categorie di prodotti farmaceutici, rendendoli una risorsa indispensabile in questo nuovo campo dello sviluppo farmaceutico.

Articoli di riferimento
- Gao W, Hu C-MJ, Fang RH, Zhang L. Liposome-like Nanostructures for Drug Delivery. Journal of materials chemistry B, Materiali per la biologia e la medicina. 2013;1(48):10.1039/C3TB21238F. doi:10.1039/C3TB21238F.
- Kraft JC, Freeling JP, Wang Z, Ho RJY. Tendenze emergenti di ricerca e sviluppo clinico dei liposomi e delle nanoparticelle lipidiche. Giornale di scienze farmaceutiche. 2014;103(1):29-52. doi:10.1002/jps.23773.
- Theresa M. Allen, Pieter R. Cullis. Sistemi di consegna dei farmaci liposomiali: Dal concetto alle applicazioni cliniche. Advanced Drug Delivery Reviews. 2013 Jan;65(1):36-48
- Esposito L. What Does Personalized Medicine Really Mean? Notizie degli Stati Uniti: Health Care. 2018 Jan;
- Wan C, Allen TM, Cullis PR. Sistemi di consegna di nanoparticelle lipidiche per terapie basate su siRNA. Drug Deliv Transl Res. 2014 Feb;4(1):74-83. doi: 10.1007/s13346-013-0161-z.
- Vogenberg FR, Isaacson Barash C, Pursel M. Personalized Medicine: Parte 1: Evoluzione e sviluppo in Theranostics. Farmacia e terapeutica. 2010;35(10):560-576.