Introduzione
L’immunofluorescenza (IF) utilizza anticorpi e rilevamento fluorescente per studiare la localizzazione, l’espressione relativa e gli stati di attivazione delle proteine target in cellule o tessuti fissati. L’IF è ampiamente utilizzato in diversi campi di studio.
L’IF può essere usato per rispondere a domande come:
- Quali cellule o tessuti esprimono la mia proteina target?
- Come cambia l’espressione e/o l’attivazione della mia proteina target in risposta a perturbazioni sperimentali?
- In quale punto della cellula/tessuto è localizzata la proteina bersaglio?
- Qual è la relazione spaziale tra diverse proteine bersaglio nel contesto dell’architettura cellulare o tissutale?
L’immunofluorescenza comprende una serie di tecniche correlate che si sono evolute nel tempo. Tutte queste tecniche sfruttano il riconoscimento specifico di obiettivi biologici da parte di anticorpi e la rilevazione di reporter fluorescenti nell’analisi citometrica. Garantire il campione biologico è ben conservato mentre gli antigeni bersaglio sono accessibili agli anticorpi è importante, ma può presentare sfide che variano a seconda del campione, il bersaglio e l’anticorpo.
In questa pagina, abbiamo compilato le risorse per aiutarvi a navigare protocolli, rispondere alle domande comuni, e aiutarvi a progettare esperimenti IF successo.
Scegliere la giusta tecnica e protocollo IF
La tecnica/protocollo IF ottimale è influenzata dal tipo di materiale biologico, dalle fasi di lavorazione del campione, dalle proprietà dell’antigene target e dal particolare anticorpo utilizzato.
Le considerazioni includono:
- I materiali di input possono essere linee cellulari in coltura, tessuto congelato o tessuto fissato in formalina e incluso in paraffina (FFPE).
- Per le linee cellulari in coltura e le cellule primarie, cercare anticorpi convalidati per immunofluorescenza-immunocitochimica (IF-IC).
- In molti laboratori, “immunoistochimica/IHC” è usato come un termine generico per includere i tessuti inclusi in paraffina o congelati, e può essere usato per includere sia la rilevazione cromogenica che quella fluorescente. Su cellsignal.com, le applicazioni differenziano tra preparazioni di tessuto congelato (IF-F) e paraffinato.
- Per i campioni di tessuto FFPE, gli anticorpi convalidati per l’immunoistochimica (IHC-P) possono anche essere utilizzati con rilevazione fluorescente senza amplificazione se l’antigene target è abbondante, o in IHC multiplexed (mIHC) con amplificazione del segnale.
- Un anticorpo può essere validato per una o più delle applicazioni elencate sopra. Le raccomandazioni del protocollo sono il risultato dei test effettuati dagli scienziati durante il processo di convalida.
- I protocolli specifici del prodotto possono essere trovati sulla pagina web di ogni prodotto. Per gli anticorpi convalidati IF, selezionare “IF” sulla pagina del prodotto per visualizzare i dati di convalida IF e il protocollo. Le informazioni di base (diluizioni/concentrazione di lavoro, applicazioni convalidate, reattività di specie, specie ospite) per ogni anticorpo sono incluse nella scheda tecnica del prodotto.
- I protocolli IF più comunemente usati possono anche essere trovati sulla pagina del protocollo.
- Non hai bisogno o vuoi usare la rilevazione della fluorescenza per i tuoi campioni di tessuto? Un approccio alternativo è la rilevazione cromogenica, trattata nella pagina IHC.
Scegliere gli anticorpi per l’IF: l’importanza della validazione degli anticorpi
I migliori anticorpi danno un segnale forte e specifico con uno sfondo minimo. È importante scegliere anticorpi che sono stati convalidati nell’applicazione che utilizzerai. La validazione degli anticorpi in IF può includere esperimenti di espressione positiva e negativa (usando linee cellulari knockout, modelli genetici, CRISPR o RNAi), manipolazione sperimentale della localizzazione della proteina bersaglio o modifiche post-traslazionali, e ottimizzazione del protocollo.
La performance di un anticorpo varia in base all’applicazione. Un anticorpo che funziona bene in un esperimento di western blot, per esempio, può o non può funzionare in IF. Durante il test di nuovi anticorpi, alcuni mostreranno un legame minore fuori bersaglio; questi non sono mai raccomandati per IF o altre applicazioni non-WB. Inoltre, un anticorpo può funzionare bene su tessuto congelato ma non su tessuto FFPE, o viceversa. La sensibilità e le prestazioni degli anticorpi possono cambiare a seconda di come il campione viene fissato e trattato e delle condizioni di lavoro degli anticorpi.
Una volta deciso quale tipo di campioni biologici utilizzare nel vostro esperimento e come saranno preparati, il modo più semplice per sfogliare gli anticorpi su cellsignal.com è quello di selezionare prima l’applicazione appropriata. Poi, puoi inserire i termini di ricerca o selezionare altri attributi (come la specie ospite, l’area di ricerca e altro) per raffinare ulteriormente la tua ricerca e selezionare un anticorpo che è stato convalidato nell’applicazione di cui hai bisogno.
Progettare esperimenti di controllo per IF
Per essere sicuri del tuo progetto sperimentale e dei risultati, e che il tuo anticorpo stia riportando fedelmente il suo target, gli esperimenti di controllo positivo e negativo possono essere informativi. Per esempio:
- I controlli solo secondari possono dirti se c’è un legame aspecifico dell’anticorpo secondario.
- Confermare la specificità di un anticorpo primario progettando esperimenti Knockout/siRNA o confrontando linee cellulari esprimenti e non esprimenti note.
- Esperimenti a target singolo sono usati nell’impostazione dell’imaging con unmixing spettrale. Questo tipo di esperimento può aiutare a determinare se una mancanza di colorazione è dovuta a ostacolo sterico che si verifica quando 2 antigeni sono in stretta prossimità di un altro.
- Trattare i campioni con fosfatasi per confermare fosfo-specifici anticorpi riconoscono solo il bersaglio fosforilato in IF.
- Se si sospettano problemi con la fissazione o la permeabilizzazione, il controllo con un anticorpo che ha lavorato per il vostro laboratorio in passato può essere utile nella risoluzione dei problemi.
Cell Signaling Technology (CST) scienziati abitualmente eseguire questi tipi di controlli come parte del nostro processo di convalida (vedi un esempio). Può essere utile impostare controlli simili nel tuo sistema di modello sperimentale, in particolare se hai difficoltà a ottenere i risultati che desideri.
Anticorpi primari o secondari e colorazione diretta o indiretta
Gli anticorpi primari forniscono un riconoscimento specifico dell’antigene target. Gli anticorpi secondari si legano agli anticorpi primari in base alla specie in cui sono stati allevati. Gli anticorpi primari che sono stati allevati nel coniglio o nel topo possono essere rilevati con secondari anti-coniglio o anti-topo, rispettivamente.
L’accoppiamento di un anticorpo primario e di un anticorpo secondario (specifico per la specie ospite del primario) che è coniugato con un fluoroforo è noto come colorazione indiretta. L’uso di anticorpi primari coniugati a fluorofori, senza anticorpi secondari, è noto come colorazione diretta. I metodi di colorazione diretta fanno risparmiare tempo e permettono il multiplexing utilizzando anticorpi allevati nella stessa specie ospite. La colorazione indiretta offre tradizionalmente una maggiore sensibilità grazie all’amplificazione del segnale che si verifica quando più anticorpi secondari si legano ad un singolo anticorpo primario.
Sono disponibili altre variazioni su queste tecniche, come l’utilizzo di anticorpi primari biotinilati con fluorocromo coniugato ad avidina/streptavidina. Frammenti di anticorpi secondari F(ab’)2 coniugati con fluoroforo (senza il dominio Fc) possono aiutare a ridurre lo sfondo. In mIHC, gli anticorpi secondari coniugati con perossidasi di rafano (HRP) sono impiegati per catalizzare la deposizione dei coniugati tiramide-fluoroforo.
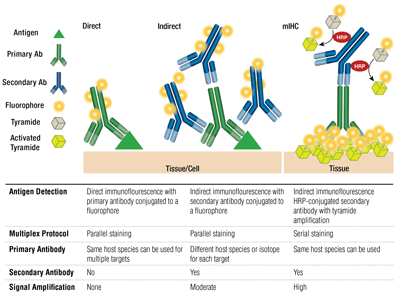
Selezione degli anticorpi fluorofori
Selezione degli anticorpi fluorofori
Quanti target/anticorpi possono essere multiplexati?
Multiplexing impiega la rilevazione di più di 1 target alla volta attraverso anticorpi multipli e la rilevazione di diverse lunghezze d’onda (colori) per ogni target. Per la colorazione indiretta, la capacità di multiplexing si basa sull’accoppiamento di anticorpi secondari specie-specifici coniugati con fluorofori ad ogni anticorpo primario. Anticorpi di topo da isotipi distinti possono anche essere multiplexati utilizzando secondari isotipo-specifici, consentendo la rilevazione di fino a 5 anticorpi di topo in una sola volta. Per la colorazione diretta, ogni anticorpo primario dovrebbe essere accoppiato ad un fluoroforo diverso. Questo permette anticorpi multipli dalla stessa specie / isotipo da combinare e permette anche “mouse-on-mouse” colorazione, dal momento che il legame aspecifico di secondari anti-mouse al tessuto del mouse non è una preoccupazione.
Quando si progettano esperimenti multiplex IF, le caratteristiche spettrali del microscopio a fluorescenza, comprese le fonti di eccitazione disponibili e set di filtraggio, dovrebbe essere preso in considerazione per evitare spettrale bleed-through. I moderni microscopi a fluorescenza epifluorescente e confocale hanno in genere la capacità di distinguere 3 o più canali.
Combinazione della colorazione degli anticorpi con coloranti o tag
I coloranti cellulari che vengono applicati dopo la fissazione o etichette fissabili delle cellule vive possono essere incorporati in un flusso di lavoro IF. L’etichettatura degli organelli è spesso usata per verificare la localizzazione subcellulare di un bersaglio. Espressi tag, come GFP, sono spesso utilizzati per monitorare le cellule trasfettate o in esperimenti di mosaico, se il segnale di fluorescenza GFP è basso, un anticorpo anti-GFP può essere impiegato in IF. L’uso di coloranti o proteine fluorescenti occuperà i canali di fluorescenza, lasciandone meno disponibili per gli anticorpi.
Scegliere i fluorofori per il tuo esperimento
Questo dipenderà dalle caratteristiche spettrali della sorgente di eccitazione e dal filtro di eccitazione/emissione a tua disposizione. Valutate il profilo di eccitazione ed emissione del fluoroforo prima di eseguire il vostro esperimento per evitare il bleed through della fluorescenza. CST offre una varietà di anticorpi primari e secondari coniugati con fluorofori, compresi i coloranti della linea Alexa Fluor®.
Preparazione del campione
Tessuto
Le sezioni di tessuto possono essere preparate sia mediante congelamento rapido in un mezzo a temperatura di taglio ottimale (OCT) sia mediante fissaggio e inclusione in paraffina. I campioni congelati possono essere sezionati utilizzando un criostato e lasciati asciugare all’aria sul vetrino da 10 a 15 minuti prima della fissazione prima della fase successiva. Per i campioni di tessuto FFPE, i requisiti per le fasi di raccolta, fissazione e inclusione in paraffina possono variare a seconda del tipo di tessuto individuale.
Tessuto congelato vs FFPE
In generale, il tessuto FFPE offre una morfologia migliore rispetto al tessuto congelato incorporato in OCT. Questo può rendere più facile quantificare le cellule positive o identificare i confini tra le macchie. Il tessuto FFPE è anche molto stabile; una volta incorporato, i blocchi di tessuto possono essere conservati per anni. Questo tipo di tessuto è anche più facile da spedire da un laboratorio all’altro, ed è il metodo di lavorazione preferito per i campioni di patologia umana.
D’altra parte, il tessuto FFPE subisce diverse fasi di lavorazione extra che riducono la quantità totale di antigene a causa della degradazione delle proteine, richiedono fasi di smascheramento per rilevare l’antigene rimanente, ed esacerbano l’autofluorescenza indotta dall’aldeide. A meno che non si lavori con una proteina molto abbondante, l’antigene rimanente può essere difficile da rilevare tramite IF indiretto e può richiedere un’amplificazione per ottenere una colorazione adeguata. È anche possibile che il recupero dell’antigene possa smascherare antigeni che normalmente non verrebbero rilevati e un anticorpo che altrimenti dà il modello di colorazione previsto può dare una colorazione aspecifica. È altrettanto possibile lavorare con un bersaglio in cui un metodo specifico di recupero dell’antigene è richiesto per rilevare l’epitopo del bersaglio. Pertanto, è importante considerare come un anticorpo è convalidato e quali passi sono necessari per usarlo.
Nel caso del tessuto congelato incorporato in OCT, la riduzione del trattamento è prioritaria rispetto alla morfologia. Questo è il metodo più veloce per ottenere risultati di immunocolorazione, poiché i vetrini sono pronti per l’uso nel momento in cui il tessuto viene tagliato e ci sono meno fasi di lavorazione prima dell’inclusione. C’è meno degradazione delle proteine e più antigene è disponibile per legare l’anticorpo senza richiedere ulteriori e difficili passaggi di recupero. Poiché questo metodo non richiede l’amplificazione, è più sensibile alla qualità del tessuto. Il tipo di fissazione (alcool o aldeide), la durata (alcuni obiettivi come i fattori di trascrizione richiedono un tempo di fissazione più breve) e l’età del tessuto (specialmente dopo il sezionamento) sono tutti importanti e variano a seconda dell’obiettivo. Infine, lavorando con tessuto congelato offre una maggiore flessibilità nella selezione del target, in quanto l’elaborazione può avvenire dopo il sezionamento consentendo una maggiore personalizzazione nella progettazione del test.
Cellule coltivate
Le cellule devono essere seminate su un materiale di supporto compatibile con la microscopia a fluorescenza. I supporti tipici includono piatti di coltura cellulare con fondo di vetro, coprioggetti di vetro (tenuti in piatti di coltura di plastica) preparati con polilsina e/o componenti della matrice extracellulare per supportare la coltura di cellule aderenti, e camere multiwell disponibili in commercio montate su vetrini di vetro che sono compatibili con i microscopi.
Nota che le condizioni della coltura cellulare possono influenzare la salute delle cellule, la morfologia, e l’espressione/localizzazione della tua proteina target e in definitiva dettare la qualità dei tuoi dati IF. Assicurarsi che le cellule sono sani controllando regolarmente i mezzi di coltura per i cambiamenti di pH e ispezionando per segni di stress cellulare (come le cellule multinucleate) a basso ingrandimento su un microscopio. Controllate anche che la confluenza delle cellule sia appropriata per il tipo di cellula e l’obiettivo.
Fissazione del campione
Il fissativo ideale conserva un’istantanea “a vita” mentre ferma rapidamente il processo degradativo di autolisi reticolando e inibendo gli enzimi endogeni, e presenta l’antigene per il riconoscimento da parte dell’anticorpo. Sfortunatamente, non esiste un unico metodo di fissazione che funzioni in modo ideale su ogni campione e per ogni antigene. Anche antigeni diversi sulla stessa proteina bersaglio possono presentare differenze tra i protocolli. Questo è il motivo per cui il miglior protocollo può variare non solo in base al tipo di campione ma anche in base all’epitopo (e all’anticorpo).
Tessuto
Per i tessuti freschi congelati, le sezioni che sono state congelate e criostatate dovrebbero essere trattate con il fissativo. In alternativa, i campioni di tessuto possono essere conservati fissando prima con perfusione transcardiale o immersione, post-fissazione e fasi di crioconservazione, seguite da congelamento e sezionamento.
Nella lavorazione dei tessuti FFPE, il tessuto viene conservato tramite fissazione per immersione con formalina (o altro fissativo a base di aldeidi) o con perfusione come sopra, seguita da inclusione in paraffina e sezionamento. Prima dell’incubazione con l’anticorpo, le sezioni devono essere sottoposte a fasi di deparaffinizzazione, reidratazione e recupero dell’antigene per consentire agli anticorpi di accedere al campione e legare le molecole bersaglio.
Cellule
Risciacquare le cellule con mezzi senza proteine caldi o PBS immediatamente prima della fissazione può prevenire la precipitazione di proteine extracellulari e detriti. La fissazione rapida si ottiene scambiando rapidamente i media con la soluzione fissativa.
Fissazione con aldeide vs fissazione con alcool
I fissativi a base di aldeide come la formaldeide, la formalina (una miscela di formaldeide disciolta con una percentuale inferiore di metanolo), e la glutaraldeide sono più comunemente usati quando la conservazione della struttura è fondamentale. Per la maggior parte degli anticorpi, CST raccomanda la fissazione con formaldeide al 4% (senza metanolo). Le aldeidi reagiscono con le ammine primarie delle proteine cellulari e le reticolano, stabilizzando il campione. Inoltre, gli enzimi cellulari, comprese le fosfatasi e le proteasi, vengono disattivati dalla reticolazione. Le aldeidi attraversano la membrana plasmatica e fissano le proteine solubili meglio degli alcoli, ma alcuni obiettivi possono perdere la loro antigenicità con la reticolazione aldeidica.
I fissativi a base di alcool disidratanti/denaturanti, come il metanolo, spostano l’acqua intorno alle macromolecole cellulari, con conseguente denaturazione e precipitazione in situ. La denaturazione della proteina bersaglio può esporre epitopi sepolti, rendendo questo approccio vantaggioso rispetto alla fissazione aldeide per alcuni anticorpi. Tuttavia, i fissatori disidratanti sono meno adatti per gli obiettivi solubili e gli anticorpi specifici dello stato di modifica come gli anticorpi fosforescenti. Controllare la scheda tecnica del prodotto per il metodo di fissazione ottimale.
Scegliere un agente permeabilizzante
Se viene utilizzato un fissativo di reticolazione, la membrana plasmatica sarà ancora intatta, rendendo obiettivi intracellulari inaccessibili agli anticorpi. Pertanto, la permeabilizzazione dovrebbe essere eseguita dopo la fissazione di reticolazione a meno che i vostri anticorpi riconoscano epitopi extracellulari. Il metodo di permeabilizzazione ottimale varia a seconda dell’anticorpo; controllare sempre la pagina del prodotto per il protocollo consigliato.
L’uso di Triton® X-100 permeabilizzazione dopo la fissazione è comune. Triton e altri detergenti, come NP-40, TWEEN®, Saponin, Digitonin e DOTMAC, interagiscono con le membrane cellulari per creare “pori” di dimensioni variabili e consentire l’accesso dell’anticorpo.
In alternativa, la permabilizzazione con alcool con etanolo o metanolo può essere eseguita dopo la fase di fissazione. Questo metodo combina la fissazione rapida dei fissativi reticolanti con la denaturazione intermedia delle proteine e la delipidizzazione della membrana. Questo può migliorare il segnale per alcuni obiettivi, in particolare quelli associati con organelli o il citoscheletro.
Quali condizioni di fix/perm devo usare quando multiplexing?
Se si sta multiplexing con anticorpi che richiedono diversi protocolli CST, potrebbe essere necessario dare priorità quale anticorpo da utilizzare alle sue condizioni ottimali. Un esempio di ottimizzazione dell’ordine eseguito in mIHC è mostrato in questa nota di applicazione (PDF). Eseguire un test su piccola scala confrontando diversi protocolli può essere informativo prima di scalare i tuoi esperimenti.
Scegliere un reagente bloccante
La raccomandazione più comune è 5% siero di capra normale (o siero della stessa specie come l’anticorpo secondario) in PBS + 0,3% Triton® X-100. Controllare la scheda tecnica per l’agente bloccante raccomandato.
Se i recettori Fc sono presenti nel campione, il segnale dell’anticorpo verrà da una miscela di riconoscimento specifico del bersaglio (attraverso il sito di legame dell’antigene/regione variabile dell’anticorpo) così come l’assorbimento aspecifico della catena pesante dell’anticorpo che si lega ai recettori Fc. Le IgG totali presenti nel siero animale bloccano i recettori Fc per impedire il legame degli anticorpi primari e secondari e ridurre il rumore di fondo. Scegliendo fluoroforo coniugato frammenti F(ab’)2 eviterà anche il legame del recettore Fc per l’anticorpo secondario (ma non l’anticorpo primario)
In altre applicazioni basate su anticorpi, come il bloccaggio occidentale, bloccando passi ridurre il segnale di fondo causato da non specifico, minore affinità legame di anticorpi primari e secondari a siti diversi dal loro obiettivo previsto. Tuttavia, abbiamo trovato che gli anticorpi monoclonali di coniglio ricombinante che sono stati rigorosamente testati in IF eseguire bene su molti campioni con o senza blocco. In definitiva, la scelta di anticorpi di qualità convalidati in immunofluorescenza aiuta molto ad evitare il rumore di fondo.
Concentrazione anticorpale e rapporto segnale-rumore in IF
Il rapporto segnale-rumore (S/N) è legato alla specificità e alla sensibilità di un anticorpo in una particolare applicazione. S/N può essere calcolato confrontando il “segnale” delle intensità di fluorescenza nelle cellule che esprimono il bersaglio di interesse con il “rumore di fondo” delle cellule che mancano di espressione. Se l’anticorpo viene applicato a una concentrazione troppo bassa, il segnale di fluorescenza sarà troppo debole per distinguerlo dal rumore di fondo. D’altra parte, una concentrazione eccessivamente alta contribuirà alla colorazione di fondo, diminuendo il S/N. Controllare sempre la scheda tecnica del prodotto per la diluizione raccomandata, che si basa sulle titolazioni effettuate durante la validazione dell’anticorpo.
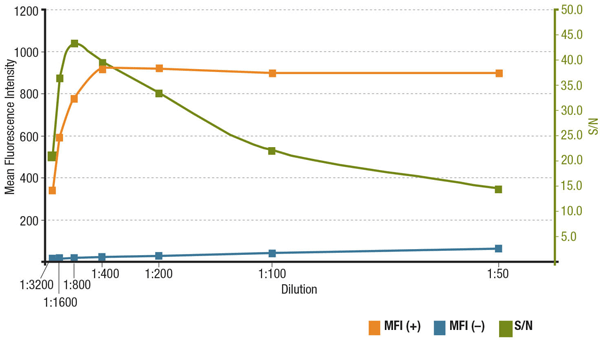
Analisi di S/N per MUC1 (D9O8K) XP® Rabbit mAb #14161 diluizione. Quantificazione dell’intensità di fluorescenza media nelle cellule ZR-75-1 esprimenti (MFI(+), arancione) e nelle cellule HCT 116 non esprimenti (MFI(-), blu), e S/N calcolato (verde).
Analisi di S/N per MUC1 (D9O8K) XP® Rabbit mAb #14161 diluizione. Quantificazione dell’intensità di fluorescenza media nelle cellule ZR-75-1 esprimenti (MFI(+), arancione) e nelle cellule HCT 116 non esprimenti (MFI(-), blu), e S/N calcolato (verde).
Tempo di incubazione dell’anticorpo
In generale, le incubazioni notturne a 4°C danno un segnale forte. Cambiare il tempo di incubazione e la temperatura può cambiare il segnale e il rapporto S/N. Anticorpi diversi possono rispondere alle condizioni di incubazione modificate in modo diverso; per saperne di più, vedere questo post del blog.
Ho bisogno di accedere a un microscopio confocale per eseguire l’IF?
L’IF può essere eseguita su qualsiasi microscopio a fluorescenza con sorgente di eccitazione e filtro appropriati, compresi i microscopi confocali epifluorescenti, a scansione e a disco rotante. L’immunofluorescenza è anche generalmente compatibile con tecniche di fluorescenza specializzate, compresa la fluorescenza a riflessione interna totale (TIRF), la microscopia a fogli di luce e alcune tecniche di super-risoluzione.
Compatibilità con lo screening automatizzato ad alta produttività/analisi ad alto contenuto
Qualunque anticorpo approvato per IF-IC può essere usato nello screening ad alta produttività (HCS) e nell’analisi ad alto contenuto (HCA). Questi esperimenti sono basati su tecniche IF standard, incorporando l’automazione.
Incontrare problemi con il tuo esperimento IF? Clicca qui per una guida alla risoluzione dei problemi.
Cell Signaling Technology, CST e XP sono marchi di Cell Signaling Technology, Inc. Tutti gli altri marchi sono di proprietà dei rispettivi titolari.
Cell Signaling Technology, CST e XP sono marchi di Cell Signaling Technology, Inc.