Tipi di amianto, proprietà e usi
L’amianto si divide in 2 grandi sottogruppi: anfiboli e serpentini, ognuno con le sue caratteristiche fisiche e chimiche distinte. Le fibre di serpentino sono caratterizzate dalla loro forma curva al microscopio elettronico, e il crisotilo o amianto bianco è l’unico membro di questo sottogruppo. Le altre forme sono gli anfiboli, che sono composti da fibre dritte e rigide di lunghezza variabile, generalmente meno di 5μm.1
L’amianto è caratterizzato dalla sua resistenza alle alte temperature e agli agenti chimici, e dalla sua alta resistenza alla trazione. È utilizzato in più di 3000 applicazioni diverse in numerosi settori industriali, e anche in altri prodotti ampiamente distribuiti come giocattoli, tostapane, asciugatrici, articoli per fumatori, ecc. L’amianto si presenta in diverse forme: a) riempimento sciolto, b) fogli o lastre, c) intrecciato in filo o tessuto in tessuto, d) fibrocemento, ed e) come componente della malta. Queste forme così diverse rendono spesso difficile identificare l’amianto come materiale usato dai lavoratori quando si registra la loro storia lavorativa. Nel 2002 è entrata in vigore la direttiva comunitaria 1999/77, che vieta l’uso di tutti i tipi di amianto nell’Unione Europea.2 Oggi, l’esposizione professionale all’amianto continua ad essere un rischio per i lavoratori coinvolti nella demolizione, manutenzione, riparazione e trasporto di strutture in cui l’amianto era precedentemente utilizzato. In Spagna, il Decreto Reale (RD) 396/20063 stabilisce tutte le disposizioni necessarie per la cura della salute di questi lavoratori.
Le malattie maligne e non maligne legate all’amianto e la loro patogenesi (in queste raccomandazioni useremo il termine benigno invece di non maligno) sono elencate nel materiale supplementare, disponibile online.
Test diagnostici per valutare la malattia legata all’amiantoAnamnesi lavorativa
È necessario raccogliere un’anamnesi lavorativa completa (raccomandazione coerente, alta qualità delle prove). Il paziente deve essere interrogato sul suo impiego, sulla categoria professionale, sul grado di protezione, sul grado di esposizione e sui controlli medici aziendali durante la sua vita lavorativa.
In caso di esposizione nota all’amianto, si raccoglieranno anche i seguenti dati:
- –
anno di prima esposizione, durata e fine dell’esposizione
- –
Tipo di esposizione: professionale, da lavoro diretto con amianto; domestica, da isolamento di edifici o altri contaminanti o da lavaggio di abiti da lavoro; ambientale, da uso di amianto in spazi pubblici, demolizione di edifici o vicinanza a fabbriche inquinanti.
- –
Intensità. Si considera esposizione intensa il contatto diretto per più di 6 mesi (8h al giorno, 40h alla settimana) o un’alta concentrazione di fibre d’amianto nell’aria respirata (ordinanza ministeriale 31 ottobre 1984. Bollettino di Stato (BOE) 7 novembre 1984). Il rischio di esposizione copre un’area entro un raggio di 300-2200m dalla fonte a seconda della direzione del vento, e l’esposizione professionale è generalmente significativa dopo 6 mesi di lavoro4 (raccomandazione coerente, qualità delle prove molto bassa).
- –
Tipo di amianto utilizzato. A seconda della professione.
- –
Indice di fumo concomitante.
Test di imagingRadiografia toracica standard e tomografia computerizzata
La radiografia del torace (Rx) è lo strumento base per identificare le malattie legate all’amianto (raccomandazione coerente, qualità moderata delle prove).
La classificazione Rx del torace dell’International Labor Office (ILO) è utile per descrivere e registrare sistematicamente le anomalie radiografiche del torace osservate non solo nell’asbestosi, ma in qualsiasi tipo di pneumoconiosi. L’ultima edizione rivede anche i criteri di classificazione dell’ispessimento pleurico.5 Questi criteri, quindi, sono utili per descrivere le anomalie radiologiche, anche se non sono un prerequisito per la diagnosi.
La tomografia computerizzata (TC) è uno strumento diagnostico più sensibile (Tabella 1).
Caratteristiche radiologiche delle malattie pleuropolmonari legate all’amianto.
| Asbestosi | Opacità reticolari irregolari prevalentemente nelle basi. Bande parenchimali. Schema a nido d’ape |
|---|---|
| Placche pleuriche | Lunghe lesioni dense o lineari nella pleura diaframmatica, rispetto ai seni e ai vertici frenico-costali. Più comunemente bilaterale. Può essere calcificato |
| Inspessimento pleurico diffuso | Aumento della pleura che si estende ad almeno un quarto della parete toracica. Più comunemente unilaterale, colpisce la pleura posteriore nelle basi. Può essere calcificata. Può essere associato a bande parenchimali e atelettasie arrotondate |
| Feffusione pleurica benigna | Unilaterale, prevalentemente sul lato sinistro, da piccola a moderata quantità. Indistinguibile da altre cause di versamento da un punto di vista radiologico |
| Atelettasia arrotondata | Opacità arrotondata della base pleurica con incurvamento dei vasi sanguigni e dei bronchi adiacenti (segno della coda di cometa). Unilaterale, prevalentemente nei lobi inferiori |
| Mesotelioma pleurico | Inspessimento nodulare diffuso della pleura mediastinica associato a versamento pleurico e perdita di volume nell’emitorace colpito emitorace |
| Cancro del polmone | Indistinguibile dagli altri casi |
Tomografia ad emissione di positroni (PET) e PET combinata con CT (PET-CT)
Bénard6 ha dimostrato l’utilità di questa tecnica per distinguere le lesioni pleuriche benigne dal mesotelioma pleurico, grazie alla sua alta sensibilità, specificità e accuratezza diagnostica, oltre al suo alto valore predittivo positivo e, in particolare, il suo alto valore predittivo negativo (92%; 75%; 89%; 94.3% e 92%, rispettivamente). Studi successivi hanno confermato questi risultati.7 Anche la doppia PET è utile nel processo diagnostico (l’indice SUV aumenta nella fase tardiva rispetto alla fase iniziale nei mesoteliomi, e diminuisce nelle lesioni benigne). Valori simili si ottengono con la PET-CT. Il valore SUV varia tra i diversi studi. Se c’è un elevato sospetto clinico di mesotelioma, o se la PET o la PET-CT sono positive, la diagnosi deve essere confermata con uno studio patologico di una biopsia del tessuto pleurico ottenuta preferibilmente per via chirurgica (raccomandazione coerente, alta qualità delle prove).
La PET-CT è anche una tecnica di imaging utile nella stadiazione del mesotelioma e nello studio delle lesioni del parenchima polmonare, poiché, a differenza del cancro del polmone, non vi è assorbimento del radiotracciante nelle atelettasie arrotondate. Un risultato positivo ha bisogno di una conferma istologica.8
Risonanza magnetica e altre tecniche di imaging
Il ruolo della risonanza magnetica (MRI) nelle malattie correlate all’amianto è molto limitato.
Può essere utile per distinguere i tumori maligni della pleura dalle lesioni benigne, sulla base dei cambiamenti morfologici e dell’intensità del segnale.9 Nell’atelettasia arrotondata, la RM mostra la pleura viscerale che si ripiega nella lesione (raccomandazione coerente, qualità moderata delle prove).
Definisce anche più chiaramente il grasso extrapleurico ed è più accurata nello stabilire l’invasione della parete toracica e del diaframma nella stadiazione del mesotelioma, sebbene non sia utile per rilevare l’invasione sottodiaframmatica.10
L’ecografia pleurica è utile nello studio del versamento pleurico e delle masse periferiche come strumento di imaging per guidare procedure come la toracocentesi, la biopsia pleurica, ecc. Non sono disponibili studi a sostegno del suo uso in altre malattie correlate all’amianto (raccomandazione coerente, alta qualità delle prove).
Test di funzionalità polmonare
I test di funzionalità polmonare sono obbligatori nella diagnosi e nel follow-up delle malattie correlate all’amianto. Quando è utilizzato nel contesto della sorveglianza sanitaria, contribuisce alla diagnosi precoce degli individui esposti, ed è indispensabile per valutare la capacità lavorativa di un paziente (raccomandazione coerente, alta qualità delle prove).
La spirometria è la procedura iniziale; il volume espiratorio forzato in 1 secondo (FEV1), la capacità vitale forzata (FVC), e FEV1/FVC possono essere utilizzati per rilevare e quantificare i difetti ventilatori ostruttivi, e avvisare di un difetto restrittivo. La misurazione dei volumi polmonari è obbligatoria per diagnosticare un difetto ventilatorio restrittivo. La misurazione della capacità di diffusione (DLCO) è un test sensibile, ma manca di specificità nel rilevamento della malattia polmonare interstiziale e ha un maggiore coefficiente di variazione rispetto alla spirometria.11 Nell’asbestosi, il cambiamento funzionale caratteristico è un modello ventilatorio restrittivo (ridotta capacità polmonare totale), e la DLCO è solitamente ridotta, entrambi come risultato della fibrosi del parenchima polmonare. Una ridotta capacità di diffusione è uno dei test più sensibili per l’asbestosi allo stadio iniziale, anche se la specificità è bassa. L’ispessimento diffuso della pleura viscerale senza coinvolgimento interstiziale può anche causare un difetto ventilatorio restrittivo.12 Dopo molte discussioni, le placche pleuriche non sono state considerate responsabili delle alterazioni della funzione polmonare che, quando si verificano, sono dovute ad altre cause concomitanti, come la comparsa di un coinvolgimento interstiziale o il fumo.13
Analisi mineralogica
L’amianto può essere rilevato in campioni respiratori alla microscopia ottica, sotto forma di corpi di amianto (AB), noti anche come corpi ferruginosi, formati dopo che le fibre sono rivestite di materiale proteico all’interno dei macrofagi. L’osservazione degli AB in campioni patologici standard utilizzando la colorazione istologica di routine (ematossilina-eosina) è molto specifica, ma la sensibilità è molto bassa. Per questo motivo, è necessario un trattamento specifico dei campioni per la valutazione del contenuto polmonare di amianto attraverso la conta degli AB nel tessuto polmonare o nel lavaggio broncoalveolare14 (raccomandazione coerente, alta qualità delle prove). Sono richiesti campioni di tessuto polmonare del peso di almeno 0,5 g, che vengono digeriti in ipoclorito di sodio, filtrati e lavati. La quantificazione dell’AB viene eseguita utilizzando un microscopio ottico 400×. La dimensione dei campioni richiesti significa che di solito sono ottenuti da lobectomie, pneumonectomie o campioni autoptici. Valori nella biopsia polmonare o nel lavaggio broncoalveolare di più di 1000AB/g di tessuto polmonare secco o di 1 AB per millilitro di lavaggio broncoalveolare sono indicativi di esposizione. Un microscopio elettronico è necessario per rilevare le fibre di amianto. Se l’obiettivo è quello di identificare la composizione chimica della fibra per determinarne il tipo, sono disponibili vari metodi di analisi del campione, compresa la spettroscopia a raggi X a dispersione di energia. Per queste procedure sono necessari un laboratorio ben attrezzato e personale addestrato, e ogni laboratorio deve stabilire valori di riferimento in base alla popolazione locale. Il primo passo richiesto per la convalida del laboratorio in questa tecnica è la standardizzazione, poiché sono state trovate notevoli differenze tra i gruppi in diversi paesi. In Spagna, sono stati recentemente pubblicati i valori di riferimento per l’AB polmonare nella popolazione non esposta.15 In base ai valori ottenuti, è stato confermato che la soglia internazionale di 1000 AB è appropriata nel nostro ambiente per classificare i valori potenzialmente causa di malattia.
Biomarcatori
Sono stati studiati diversi marcatori del sangue e del liquido pleurico del mesotelioma pleurico maligno, come l’acido ialuronico, l’antigene carcinoembrionale o il CA 125, ma nessuno ha dimostrato di essere utile. L’osteopontina è prodotta dal mesotelioma pleurico maligno, e i livelli nel siero sono direttamente associati agli anni di esposizione e all’intensità delle lesioni. La mancanza di specificità limita l’utilità diagnostica di questo marcatore.
Lo svantaggio della mesotelina solubile è che non è espressa nel sottotipo sarcomatoso. I livelli nel siero e nel liquido pleurico sono strettamente correlati. Una recente metanalisi che studia l’efficacia della mesotelina solubile nella diagnosi del mesotelioma pleurico maligno ha concluso che per un punto di cutoff di 2ng/ml nel plasma, l’area sotto la curva è 0,77 (95% CI: 0,73-0,81) con una specificità del 95%, ma una sensibilità molto bassa del 32%.16 Data l’elevata specificità di questo marcatore, i valori positivi nelle popolazioni a rischio richiedono che il paziente sia esaminato più a fondo. Tuttavia, la sua bassa specificità significa che un risultato negativo non esclude la diagnosi. Pertanto, la determinazione sistematica della mesotelina solubile nella popolazione esposta non è raccomandata come metodo di diagnosi precoce (raccomandazione coerente, alta qualità delle prove).
Fibulina-3, un nuovo biomarcatore descritto nelle cellule di glioma, è coinvolto nell’invasione e nella crescita del tumore. Gli studi nel mesotelioma pleurico maligno hanno dimostrato che i livelli di fibulina-3 nel plasma hanno una sensibilità del 96% e una specificità del 95%, e quando si trova nel liquido pleurico, la sensibilità è dell’84% e la specificità del 93%. A differenza della mesotelina solubile, non esiste una correlazione tra i livelli nel siero e i livelli nel liquido pleurico. I livelli di fibulina-3 nel plasma possono aiutare a distinguere gli individui esposti all’amianto dai pazienti con mesotelioma pleurico maligno, e in quest’ultimo gruppo, i livelli sono associati alla prognosi. Tuttavia, la mesotelina solubile ha dimostrato di essere superiore alla fibulina-3 come marcatore diagnostico.17 Nonostante la sua bassa sensibilità, che lo rende meno utile come metodo di screening della popolazione esposta, la mesotelina solubile è ancora il biomarcatore più efficace per la diagnosi di mesotelioma (raccomandazione coerente, bassa qualità delle prove).
Legislazione e protocollo specifico di sorveglianza sanitaria dell’amianto
L’attuale quadro giuridico si basa sul RD 1299/2006 (materiale supplementare, disponibile online, allegato I). La classificazione delle malattie professionali è stata aggiornata in questo decreto, ed è stato fornito un elenco di attività che potrebbero causare malattie professionali. Le malattie legate all’amianto sono elencate nell’allegato II (materiale supplementare, disponibile online), recentemente ampliato per includere il cancro della laringe.18 Sono specificati sei gruppi di malattie professionali. L’esposizione all’amianto compare nel gruppo 4 (malattie non tumorali) e nel gruppo 6 (malattie tumorali).
Inoltre, la legge rende obbligatorio per qualsiasi medico del Sistema Sanitario Nazionale segnalare come sospetta malattia professionale qualsiasi malattia causata dall’esposizione professionale a una di queste sostanze. A questo scopo è disponibile un modulo di dichiarazione standard, che viene valutato dall’ente gestore, generalmente l’Istituto Nazionale di Sicurezza Sociale spagnolo, e accettato o respinto. Questa dichiarazione è importante per il successivo contenzioso e determina il periodo di prescrizione, generalmente 1 anno dopo il rifiuto.
La legge richiede anche che le aziende forniscano informazioni, il che ha portato ogni comunità autonoma a creare elenchi di aziende in cui è stato utilizzato l’amianto.
Da quando è stato emanato questo RD, è apparso solo 1 regolamento associato a questo tema: RD 843/2011, che regola i servizi di prevenzione dei rischi sul posto di lavoro.
In questo quadro, le comunità autonome hanno istituito programmi di prevenzione dei rischi sul posto di lavoro e di assistenza alle persone esposte.
Applicazione del protocollo di sorveglianza sanitaria specifica: Prima visita e intervalli di visita. Raccomandazioni del gruppo EROM
L’articolo 16 del RD 396/2006, del 31 marzo 2006, che stabilisce le disposizioni minime di salute e sicurezza applicabili ai lavori con rischio di esposizione all’amianto, stabilisce che “tenuto conto del lungo periodo di latenza delle manifestazioni patologiche dell’esposizione all’amianto, qualsiasi lavoratore con una storia di esposizione all’amianto che cessi il suo rapporto di lavoro con l’azienda in cui è sorta la situazione di esposizione, sia per pensionamento, sia per cambio di azienda, sia per qualsiasi altro motivo, continuerà a sottoporsi a controlli medici preventivi, mediante esami regolari eseguiti dal Sistema Sanitario Nazionale nei reparti di medicina respiratoria dotati di mezzi adeguati per l’esame della funzione respiratoria, o in altri reparti associati alle malattie legate all’amianto”.
In Spagna, come in altri paesi, esiste un programma di screening e sorveglianza per i lavoratori esposti all’amianto. Si tratta di programmi medicolegali che sono molto importanti per l’identificazione e la diagnosi delle diverse malattie, ma ci sono poche prove scientifiche che questa sia una strategia efficace per migliorare il decorso di queste malattie.
In considerazione di ciò, il gruppo SEPAR EROM raccomanda che gli esami eseguiti nella prima visita e nelle visite successive e gli intervalli di visita siano i seguenti:
1) Prima visita di un paziente che consulta una storia di possibile esposizione all’amianto:
- –
Anamnesi lavorativa: come elencato sopra.
- –
Anamnesi del fumatore: se fumatore attivo, consulenza o trattamento antifumo (raccomandazione coerente, alta qualità delle prove).
- –
Anamnesi medica e anamnesi: al paziente verranno chiesti in particolare i sintomi respiratori (dispnea, tosse ed espettorazione, dolore al petto, emottisi) e l’astenia, l’anoressia e la perdita di peso.
- –
Esame fisico: valutare la presenza di crepitii e di unghie clavate.
- –
Test aggiuntivi:
- –
Rx torace.
- –
Test di funzionalità polmonare completo con spirometria forzata, volumi polmonari e DLCO in un laboratorio attrezzato per test funzionali, seguendo le raccomandazioni SEPAR.
Se la probabilità di esposizione è zero o poco chiara dalla storia lavorativa del paziente (il suo lavoro non compare nella lista delle attività con rischio di esposizione all’amianto http://www.msssi.gob.es/ciudadanos/saludAmbLaboral/docs/ProtoVigiAmianto1.pdf) e i risultati dei test sono normali, il follow-up terminerà a questo punto.
Una HRCT dovrebbe essere eseguita se si osservano cambiamenti nella Rx del torace, se i test di funzionalità polmonare sono anormali, o se si osserva una discrepanza clinica/funzionale (raccomandazioni coerenti, bassa qualità delle prove).
Se è vero che la TC è più sensibile della Rx torace per la diagnosi di placche pleuriche non calcificate, il suo uso per la diagnosi in un paziente con una Rx torace normale, test funzionali normali e nessun sintomo è discutibile e non supportato da prove scientifiche (il rapporto rischio-beneficio dovuto alle radiazioni deve anche essere preso in considerazione).
Un’altra questione è l’uso della TC come strumento di screening per il cancro ai polmoni nelle prime fasi della malattia. A questo proposito, una meta-analisi recentemente pubblicata su Chest19 su oltre 5000 lavoratori in totale ha trovato una prevalenza di cancro ai polmoni negli individui esposti all’amianto dell’1,1%, simile a quella riportata nello studio sullo screening del cancro ai polmoni nei forti fumatori (1%: 95% CI: 0,09-1,1%).20 Per questo motivo, lo studio conclude che lo screening CT nei lavoratori esposti all’amianto può essere efficace per rilevare il cancro ai polmoni asintomatico, allo stadio iniziale, quindi può ridurre la mortalità per cancro ai polmoni in questo gruppo di lavoratori.
Lo screening del cancro ai polmoni tra i lavoratori esposti all’amianto è una questione urgente che richiede un grande studio randomizzato per stabilire raccomandazioni coerenti basate su prove scientifiche di alta qualità.
2) Le visite regolari avranno luogo agli intervalli stabiliti, a seconda dei risultati diagnostici, e a condizione che il paziente sia asintomatico e non mostri cambiamenti nei sintomi (raccomandazione coerente, bassa qualità delle prove):
- –
Nessuna malattia: check-up con spirometria forzata e Rx torace ogni 3 anni.
- –
Malattia pleurica con placche pleuriche: controllo ogni 1-3 anni con Rx torace e spirometria forzata. Se patologico, completare lo studio con test di funzionalità polmonare completo con volumi e DLCO.
- –
Malattia pleurica con ispessimento pleurico diffuso: controllo annuale con Rx torace e studio funzionale completo con volumi e DLCO.
- –
Malattia pleurica da amianto con atelettasia rotonda: se si osservano segni radiologici tipici, monitorare la stabilità nel tempo con tecniche di imaging, preferibilmente CT ogni 6 mesi per 2 anni. Follow-up successivo simile a quello dell’ispessimento pleurico diffuso (raccomandazione coerente, bassa qualità delle prove). In assenza di segni radiologici tipici o se si osservano sintomi, considerare altre tecniche (PET, PET-CT, FNAB guidato dalla CT) per escludere una neoplasia (raccomandazione coerente, alta qualità delle prove).
- –
Asbestosi: controllo annuale con Rx torace e studio funzionale completo. In caso di deterioramento dei test di funzionalità polmonare o di cambiamenti radiologici all’Rx torace, considerare la ripetizione della TC ad alta risoluzione.
- –
Trattamento antifumo se il paziente continua a fumare.
I cambiamenti nei sintomi, nei test di funzionalità polmonare o negli studi radiologici possono richiedere una ripetizione della TC.
Né la determinazione dei biomarcatori né le TAC regolari sono attualmente indicate per la diagnosi precoce del mesotelioma (Fig. 1).
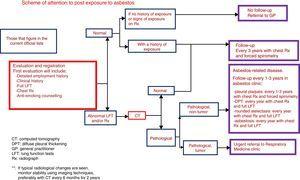
Programma di visita per pazienti precedentemente esposti all’amianto.
Criteri per l’attribuzione di malattie all’amianto
L’attribuzione di una malattia all’amianto ha un significato diagnostico che influenzerà il successivo monitoraggio e può anche avere implicazioni legali ed economiche, poiché il mesotelioma, l’asbestosi, il cancro ai polmoni e la fibrosi pleurica associata alla limitazione ventilatoria sono riconosciuti come malattie professionali. Il fatto che l’amianto possa causare tutta una serie di malattie respiratorie non facilita l’attribuzione in ogni caso specifico. Questo perché i dati epidemiologici e sperimentali disponibili mostrano che l’esposizione deve soddisfare determinati criteri in termini di intensità e durata per essere considerata un fattore causale di una specifica malattia.
Come in altre malattie causate dall’inalazione di sostanze, la diagnosi dei processi causati dall’amianto richiede l’esposizione, un quadro clinico e radiologico coerente e l’esclusione di qualsiasi altra causa ragionevole. Così, la diagnosi di mesotelioma di solito comporta l’attribuzione all’amianto, poiché nessun altro agente che causa chiaramente la malattia è stato identificato, e le malattie benigne della pleura mostrano segni radiologici che possono renderli più facili da riconoscere.
Come regola generale, le caratteristiche dell’esposizione devono essere valutate. È improbabile che l’asbestosi si sviluppi con esposizioni accumulate inferiori a 25 fibre/ml/anno,21 e l’aumento dell’incidenza del cancro ai polmoni si verifica anche dopo esposizioni intense per un periodo superiore a 20 anni. Al contrario, le malattie pleuriche benigne possono comparire dopo 10 anni dalla prima esposizione, e l’esposizione può essere di lieve intensità.
Nella pratica, il paziente di solito non è consapevole della concentrazione di fibre presenti nell’ambiente di lavoro, e può essere difficile per il medico valutare l’intensità dell’esposizione dalle informazioni ottenute dalla storia lavorativa. Infatti, anche con l’uso di un questionario completo, la sensibilità e la specificità per rilevare l’esposizione sono solo del 50% e del 75%, rispettivamente, rispetto al numero di ABs rilevati nel tessuto polmonare (dati personali non pubblicati). In caso di esposizione domestica o ambientale, è più difficile stabilire la relazione causale.
Nei pazienti con una storia nota di esposizione, le malattie associate possono essere attribuite a tale esposizione senza altre considerazioni (raccomandazione coerente, qualità moderata delle prove).
Se, tuttavia, vengono rilevate discrepanze tra il quadro clinico o gli esami di imaging e la nozione di esposizione, è utile avere prove oggettive di esposizione. Il gold standard è il rilevamento dell’amianto nel polmone, determinato da test per AB (i depositi nella pleura sono generalmente scarsi). I valori indicativi di depositi polmonari suscettibili di causare la malattia sono 103AB/g nel polmone secco o più di 106 fibre/g, secondo i dati dell’unico laboratorio in Spagna che ha valori di riferimento.15 Questa tecnica può essere effettuata anche nel lavaggio broncoalveolare, con valori di soglia di 1AB/ml.
La comparsa di nuove fibre che hanno sostituito l’amianto e il loro possibile impatto sulla salute sono esaminati nel materiale supplementare, disponibile online.
Conflitto di interessi
Gli autori dichiarano di non avere conflitti di interessi.