Struttura di Kekulé per il benzene
Il benzene era noto per avere la formula molecolare C6H6, ma la sua formula strutturale era sconosciuta.
Se il benzene fosse un idrocarburo insaturo a catena dritta dovrebbe subire facilmente reazioni di addizione (proprio come altri alcheni e alchini).
Per esempio, il bromo, Br2, dovrebbe aggiungersi attraverso il doppio o triplo legame come mostrato di seguito:
| possibile reazione di addizione a catena dritta: | |||
| CH3-C≡C-C≡C-CH3 | + Br2 | → | CH3-CBr=CBr-C≡C-CH3 |
Ma, quando il bromo viene aggiunto al benzene a 25°C e 1 atm (101.3 kPa), non sembra avvenire alcuna reazione.
Quindi, le possibili strutture per il benzene che coinvolgono doppi e/o tripli legami disposti in una catena sembravano più improbabili in quanto queste dovrebbero subire reazioni di addizione.
Se il bromo viene aggiunto al benzene in presenza di FeBr3, esso subisce una reazione di sostituzione in cui uno degli atomi di idrogeno viene sostituito da un atomo di bromo per produrre un composto con la formula C6H5Br, come mostrato di seguito:
| reazione di sostituzione nota: | ||||||||
| C6H6 | + Br2 | FeBr3 → |
C6H5Br | + HBr | ||||
In questo senso, il benzene si comportava molto più come un idrocarburo saturo (solo legami singoli tra gli atomi di carbonio).
Così, la prima struttura proposta da Kekulé per il benzene nel 1865 non conteneva doppi legami ma disponeva i 6 atomi di carbonio in un anello come mostrato qui sotto:
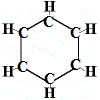
Kekulé si rese conto che questa molecola rompe la regola della tetravalenza del carbonio, cioè, ogni atomo di carbonio forma solo 3 legami invece di 4.
Così, nel 1872 Kekulé propose una struttura del benzene composta da tre legami singoli e doppi alternati come mostrato qui sotto:

Si noti che, sebbene gli atomi di carbonio non siano scritti all’interno della struttura, si intende sempre che un atomo di carbonio esiste dove due linee dell’esagono si uniscono, così che ci sono 6 “giunzioni”, 6 angoli, e quindi 6 atomi di carbonio.
In questa struttura ogni atomo di carbonio è legato ad un atomo di idrogeno e ad altri due atomi di carbonio. Uno dei legami carbonio-carbonio è un legame singolo, l’altro legame carbonio-carbonio è un doppio legame. Ogni atomo di carbonio ha fatto 4 legami.
Mentre questa struttura non spiega perché il benzene non subisce reazioni di addizione, potrebbe spiegare perché il benzene forma solo un isomero strutturale quando il benzene reagisce con il bromo in una reazione di sostituzione come mostrato qui sotto:
 proposta di struttura del benzene |
+ Br2 | → |  solo 1 isomero strutturale |
+ HBr |
Le altre strutture ad anello proposte per il benzene avrebbero previsto più di un isomero strutturale per il prodotto della reazione di sostituzione come mostrato di seguito:
| altre proposte di struttura ad anello della reazione: | 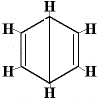 |
Br2 → |
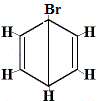 isomero strutturale 1 |
+ | 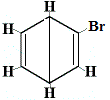 Isomero strutturale 2 |
Cosa accadrebbe se un altro atomo di idrogeno fosse sostituito (sostituito) con un atomo di bromo?
| C6H5Br | + Br2 | FeBr3 → |
C6H4Br2 | + HBr |
Quanti isomeri strutturali di C6H4Br2 verrebbero prodotti?
 |
Br2 → FeBr3 |
 Isomero strutturale 1 |
+ | 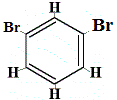 Isomero strutturale 2 |
+ | 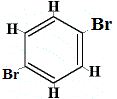 Isomero strutturale 3 |
+ |  Isomero strutturale 4 |
Gli isomeri strutturali 1 e 4 sono diversi perché nell’isomero 1 i due atomi di Br sono legati ad atomi di carbonio su un legame C-C, mentre nell’isomero 4 i due atomi di Br sono legati ad atomi di carbonio su un legame C=C.
Tuttavia, quando il C6H5Br ottenuto dal benzene reagisce con il bromo in una reazione di sostituzione, vengono prodotti solo 3 isomeri strutturali di C6H4Br2!
Per risolvere questo problema, Kekulé ha proposto che l’anello del benzene sia in rapido equilibrio tra strutture in cui i doppi legami sono nelle posizioni alternative come mostrato qui sotto:
 |
⇋ | 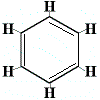 |
Così, quando il bromo reagisce con C6H5Br in una reazione di sostituzione per produrre C6H4Br2, coppie di isomeri strutturali di C6H4Br2 sono in equilibrio tra loro.
Questo significa che gli isomeri strutturali 1 e 4 mostrati sopra, che differiscono solo per il fatto che gli atomi di Br sono legati attraverso un legame singolo o un doppio legame, sono ora in rapido equilibrio l’uno con l’altro come mostrato qui sotto:
| Atomi di Br su atomi di C adiacenti, l’isomero strutturale 1 ha atomi di Br su C-C l’isomero strutturale 4 ha atomi di Br su C=C |
 l’isomero strutturale 1 |
⇋ |  l’isomero strutturale 4 |
Secondo Kekulé, questi due isomeri strutturali di C6H4Br2 sono in equilibrio così rapido che non possono essere separati come due molecole separate, quindi sembra che ci siano solo 3 isomeri invece di 4.
Mentre questa struttura di rapido equilibrio per il benzene, nota come struttura di Kekulé, si è rivelata utile, non spiega la stabilità unica (mancanza di reattività) dell’anello del benzene, non spiega perché il benzene non subisce facilmente reazioni di addizione ma può essere indotto a subire reazioni di addizione.
Lo capisci?
Entra in AUS-e-TUTE!
Fai il test ora!