I tilakoidi contengono molte proteine di membrana integrali e periferiche, così come proteine lumenali. Recenti studi di proteomica delle frazioni dei tilakoidi hanno fornito ulteriori dettagli sulla composizione proteica dei tilakoidi. Questi dati sono stati riassunti in diversi database di proteine del plastidio che sono disponibili online.
Secondo questi studi, il proteoma del tilakoide consiste di almeno 335 proteine diverse. Di queste, 89 si trovano nel lume, 116 sono proteine integrali di membrana, 62 sono proteine periferiche sul lato dello stroma e 68 proteine periferiche sul lato lumenale. Ulteriori proteine lumenali a bassa abbondanza possono essere previste attraverso metodi computazionali. Delle proteine del tilakoide con funzioni note, il 42% è coinvolto nella fotosintesi. I gruppi funzionali successivi più grandi includono le proteine coinvolte nel targeting delle proteine, nell’elaborazione e nel ripiegamento con l’11%, nella risposta allo stress ossidativo (9%) e nella traduzione (8%).
Proteine di membrana integraleModifica
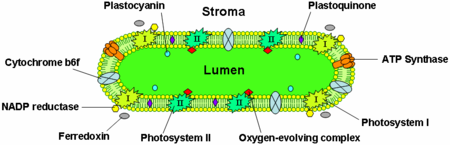
Le membrane tilakoidi contengono proteine di membrana integrale che svolgono un ruolo importante nella raccolta della luce e nelle reazioni luce-dipendenti della fotosintesi. Ci sono quattro principali complessi proteici nella membrana tilakoide:
- Fotosistema I e II
- Complesso del citocromo b6f
- ATP sintasi
Il fotosistema II si trova principalmente nei tilakoidi del grana, mentre il fotosistema I e l’ATP sintasi si trovano principalmente nei tilakoidi dello stroma e negli strati esterni del grana. Il complesso del citocromo b6f è distribuito uniformemente nelle membrane dei tilakoidi. A causa della posizione separata dei due fotosistemi nel sistema di membrane dei tilakoidi, sono necessari dei trasportatori di elettroni mobili per trasferire gli elettroni tra di loro. Questi trasportatori sono il plastochinone e la plastocianina. Il plastochinone trasporta gli elettroni dal fotosistema II al complesso del citocromo b6f, mentre la plastocianina trasporta gli elettroni dal complesso del citocromo b6f al fotosistema I.
Insieme, queste proteine utilizzano l’energia luminosa per guidare le catene di trasporto degli elettroni che generano un potenziale chemiosmotico attraverso la membrana tilaconica e NADPH, un prodotto della reazione redox terminale. L’ATP sintasi utilizza il potenziale chemiosmotico per produrre ATP durante la fotofosforilazione.
PhotosystemsEdit
Questi fotosistemi sono centri redox guidati dalla luce, ognuno dei quali consiste in un complesso antenna che utilizza clorofille e pigmenti fotosintetici accessori come carotenoidi e ficobiliproteine per raccogliere la luce a diverse lunghezze d’onda. Ogni complesso antenna ha tra 250 e 400 molecole di pigmento e l’energia che assorbono viene trasferita per risonanza ad una clorofilla a specializzata nel centro di reazione di ogni fotosistema. Quando una delle due molecole di clorofilla a al centro di reazione assorbe energia, un elettrone viene eccitato e trasferito a una molecola di intercettore di elettroni. Il fotosistema I contiene una coppia di molecole di clorofilla a, designata P700, al suo centro di reazione che assorbe al massimo la luce a 700 nm. Il fotosistema II contiene la clorofilla P680 che assorbe meglio la luce a 680 nm (si noti che queste lunghezze d’onda corrispondono al rosso intenso – vedi lo spettro visibile). La P sta per pigmento e il numero è il picco di assorbimento specifico in nanometri per le molecole di clorofilla in ogni centro di reazione. Questo è il pigmento verde presente nelle piante che non è visibile ad occhi nudi.
Complesso del citocromo b6fModifica
Il complesso del citocromo b6f fa parte della catena di trasporto degli elettroni del tilacoide e accoppia il trasferimento di elettroni al pompaggio di protoni nel lume del tilacoide. Energeticamente, è situato tra i due fotosistemi e trasferisce elettroni dal fotosistema II-plastochinone alla plastocianina-fotosistema I.
ATP sintasiModifica
L’ATP sintasi tilakoide è una sintasi CF1FO-ATP simile all’ATPasi mitocondriale. È integrata nella membrana tilakoide con la parte CF1 che si attacca allo stroma. Così, la sintesi dell’ATP avviene sul lato stromale dei tilakoidi dove l’ATP è necessario per le reazioni indipendenti dalla luce della fotosintesi.
Proteine del lumeModifica
La proteina di trasporto degli elettroni plastocianina è presente nel lume e trasporta gli elettroni dal complesso proteico del citocromo b6f al fotosistema I. Mentre i plastochinoni sono solubili nei lipidi e quindi si muovono all’interno della membrana del tilacoide, la plastocianina si muove attraverso il lume del tilacoide.
Il lume dei tilacoidi è anche il sito di ossidazione dell’acqua da parte del complesso evolutivo dell’ossigeno associato al lato lumenale del fotosistema II.
Le proteine lumenali possono essere predette computazionalmente sulla base dei loro segnali di destinazione. In Arabidopsis, tra le proteine lumenali predette che possiedono il segnale Tat, i gruppi più numerosi con funzioni note sono il 19% coinvolto nell’elaborazione delle proteine (proteolisi e ripiegamento), il 18% nella fotosintesi, l’11% nel metabolismo e il 7% nei trasportatori redox e nella difesa.
Espressione proteicaModifica
I cloroplasti hanno il loro genoma, che codifica un certo numero di proteine del tilakoide. Tuttavia, nel corso dell’evoluzione dei plastidi dai loro antenati cianobatterici endosimbiotici, ha avuto luogo un esteso trasferimento genico dal genoma dei cloroplasti al nucleo della cellula. Questo ha fatto sì che i quattro principali complessi proteici del tilakoide siano codificati in parte dal genoma del cloroplasto e in parte dal genoma nucleare. Le piante hanno sviluppato diversi meccanismi per co-regolare l’espressione delle diverse subunità codificate nei due diversi organelli per assicurare la corretta stechiometria e l’assemblaggio di questi complessi proteici. Per esempio, la trascrizione dei geni nucleari che codificano parti dell’apparato fotosintetico è regolata dalla luce. La biogenesi, la stabilità e il turnover dei complessi proteici del tilakoide sono regolati dalla fosforilazione attraverso chinasi sensibili al redox nelle membrane del tilakoide. Il tasso di traduzione delle proteine codificate nel cloroplasto è controllato dalla presenza o dall’assenza di partner di assemblaggio (controllo per epistasi della sintesi). Questo meccanismo implica un feedback negativo attraverso il legame della proteina in eccesso alla regione non tradotta 5′ dell’mRNA dei cloroplasti. I cloroplasti devono anche bilanciare i rapporti di fotosistema I e II per la catena di trasferimento degli elettroni. Lo stato redox del plastochinone trasportatore di elettroni nella membrana tilaconica influenza direttamente la trascrizione dei geni cloroplastici che codificano le proteine dei centri di reazione dei fotosistemi, contrastando così gli squilibri nella catena di trasferimento degli elettroni.
Targeting delle proteine ai tilacòniModifica
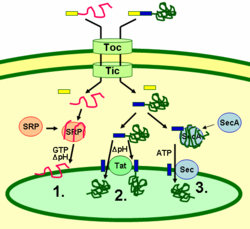
Le proteine tilakoidi sono indirizzate alla loro destinazione attraverso peptidi di segnale e vie secretorie di tipo procariotico all’interno del cloroplasto. La maggior parte delle proteine tillakoidi codificate dal genoma nucleare di una pianta hanno bisogno di due segnali di targeting per una corretta localizzazione: Un peptide di destinazione del cloroplasto N-terminale (mostrato in giallo nella figura), seguito da un peptide di destinazione del tilakoide (mostrato in blu). Le proteine sono importate attraverso il translocon dei complessi di membrana esterna e interna (Toc e Tic). Dopo essere entrato nel cloroplasto, il primo peptide di targeting viene scisso da una proteasi che elabora le proteine importate. Questo smaschera il secondo segnale di targeting e la proteina viene esportata dallo stroma nel tilakoide in una seconda fase di targeting. Questo secondo passo richiede l’azione dei componenti di traslocazione delle proteine dei tilakoidi e dipende dall’energia. Le proteine sono inserite nella membrana attraverso la via SRP-dipendente (1), la via Tat-dipendente (2), o spontaneamente attraverso i loro domini transmembrana (non mostrati in figura). Le proteine del lume sono esportate attraverso la membrana tilaconica nel lume attraverso la via Tat-dipendente (2) o la via Sec-dipendente (3) e rilasciate per scissione dal segnale di destinazione tilaconica. Le diverse vie utilizzano diversi segnali e fonti di energia. La via Sec (secretoria) richiede ATP come fonte di energia e consiste di SecA, che si lega alla proteina importata e di un complesso di membrana Sec per trasportare la proteina attraverso. Le proteine con un motivo a doppia arginina nel loro peptide di segnale tilakoide sono trasportate attraverso la via Tat (traslocazione a doppia arginina), che richiede un complesso Tat legato alla membrana e il gradiente di pH come fonte di energia. Alcune altre proteine sono inserite nella membrana attraverso la via SRP (signal recognition particle). La SRP del cloroplasto può interagire con le sue proteine bersaglio sia post-traslazionalmente che co-traslazionalmente, trasportando così le proteine importate così come quelle che sono tradotte all’interno del cloroplasto. La via SRP richiede GTP e il gradiente di pH come fonti di energia. Alcune proteine transmembrana possono anche inserirsi spontaneamente nella membrana dal lato stromale senza bisogno di energia.