US Pharm. 最近の研究では、痛みは数千万人の米国人に影響を与え、医療消費の増加、欠勤や生産性の低下による間接的なコストにより、米国では年間6350億ドルのコストがかかると推定されています2。オピオイドなどの薬剤による慢性疼痛の管理は一般的な戦略ですが、慢性疼痛は積極的なオピオイド療法にもかかわらず持続または悪化することがあります。 本論文は、疼痛治療のために処方されたオピオイドが、新たな疼痛を引き起こす、あるいは逆説的に疼痛を悪化させるという現象に光を当てることを目的としています。この状態は、オピオイド誘発性痛覚過敏(OIH)と呼ばれています。 OIHは、より正式には、オピオイドへの曝露によって引き起こされる侵害受容性感作の増加と定義される。3OIHは、耐性、中毒、依存、および疾患の進行とは明確に異なる。 4
Diagnosis and Presentation
起立耐性失調を正しく診断する上で最も問題となるのは、この症状がオピオイド耐性に酷似していることである。 5 耐性はオピオイドの投与量を増やすことで克服で きるが、起立耐性失調の患者では同じ増量でも痛みが増 加する。4 さらに、耐性は時間をかけてゆっくりと進行 する傾向があるが、起立耐性失調患者ではオピオイド 治療による痛みの増加が比較的早く起こる。 6
Undertreated painは除外すべきもう一つの可能性である。 オピオイド治療が最適でない場合、投与量を増やすと 痛みが軽減されるはずであるが、起立耐性失調がある場合は、 その逆の結果になるはずである。 6 さらに複雑なことに、オピオイドの離脱に よる痛覚過敏はよく知られている現象である7。 起立耐性失調に伴う痛みは、より拡散的で質 が低く、侵害刺激は通常予想される痛みよりも強 くなる傾向がある(表1)。 起立耐性失調では、傷害や組織損傷の部位を超えた 部位に痛みが現れることが多い。 起立耐性失調では、疼痛の原 因が取り除かれたり、損傷した組織が治癒したりし ても疼痛が持続することがある。オピオイド治療が進 むと、時間、休息、その他の通常臨床的に適切な治 癒を可能にする措置にもかかわらず、疼痛は当初の報告 より悪化したように見えることがある5。 5

病因
起立耐性失調の原因については、いくつかの説がある。 最も多く研究され、現在最も注目されている説は、神経興奮モデルである。 ある種のオピオイドとその代謝物がN-methyl-D-aspartate(NMDA)受容体をアゴナイズすると信じられている。 NMDA受容体が活性化されると、カルシウムが流入し、神経細胞の興奮性が大きく高まります。 NMDA受容体とそれに対応する神経細胞がより活性化されると、循環物質や他の有害な刺激によって引き起こされる痛みのインパルスをより容易に伝えることができるようになります。 9
NMDA受容体の活性化によって前駆症状が調節されると いうこの理論を裏付けるものとして、NMDA受容体拮抗薬 の投与によって起立耐性失調が緩和されたという研究結果があ る。 これらの拮抗薬は、NMDAチャネルのフェンシクリジ ン部位に非競合的に結合し、受容体がグルタミン酸や異 性物質と結合したときに生じるカルシウムの流入をブ ロックする10 。動物およびヒトでの研究により、NMDA受容 体拮抗薬のケタミンを投与した起立耐性失調被験者に 対し、疼痛刺激制御試験で良好な成績を示した。 ある研究では、ラットにモルヒネを数日間髄腔内 に注射し、熱に感受性のある起立耐性失調を呈した。 NMDA阻害剤であるジゾシルピンの投与は、少なくとも 部分的に熱痛覚過敏を回復させるのに有効であった5。 コデイン、ヒドロモルフォン、モルヒネなどのオピオイドは、通常の代謝プロセスの一部として、多くの生体内変換を受ける。 モルヒネは多くの分子に代謝されますが、主にグルクロン酸化により、モルヒネ-3-グルクロニド(M3G)およびより高度にはモルヒネ-6-グルクロニド(M6G)に代謝されます(図1)11
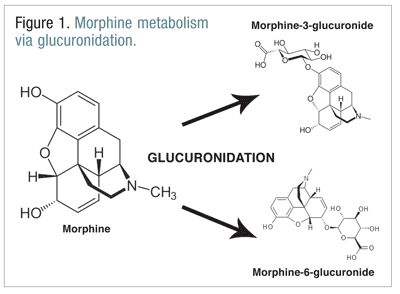
M6G は治療上重要な代謝物であるとされています。 モルヒネと同様のmu受容体結合親和性を有し、モルヒネと同様の鎮痛作用、呼吸抑制作用、その他の作用を発揮することができる。 しかし、M3Gはmu受容体のアゴニストではなく、mu受容体への親和性はモルヒネと比較してほとんどない。 M3Gは、モルヒネ、M6G、その他のオピオイドとは異なり、NMDAアゴニストである。 12 他のオピオイドは、NMDAアゴニスト活性と逆説的な 神経興奮作用に関与しているとされている。 13 μ受容体からオピオイドを置換することで、ナロキ ソンはμ受容体活性化により可能な鎮痛をオピオイドに与 えないようにし、同時に、痛覚過敏も抑制されないまま にした14。
治療オプション
起立耐性失調症の診断が下されると、いくつかの治療オプションから慎重に選択する必要がある。 最初の疼痛を伴う傷害や組織損傷が解消され、オピオイド治療にもかかわらず、あるいはオピオイド治療が原因で疼痛が続いている場合、最も簡単な方法は、原因となるオピオイドを中止することである。 これは、有害な離脱効果を最小限に抑えるために、徐々に行うべきである。 このことは、痛みの治療のために処方された薬が痛みを引き起こしたり悪化させている可能性があり、最終的に解決する前に痛みがさらに悪化する可能性があることを臨床家が患者に納得させることが困難な倫理的状況をもたらす17
正当な痛みが続き、オピオイドによる鎮痛がある程度必要な場合、オピオイドの完全中止以外の戦略を検討する必要がある。 4 オピオイドの減量により、鎮痛と痛覚過敏の緩和のバ ランスが取れたという報告もある。 4 フェナントレン系オピオイドの滴定と別のオピオイドへの変 更により、起立耐性失調が解消される可能性がある。 コデイン、ヒドロモルフォン、モルヒネ、および構造的に類似したオピオイドは、その代謝の一部としてグルクロン酸抱合を受ける。 フェンタニルのような構造的にユニークなオピオイドに変更することで、NMDA受容体活性化グルクロニド代謝物を回避することが可能である。 この論文執筆時点では、オキシモルフォンに関する試験で起立耐性失調は証明されていない4
オピオイド療法にCOX-2阻害剤を補充することも、ある程度支持されている戦略である。 COX-2阻害剤は、プロスタグランジン合成を減少させることにより、前駆刺激性ニューロンの感作を減少させることができる。 非ステロイド性抗炎症薬(NSAIDs)およびCOX-2阻害剤は、末梢でプロスタグランジン合成を抑制する能力とは無関係に鎮痛効果を発揮するようである9。 中枢性では、NSAIDsはグルタミン酸、サブスタンスPおよび他の興奮性アミノ酸をブロックすることにより、NMDA受容体に拮抗することが可能である。 これとは別に、NMDA受容体の活性化はCOX-2の発現をアップレギュレートすることができる。18
OIH におけるNMDA受容体の役割に注目が集まっていることから、この受容体の拮抗は妥当な治療戦略であると思われる。 ケタミンは多くの研究がなされているが、その副作用は深刻である。 19 これらの作用には、頻脈性不整脈、高血圧、認知障害、および気分変化、鮮明な夢、せん妄、幻覚、および鎮静を含む精神模倣反応が含まれる。 ケタミンは、大量に投与された患者の痛覚過敏の回復とオピオイドの効果の増強に有効であるが、その副作用のため、実行可能な治療選択肢とはなっていない。 モルヒネとデキストロメトルファンを1:1で混合した配合剤が研究されている20。 この研究では、デキストロメトルファンの量が不十分で、NMDA受容体に十分に拮抗できなかったと批判されています21。1691>
メタドンは、起立耐性失調患者の疼痛を治療する ための有力な選択肢となるユニークな性質を持つオピ オイドである。 4 低用量のメタドンの添加でも、痛覚過敏の軽減に有 効であることが報告されている。 ある症例では、低用量メタドン(10mg 1日2回)の追加により、疼痛が顕著に改善し、総オピオイド量が40%から50%減少した22。 22 トラマドールやメペリジンにもNMDA受容体拮抗作用が ある。23,24 ブプレノルフィンは、ミュー受容体の部分オピ オイド作動薬であると同時に、カッパ受容体拮抗作用があ る。 25 起立耐性失調の治療におけるブプレノルフィン の臨床的有用性は、まだ十分に説明されていな い。 7753>
起立耐性失調が解明されたと宣言するまでに は、多くの課題が残されている。 この現象の正確な細胞機序やシグナル伝達経路は、 定義されていない。 さらに複雑なことに、特定の成分が重要な役割を果た しているのか、あるいは全く役割を果たしていないのかに ついては、相反する報告がある。 起立耐性失調の病態解明に関する研究の大部分は、動物モデルで行われ ている。
病態の原因の理解が不十分であるため、治療法の選択肢は不確かである。 利用可能な最善の戦略は、問題のあるオピオイドを完全に中止することであるが、これはオピオイドタイプの疼痛緩和を必要とする患者にはほとんど役に立たない。他のいくつかの治療方法が検討されているが、いずれもさらなる研究が必要である。 ヒトで行われた研究の大半は、周術期患者、回復期の薬物中毒者、実験的な疼痛モデルである。 これらの研究は価値がないわけではないが、これらの集団は慢性疼痛患者を反映していない。 この論文執筆時点で、起立耐性失調の治療にNMDA受容体拮抗薬 のメマンチンを用いた多くの臨床研究が進行中または計 画中である26 。 26 それでもなお、起立耐性失調におけるNMDA受容体の 正確な役割については、相反する報告があるため、 起立耐性失調に存在する鍵となる受容体とそのメカニズム を明らかにするためには、さらなる研究が必要である。 研究のサンプルサイズを拡大することで、どの治療薬が起立耐性失調の原因であり、治療に有効であるかについての結論を支持することができる。
Chapman らは、起立耐性失調の診断と効果的な治療を行う前 に答えなければならない特定の問題を提起している27。 どのような種類の痛みで、あるいはどのような患者 で、起立耐性失調が起こりやすいのか? これらは、今後の臨床研究の指針となるべき問題である。 Parselis Kelly J, Cook SF, Kaufman DW, et al. 米国成人集団におけるオピオイド使用の有病率と特性. Pain. 2008;138:507-513.
2. Institute of Medicine. Relieving Pain in America: 米国における痛みの緩和:予防、ケア、教育、研究を変革するための青写真. Clin J Pain. 2008;24:479-496.
4. Lee M, Silverman SM, Hansen H, et al. A comprehensive review of opioid-induced hyperalgesia. ペイン・フィジシャン。 2011;14:145-161.
5. オピオイド誘発性疼痛感受性異常:臨床オピオイド療法における意義.Mao J. 痛み。 2002;100:213-217.
6. Raffa RB, Pergolizzi JV Jr. オピオイドによる痛覚過敏:疼痛患者の治療と臨床的な関連性はあるか? Pain Manage Nurs. 2011;1-17.
7. Li X, Clark JD. オピオイド断薬中の痛覚過敏:グルタミン酸とサブスタンスPによるメディエーション Anesth Analg. Pud D, Cohen D, Lawental E, Eisenberg E. Opioids and abnormal painperception: new evidence from a study of chronic opioid addicts andhealthy subjects.2002;95:979-984.
8. Drug Alcohol Depend. 2006;82:218-223.
9. マルムバーグAB、ヤクシュTL. 脊髄グルタミン酸受容体、サブスタンスP受容体を介した痛覚過敏は、脊髄シクロオキシゲナーゼ阻害でブロックされる。 Science. 1992;257:1276 -1279.
10. フィッシャーK、Coderre TJ、Hagen NA。 慢性疼痛管理のためのN-methyl-D-aspartate受容体の標的化。 前臨床動物試験、最近の臨床経験、および将来の研究方向性。 J 痛み症状管理します。 2000;20:358-373.
11. Lötsch J. オピオイドの代謝産物。 J Pain Symptom Manage. 2005;29:S10-S24.
12. Skarke C、Lötsch J.モルヒネ代謝物:臨床的意義。 Semin Anesth、Perioperativeメッドペイン。 2002;21:258-264.
13. モルヒネによる痛覚過敏は、オピオイド活性、鎮痛、耐性と無関係である:複数の多様な痛覚過敏システムを形成する証拠。 また,”Brain Res “誌2006:1070:35-44.
14. Angst M, Clark JD. オピオイド誘発性痛覚過敏:定性的系統的レビュー。 Anesthesiology. 2006;104:570-587.
15. Vanderah TW, Gardell LR, Burgess SE, et al. Dynorphin promotes abnormal pain and spinal opioid antinociceptive tolerance(ダイノルフィンは異常疼痛と脊髄オピオイド抗侵害受容を促進する). J Neurosci. 2000;20:7074-7079.
16. Hooten WM, Mantilla CB, Sandroni P, Townsend CO. 漸減中の慢性疼痛患者における熱痛覚とオピオイド用量の関連性。 Pain Med. 2010;11:1587-1598.
17. オピオイドによる痛覚過敏:ペインプラクティショナーのための臨床的意味合い。 ペインフィジシャン。 2009;12:679-684.
18. 李SQ、興YL、陳WN、他。 NMDA受容体の活性化は、ラットの侵害受容入力時の脊髄背側角におけるCOX-2発現のアップレギュレーションと関連する。 神経化学研究 2009;34:1451-1463.
19. ケタミン:疼痛・緩和医療専門医のための入門書. Pain Physician. 2007;10:493-500.
20. このような状況下において、「医療費抑制のために必要なことは何か」、「医療費抑制のために必要なことは何か」、「医療費抑制のために必要なことは何か」、「医療費抑制のために必要なことは何か」、「医療費抑制のために必要なことは何か」、「医療費抑制のために必要なことは何か」、「医療費抑制のために必要なことは何か」、「医療費抑制のために必要なことは何か」、「医療費抑制のために必要なことは何か」、「医療費抑制のために必要なことは何か」を考えることが重要である。 Pain. 2005;115:284-295.
21. Wiesenfeld-Hallin Z. Combined opioid-NMDA antagonist therapies.What advantages do they offer for the control of pain syndromes? Drugs. 1998;55;1-4.
22. オピオイドの減量に伴う鎮痛効果の改善. Pain Med. 2008;9:724-727.
23. バロンMJ、マクドナルドPW. 慢性疼痛患者における高用量オピオイドからの解毒後の有意な疼痛軽減。 J Opioid Manag. 2006;2:277-282.
24. Koppert W, Ihmsen H, Körber N, et al.ヒト疼痛モデルにおけるブプレノルフィン誘発鎮痛・抗過覚の異なるプロファイル。 Pain. 2005;118:15-22.
25. Pan ZZ. κ-オピオイド受容体のμ-opposing作用. また、そのような薬物療法を行うためには、薬物療法を行う前に、薬物療法を行う前に、薬物療法を行う前に、薬物療法を行う前に、薬物療法を行う必要がある。 Ballantyne JC, Mao J.慢性疼痛に対するオピオイド療法. N Engl J Med. 2003;349:1943-1953.
27. このような状況下において、「オピオイドを用いた慢性疼痛治療」を行うためには、「オピオイドを用いた非がん性慢性疼痛治療」を行うためのエビデンスベースが必要である。 J Pain. 2010;11:807-829.