はじめに
免疫蛍光法(IF)は、抗体と蛍光検出器を用いて、固定した細胞や組織における標的タンパク質の局在、相対発現、活性化状態について研究する方法です。
- どのような細胞や組織が標的タンパク質を発現しているか、
- 実験の影響により、標的タンパク質の発現や活性化はどのように変化するか、などの質問に答えるために使用されます。
- 標的タンパク質は細胞や組織のどこに局在していますか?
- 細胞や組織の構造において、異なる標的タンパク質間の空間的関係はどうなっていますか?
免疫蛍光法は、時間とともに発展した多くの関連技術を包含しています。 これらの技術はすべて、抗体による生物学的標的の特異的認識と、サイトメトリー分析における蛍光レポーターの検出を活用しています。 このページでは、プロトコルを理解し、よくある質問に答え、IF実験を成功させるために役立つリソースをまとめました。
正しいIF技術とプロトコルの選択
最適なIF技術/プロトコルは、生物材料の種類、サンプル処理ステップ、標的抗原の特性、使用する特定の抗体によって影響を受けます。
考慮すべき点は以下のとおりです。
- 入力材料は、培養細胞株、凍結組織、またはホルマリン固定、パラフィン包埋(FFPE)組織です。
- 培養細胞株および初代細胞については、免疫蛍光-免疫細胞化学(IF-IC)用に検証済みの抗体を見つけてください。
- 多くのラボで、「免疫組織化学/IHC」は、パラフィン包埋または凍結された組織を含むキャッチオール用語として使用されており、発色および蛍光検出の両方を含むために使用することができます。
- FFPE組織サンプルでは、免疫組織化学(IHC-P)でバリデートされた抗体は、標的抗原が豊富な場合は増幅せずに蛍光検出で、またはシグナル増幅を伴う多重IHC(mIHC)でも使用することができます。
- 製品固有のプロトコルは、各製品のウェブページに記載されています。 IFバリデーションの抗体については、製品ページで「IF」を選択すると、IFバリデーションデータおよびプロトコルが表示されます。 各抗体の基本情報(希釈倍率/使用濃度、検証済みアプリケーション、反応性、宿主種)は製品データシートに記載されています。
- また、最も一般的に用いられるIFプロトコルは、プロトコルページで確認することができます。
IF 用抗体の選択:抗体バリデーションの重要性
最高の抗体は、最小限のバックグラウンドで強力かつ特異的なシグナルをもたらします。 使用するアプリケーションで検証された抗体を選択することが重要です。 IFにおける抗体の検証には、陽性および陰性発現実験(ノックアウト細胞株、遺伝子モデル、CRISPRまたはRNAiを使用)、標的タンパク質の局在または翻訳後修飾の実験的操作、およびプロトコルの最適化が含まれます
抗体の性能は用途によって変化するものです。 例えば、ウェスタンブロット実験で良好な性能を示す抗体は、IFで性能を示す場合もあれば、示さない場合もある。 新しい抗体のテスト中に、わずかなオフターゲット結合を示すものがありますが、これらはIFまたは他の非WBアプリケーションには決して推奨されません。 さらに、ある抗体は凍結組織ではよく機能するが、FFPE組織では機能しない、あるいはその逆もあり得ます。
実験に使用する生体サンプルの種類とその準備方法が決まったら、cellsignal.comで抗体を閲覧する最も簡単な方法は、最初に適切なアプリケーションを選択することです。
Designing control experiments for IF
実験デザインと結果に自信を持ち、抗体がそのターゲットを忠実に報告していることを確認するには、陽性および陰性対照実験が有益な情報となりえます。 例えば、
- 二次抗体のみのコントロールは、二次抗体の非特異的結合があるかどうかを知ることができます。
- ノックアウト/siRNA実験や、既知の発現細胞と非発現細胞の比較により、一次抗体の特異性を確認することが可能です。 このタイプの実験は、染色性の欠如が、2つの抗原が互いに近接しているときに発生する立体障害によるものかどうかを判断するのに役立ちます。
- リン酸化特異的抗体は、IFにおいてリン酸化した標的のみを認識することを確認するために、サンプルをホスファターゼで処理することができます。
- 固定化または透過化の問題が疑われる場合、過去にあなたのラボで機能した抗体で確認すると、トラブルシューティングに役立ちます。
Cell Signaling Technology (CST) の科学者は日常的に、バリデーションプロセスの一環としてこのタイプのコントロールを行っています(一例をご覧ください)。
一次抗体と二次抗体、直接染色と間接染色
一次抗体は、標的抗原を特異的に認識することができます。 二次抗体は、育種された種に基づいて一次抗体と結合します。 ウサギやマウスで育てた一次抗体は、それぞれ抗ウサギや抗マウス二次抗体で検出可能です。
一次抗体と、蛍光色素と結合した二次抗体(一次抗体の宿主種に特異的)の対は、間接染色として知られています。 二次抗体を使用せず、蛍光色素に結合した一次抗体を使用することは、直接染色として知られている。 直接染色法は、時間を節約し、同じ宿主種で育てた抗体を用いたマルチプレックス染色を可能にする。
これらの手法の他のバリエーションとして、ビオチン化一次抗体とアビジン/ストレプトアビジン結合蛍光色素の使用も可能である。 蛍光色素を結合させたF(ab’)2二次抗体フラグメント(Fcドメインを欠く)は、バックグラウンドを減少させるのに役立ちます。 mIHCでは、西洋わさびペルオキシダーゼ(HRP)標識二次抗体が、チラミド-フルオロフォア結合体の沈着を触媒するために使用される。
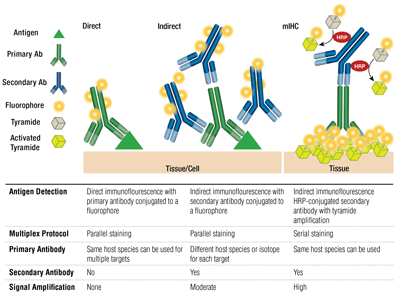
抗体蛍光色素の選択
抗体蛍光色素の選択
何種類のターゲット/抗体を多重化できますか?
マルチプレキシングとは、複数の抗体を用いて一度に複数のターゲットを検出し、それぞれのターゲットに対して異なる波長(色)で検出することです。 間接染色では、蛍光標識された種特異的な二次抗体と一次抗体との組み合わせにより、多重染色を行うことができます。 アイソタイプの異なるマウス抗体も、アイソタイプ特異的な二次抗体を用いて多重化することができ、一度に最大5つのマウス抗体を検出することができる。 直接染色する場合は、それぞれの一次抗体に異なる蛍光色素を結合させる必要があります。
マルチプレックスIF実験をデザインする場合、蛍光顕微鏡のスペクトル特性(利用可能な励起源やフィルターセットなど)を考慮し、スペクトルのブリードスルーを防ぐ必要があります。
Combining antibody staining with dyes or tags
Cellular dyes that is applied post-fixation or fixable live-cell labels can be incorporated into an IF workflow.
抗体染色と色素またはタグの組み合わせ
固定後に塗布する細胞色素や固定可能な生細胞のラベルは、IFワークフローに組み込むことができます。 オルガネララベリングは、ターゲットの細胞内局在を確認するためによく使用されます。 GFPのような発現タグは、トランスフェクトされた細胞の追跡やモザイク実験によく使用されます。GFP蛍光シグナルが低い場合は、抗GFP抗体をIFに使用することが可能です。
実験のための蛍光色素の選択
これは、励起光源のスペクトル特性と、利用できる励起/発光フィルタリングに依存します。 蛍光のブリードスルーを避けるため、実験を行う前に蛍光体の励起および発光プロファイルを評価します。 CSTでは、Alexa Fluor® ラインの色素を含む、さまざまな蛍光色素標識一次抗体および二次抗体を提供しています。
サンプル調製
組織
組織切片は、最適切断温度(OCT)培地で急速冷凍する方法とパラフィンに固定・包埋する方法のいずれかで作成することができます。 凍結したサンプルは、クライオスタットを用いて切り出し、次のステップに進む前に固定する前にスライド上で10~15分自然乾燥させることができます。
Frozen vs FFPE tissue
一般に、FFPE組織はOCTで包埋された凍結組織よりも形態が良好であると言われています。 これにより、陽性細胞の定量化や染色間の境界の特定が容易になる可能性がある。 また、FFPE組織は非常に安定しており、一度埋め込んだ組織ブロックは何年も保存することができる。 この種の組織はラボ間の輸送も容易で、ヒトの病理学的標本には好ましい処理方法です。
その一方で、FFPE組織はいくつかの余分な処理工程を経るため、タンパク質の分解により抗原の総量が減少し、残った抗原を検出するためのマスク除去工程が必要となり、アルデヒドによる自家蛍光を増悪させることがあります。 非常に豊富なタンパク質を扱わない限り、残存抗原を間接的なIFで検出することは困難であり、適切な染色を得るために増幅が必要となる場合があります。 また、抗原賦活化により、通常は検出されない抗原がマスクされなくなる可能性があり、そうでなければ期待通りの染色パターンを与える抗体が、非特異的な染色を与える可能性があります。 また、標的エピトープを検出するために、特定の方法で抗原賦活を行う必要がある場合も同様にあり得ます。 したがって、ある抗体がどのように検証され、それを使用するためにどのようなステップが必要かを検討することが重要です。 組織を切った瞬間にスライドが使えるようになり、埋め込むまでの処理工程が少ないので、免疫染色の結果を得るには最も早い方法です。 タンパク質の分解が少なく、より多くの抗原が抗体と結合できるため、過酷な回収工程を追加する必要がありません。 この方法は増幅を必要としないため、組織の品質に対してより敏感である。 固定方法の種類(アルコールとアルデヒド)、固定時間(転写因子など、より短い固定時間が必要なターゲットもあります)、組織年齢(特に切片化後)はすべて重要で、ターゲットによって異なります。 最後に、凍結組織を使用することで、切片化後に処理を行うことができるため、ターゲット選択においてより柔軟性があり、アッセイデザインにおいてよりカスタマイズすることが可能です
培養細胞
細胞は蛍光顕微鏡に適した支持体上に播種する必要があります。 典型的な支持体としては、ガラス底の細胞培養皿、ポリリジンおよび/または細胞外マトリックス成分で接着細胞培養をサポートするように調製したガラスカバースリップ(プラスチック培養皿に保管)、顕微鏡に適合するスライドガラスにマウントした市販のマルチウェルチャンバーなどが挙げられます
細胞培養条件は、細胞の健康、形態、標的タンパク質の発現/局在に影響し、最終的にIFデータの質を決定する可能性がありますので注意してください。 定期的に培地のpH変化を確認し、細胞ストレスの兆候(多核細胞など)を顕微鏡の低倍率で検査し、細胞が健康であることを確認してください。 また、細胞のコンフルエンスが細胞の種類やターゲットに対して適切であることも確認してください。
サンプルの固定
理想的な固定剤は、架橋と内因性酵素の阻害により自己分解の分解プロセスを迅速に停止させながら「生命らしい」スナップショットを保存し、抗体による認識のために抗原を提示するものです。 残念ながら、すべてのサンプル、すべての抗原に対して理想的な固定方法は存在しません。 同じ標的タンパク質上の異なる抗原であっても、プロトコルの違いによって差が生じることがあります。
Tissue
新鮮な凍結組織の場合、凍結してクリオスタットで切断した切片は、固定剤で処理する必要があります。
FFPE組織の処理では、組織はホルマリン(または他のアルデヒド系固定剤)による浸漬固定、または上記のような灌流によって保存され、その後パラフィン包埋と切片作成が行われる。 抗体とインキュベートする前に、切片は脱パラフィン、再水和、抗原賦活のステップを経て、抗体がサンプルにアクセスし、標的分子と結合できるようにしなければならない。
Cells
固定直前に温めた無タンパク培地またはPBSで細胞を洗浄すると、細胞外タンパク質や破片の沈殿を防ぐことができます。
Aldehyde fixing vs alcohol fixation
ホルムアルデヒド、ホルマリン(溶解したホルムアルデヒドと低い割合のメタノールの混合物)、グルタルアルデヒドなどのアルデヒド系固定剤は、構造を保持することが重要な場合に最もよく使用されています。 ほとんどの抗体に対して、CSTは4%ホルムアルデヒド(メタノールフリー)での固定を推奨しています。 アルデヒドは細胞内タンパク質の一次アミンと反応して架橋し、サンプルを安定化させます。 さらに、ホスファターゼやプロテアーゼなどの細胞内酵素は、架橋により不活性化されます。 アルデヒドはアルコールよりも細胞膜を通過して可溶性タンパク質を固定するが、標的によってはアルデヒド架橋によって抗原性を失うことがある。
メタノールなどの脱水/変性アルコール固定剤は細胞高分子周囲の水分を置換し、その場で変性や沈殿を生じる。 標的タンパク質の変性は、埋もれたエピトープを露出させる可能性があり、抗体によってはアルデヒド固定よりも有利な方法である。 しかし、脱水固定剤は、可溶性ターゲットやリン酸化抗体などの修飾状態特異的な抗体にはあまり適していません。
透過型固定剤の選択
架橋型固定剤を使用した場合、細胞膜がそのまま残っているため、細胞内ターゲットは抗体によるアクセスが不可能になります。 したがって、抗体が細胞外のエピトープを認識する場合を除き、架橋固定後に透過処理を行う必要があります。 最適な透過化方法は抗体によって異なります。推奨されるプロトコルについては、必ず製品ページをご確認ください。
固定後の透過化には、Triton® X-100を使用することが一般的です。 TritonやNP-40、TWEEN®、Saponin、Digitonin、DOTMACなどの洗浄剤は、細胞膜と相互作用し、可変の「孔」サイズを作り、抗体のアクセスを可能にします。 この方法は、架橋固定剤の迅速な固定と、膜の中間的なタンパク質変性および脱脂を組み合わせたものである。
What fix/perm conditions do I use when multiplexing?
異なるCSTプロトコルを要求する抗体を用いて多重化する場合、どの抗体をその最適条件で使用するかを優先する必要がある場合があります。 mIHCで実施したオーダー最適化の例を、このアプリケーションノート(PDF)で紹介しています。
ブロッキング試薬の選択
最も一般的な推奨は、PBS + 0.3% Triton® X-100中の5%正常ヤギ血清(または二次抗体と同じ種からの血清)です。
サンプルにFcレセプターが存在する場合、抗体のシグナルは、Fcレセプターに結合する抗体重鎖の非特異的吸収と同様に(抗体の抗原結合部位/可変領域を介して)特定のターゲット認識の混合から得られます。 動物血清中に存在する全IgGは、一次抗体と二次抗体の結合を防ぎ、バックグラウンドノイズを低減するためにFcレセプターをブロックする。 フルオロフォア結合F(ab’)2フラグメントを選択すると、二次抗体のFcレセプター結合も回避できる(一次抗体にはできない)
ウェスタンブロッティングなど、他の抗体ベースのアプリケーションでは、ブロッキングステップにより、一次抗体と二次抗体が意図したターゲット以外の部位に非特異的に低親和性結合することで生じるバックグラウンドシグナルが減少する。 しかし、IFで厳密にテストされたリコンビナントウサギモノクローナル抗体は、ブロッキングの有無にかかわらず、多くのサンプルで良好なパフォーマンスを示すことが分かっています。
IFにおける抗体濃度とS/N比
S/N比は、特定のアプリケーションにおける抗体の特異性と感度に関連します。 S/Nは、目的のターゲットを発現している細胞の蛍光強度の「シグナル」と、発現を欠く細胞の「バックグラウンドノイズ」を比較することで算出することができます。 抗体の適用濃度が低すぎる場合、蛍光シグナルが薄すぎてバックグラウンドノイズと区別がつきません。 一方、濃度が高すぎると、バックグラウンドの染色に寄与し、S/Nが低下します。
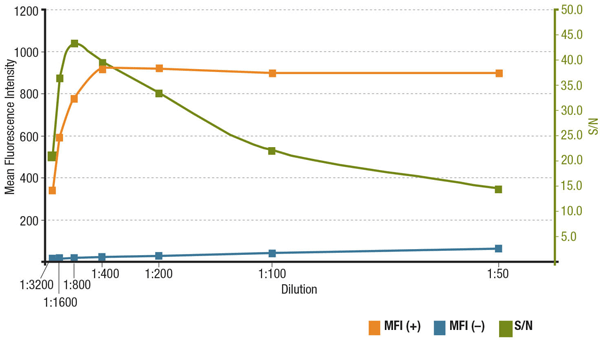
Analyst of S/N for MUC1 (D9O8K) XP® Rabbit mAb #14161希釈度. 発現している(MFI(+)、オレンジ)ZR-75-1細胞と非発現(MFI(-)、ブルー)HCT 116細胞における平均蛍光強度の定量とS/N算出(グリーン)
MUC1(D9O8K)XP®ラビットmAb #14161のS/Nを解析したもの。 発現している(MFI(+)、オレンジ)ZR-75-1細胞と非発現(MFI(-)、ブルー)HCT 116細胞における平均蛍光強度を定量し、S/N(グリーン)を算出。
抗体のインキュベーション時間
一般に4℃でのオーバーナイト培養では強いシグナルとなる。 インキュベーション時間や温度を変えると、シグナルやS/Nが変化することがあります。
IFを行うには共焦点顕微鏡が必要ですか?
適切な励起光源とフィルターがあれば、落射蛍光顕微鏡、走査型顕微鏡、回転ディスク共焦点顕微鏡を含む、あらゆる蛍光顕微鏡でIFを行うことが可能です。
Compatibility with automated high-throughput screening/high content analysis
IF-IC で承認された抗体は、ハイスループットスクリーニング(HCS)やハイコンテンツ解析(HCA)に使用することが可能です。 これらの実験は、自動化を取り入れた標準的なIF技術に基づいています。
IF実験で問題に直面しましたか?
Cell Signaling Technology、CST、およびXPは、Cell Signaling Technology, Inc.の商標です。 その他すべての商標は、それぞれの所有者の財産です。