水素結合の定義
水素結合は、部分的に正電荷の水素と部分的に負電荷の原子(酸素と窒素)の間の引力である。 これは非常に弱い結合で、水素結合の強さ(結合あたり5-10 Kcal)は共有結合の強さに比べてはるかに小さい。 水素結合は通常、2つの原子の間を点線で結ぶ形で示される。 例えば、水の2分子間の水素結合を以下に示します。
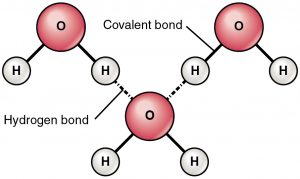
水素結合の理由
酸素や窒素などの非常に電気陰性な原子があると、酸素と水素が共有している電子対はより電気陰性な原子のほうへ引き寄せられます。 このような電子対の不均等な分布により、2つの部分双極子が形成されます。 部分的に正に帯電した水素は、他の部分的に負に帯電した酸素や窒素に引き寄せられ、水素結合として知られています。 これによって、水素結合には2つのタイプがあります。
- 分子間水素結合
- 分子内水素結合
分子間水素結合
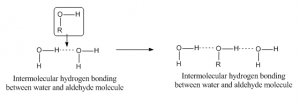
異なる分子間の水素結合は、分子間水素結合と呼ばれています。 このような結合のためには、ある分子は部分的に正の水素をアクセプター原子として持ち、別の分子は部分的に負のまたはドナー原子を持っていなければならない。 例えば、アルデヒドと水の水素結合は次のようになります。 これは、同じ分子内に2つの官能基が存在し、それらが互いに引き合って水素結合を形成するような状態にあるときに起こります。 例えば、サリチル酸は、アルコールとカルボン酸の2つの官能基を持っています。 5308>
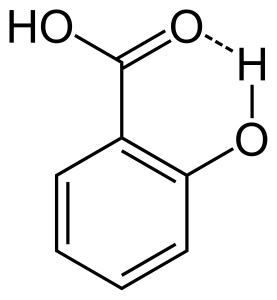
水素結合の効果
沸点について
同一または類似の分子量の物質の沸点は同一または類似であると予想されます。 同程度の分子量のエーテルとアルカンの沸点はそれほど離れていない。 しかし、アルコールの沸点は同程度の分子量のエーテルよりはるかに高い。 これは、水素結合の観点から説明することができる。 アルコールでは水素結合があるため、沸点が高くなる。 沸騰する前に水素結合を切断するために余分なエネルギーが必要になる。

溶解度について
アルコールは水に溶けるが、アルカンは溶けない。 これは、分子間水素結合化合物は分子間水素結合溶媒に溶けるからです。 アルコールのような極性分子は2つの水分子に入り込んで水素結合を作ることができるが、アルカンのような非極性物質はできない。 しかし、アルコールの炭素鎖が長くなると、水素結合を形成する際に邪魔になり、溶解性が低下する。
まとめ
- 水素結合は、部分的に正に帯電した水素と部分的に負に帯電した原子間の引力のことを言います。
- 同じ分子の部分的に帯電した原子の間で水素結合が起こると、分子内水素結合と呼ばれます。
- 分子間水素結合のために、極性化合物の沸点は同じaを持つ極性化合物より高くなります。
- 有機化合物と水の間の水素結合により、ある程度の溶解が可能です。