はじめに
B型肝炎ウイルス(HBV)感染はアジアのほとんどの地域で肝硬変と肝細胞癌の最も多い原因となっています1,2。 慢性肝炎の病態は、宿主の免疫反応とHBV抗原を提示する肝細胞の相互作用によって進行します。3,4 以前の研究では、肝細胞によるHBV抗原の発現が慢性肝疾患のステージおよび活動性と重要な関係があることが証明されています。 免疫寛容期には、B型肝炎コア抗原(HBcAg)のほとんどが核に存在し、HBVの複製と相関しています。一方、続く免疫クリアランス期には、HBcAgの核から細胞質への肝内移行が起こり、慢性肝炎の組織学的活性と関連しています5,6。 B型肝炎表面抗原(HBsAg)が肝臓内に発現している場合、3つのパターン-均質型、I型ground glass hepatocyte(GGH)、II型GGH-が報告されています。 ホモジニアス型は、高ウイルス血症や活動性肝炎の患者において、集団的、離散的、あるいは微弱に発現するパターンが観察される。 I型GGHは、一般に肝小葉に単発で散在し、封入体様の密な均一発現であるのに対し、II型GGHは、肝細胞の周辺に表面抗原を発現し、群発的に集積し、一般に低増殖期に存在し、活動性肝炎から肝硬変、肝細胞癌にかけて流行する(7) 。-10 したがって、肝内HBcAgとHBsAgの両発現は、感染とHBV複製の自然経過と密接に関連しているのである。
B型慢性肝炎のうち、HBeAg陽性慢性肝炎と呼ばれる免疫クリアランス期は、HBeAg陰性慢性肝炎に比べて、若年層に多く、組織学的活動性が低く、プレコアA1896変異やバサルコアプロモーター(BCP)T1762/1764変異の保有率が少ない11。-14 B型慢性肝炎の経過は、ウイルス複製と宿主免疫系の相互作用から生じるダイナミックなものである。 そのため、HBeAg陽性患者では、臨床的特徴や組織学的活動性に多様性が認められるのが一般的です。 肝細胞におけるHBsAgの蓄積は、特定のウイルス変異と関連し、疾患活動と関連していることが示されている8,9。 自然発生するHBV変異体のうち、BCP T1762/A1764変異は疾患の進行とともに広まり、進行した肝臓疾患や肝細胞癌と頻繁に関連していることが分かっている17,18。 BCP T1762/A1764変異と肝内HBsAg発現の関連はまだ不明であり、今後の検討課題である。
そこで、本研究の目的は、HBe抗原陽性B型慢性肝炎における肝内HBsAg発現の特徴を評価し、肝組織学、ウイルス複製マーカー、HBV変異体との関連を解析することにある。
材料と方法患者
本研究では、対象基準を満たす治療歴のないHBe抗原陽性患者計181名をレトロスペクティブに抽出し登録した。 対象基準は、年齢18歳以上70歳未満、血清HBsAgが6カ月以上陽性で血清HBV DNA値が10万コピー/mL以上、血清アラニンアミノトランスフェラーゼ値が異常、他に説明できる慢性肝炎の病因がない、であった。 アルコール、自己免疫性肝炎、C型肝炎ウイルス、D型肝炎ウイルス、ヒト免疫不全ウイルス感染のマーカーを含み、抗HBV治療歴がなく、組織学的評価に利用できる肝生検の標本がないこと。 全患者の血清と肝生検は抗ウイルス治療前に採取し、検査まで-70 oCで保存した。 この研究は、国立成功大学病院の施設審査委員会(No: ER-99-398)の承認を得ている。 血清HBV DNA量はCOBAS Amplicor HBV Monitor test (COBAS-AM assay, Roche Diagnostics, Branchburg, NJ)を用いて測定された. 血清HBsAg値はAbbott Architect HB-sAg QT(Abbott Diagnostics, Rungis, France)により定量され、ダイナミックレンジは0.05-250.0 IU/mLであった。 HBsAgレベル> 250 IU/mLのサンプルは、1:20および1:1000の希釈で再検査した。
ポリメラーゼ連鎖反応とプレコアおよびBCP領域の配列決定
HBV DNAを50μLの血清から血液および組織ゲノムミニキット(VIOGENE、台北、台湾)により抽出した。 First-round PCRは以下の条件で行った。 96 oC 2分、94 oC 1分、54 oC 1分、72 oC 2分。プライマーは5′-ACCTCTGCACGTAGCATGG (forward) および 3′-GGATTAAAGACAGGTACAGTAGAAG (reverse) であった。 セカンドラウンドPCRは、プライマー5′-ATGTCAACGACCGACCTTGA(フォワード)および3′-TTCCCACCTTATGAGTCCAAG(リバース)を用いて同じ条件下で実施された。 精製したPCR産物は、自動DNAシーケンサーABI 310とABI PRISM Big Dye Terminator Cycle Sequencing Ready Reaction Kit(Applied Biosystems)を用いて、2ラウンド目のPCRで使用されたフォワードプライマーで直接配列決定された。 壊死性炎症と線維化は、それぞれKnodell necroinflammation grade(0から18の範囲)20とIshak fibrosis stage(0から6の範囲)21に基づいて評価した。
免疫組織化学染色は、他の場所で説明されているように行った22。 簡単に言うと、脱パラフィン処理した5μm厚の切片をモノクローナルマウス抗HBsAg(Clone 3E7, Dako Corp.、Carpinteria、USA)および抗HBcAg(Novocastra Laboratories, Newcastle, UK)とともに4℃で一晩インキュベートした。 抗HBsAgまたは抗HBcAgの最適希釈率は、陽性対照としてHBVキャリアーの肝組織を用いて決定した。 得られた免疫複合体の検出には、StrAviGen Super Sensitive MultiLink Kit (BioGenex) を使用した。 Peroxidase活性は,aminoethyl carbazole substrate kit (Zymed Laboratory, Inc, San Francisco, CA)で可視化した. 最後に、切片をヘマトキシリンで対比染色した。 陰性対照として、非免疫マウス免疫グロブリンをインキュベーションにおける一次抗体の代わりに使用した。 核、細胞質、あるいはその両方によるHBcAg発現のパターンを記録した。 HBsAg の発現パターンは、均一、タイプ I GGH、タイプ II GGH に分類された22。均一染色された肝細胞は、中程度から強い均一な細胞質染色を有する肝細胞として同定された。タイプ I GGH は、密集した球状または「包接様」染色を有する肝細胞として、タイプ II GGH は、細胞の縁または周辺に表面抗原染色を有する肝細胞として同定された6,22。 タイプIのGGHは肝小葉に単独または集合して散在し、タイプIIのGGHは結節に一貫して集合している。 HBcAgとHBsAgの発現レベルは、検査した肝細胞の0、1-10、11-25、25-50%、50%以上の陽性に対応する0-4+スケールで、免疫標識細胞の割合に応じて半定量的にスコア化した。 連続変数は、一変量解析のためにMann-Whitney U検定またはKruskal-Wallis ANOVAを使用して比較した。 カテゴリー変数は,χ2検定またはフィッシャーの正確検定を用いて解析した。 肝内HBsAg発現レベルに関連する独立因子は、多変量ロジスティック回帰分析を用いて実施した。 データ処理と統計解析はSPSS software for Windows, version 17.0 (SPSS Inc., Chicago, IL) を用いて行った。
結果登録患者の特徴
表1に登録患者181名の人口統計学的特徴を示す。 また,Precore A1896変異は20名(11.0%),BCP T1762/A1764変異は38名(21.0%)に検出された。 181名のうち,105名(58.0%)にHB-sAg陽性が検出された. HBsAg染色が認められた患者は,血清HBsAgが有意に高かった(P
181人の臨床的,ウイルス学的および組織学的特徴。
| 特徴 | 値 | |||||||
|---|---|---|---|---|---|---|---|---|
| HBsAg expression | P 値 | |||||||
| 全例(n = 181) | 陰性(n = 76) | 陽性(n = 105) | ||||||
| 年齢(歳)± SD | 36.4 ± 10.5 | 34.2 ± 9.2 | 38.0 ± 11.2 | 0.009 | ||||
| 性別(男/女) | 125/56 | 50/26 | 75/30 | 0.009 <1348> | 0.418 | |||
| 平均AST値(U/L)±SD | 59.7 ± 51.2 | 58.7 ± 42.5 | 60.5 ± 56.8 | 0.634 | ||||
| Mean ALT level (U/L) ± SD | 116.3 ± 124.2 | 120.2 ± 100.8 | 113.5 ± 139.1 | 0.282 | ||||
| HBV genotype (B/C) | 114/67 | 66/10 | 48/57 | 20/161 | 13/63 | 7/98 | 0.027 | |
| BCP:* mutant/wild | 38/143 | 12/64 | 26/79 | 0.144 | ||||
| HBV DNA (log copies/mL) | 8.4 ± 1.0.1 | 4.0 ± 0.7 | 4.3 ± 0.7 | |||||
| HBsAg level ((log IU/mL) | 4.2 ± 0.7.7 | 8.1 ± 1.0 | 8.6 ± 1.1 | 0.003 | ||||
| 平均Knotell necroinflammation grade ± SD | 5.0 ± 1.0 | 8.6 ± 1.0 | 5.0 ± 1.0 | 5.3 ± 2.8 | 4.7 ± 3.0 | 0.128 | ||
| Mean Ishak fibrosis stage ± SD | 1.8 ± 1.6 | 1.7 ± 1.2 | 1.9±1.7 | 0.8 ± 1.0 | ||||
Mutant, T1762 and A1764; wild, A1762 and T1764. χ2検定は性別、HBV遺伝子型、プレコアおよびバサルコアのプロモーター突然変異の変数に使用、その他の変数にはマン・ホイットニーU検定が使用されています。 AST:Aspartate aminotransferase。 ALT:alanine aminotransferase(アラニンアミノトランスフェラーゼ)。 BCP:basal core promoter。 HBV: hepatitis B virus.
HBsAg expressionの分布パターン
HBsAg expressionを示した105人の患者に関して、均一なパターン(図1A)が34人で検出された(32.4%)、I型GGH(図1B)が50例(47.6%)、II型GGH(図1C)が7例(6.7%)、混合型が14例(13.3%)で検出され、I型GGHとII型GGHが混在していることがわかった。 表2に示すように、II型GGHではBCP T1762/A1764変異が他のパターンに比べて多く検出された(P = 0.001)。 HBsAgの発現と血清ウイルス複製マーカーとの間には相互関係があった。 図1Dに示すように、II型GGH発現患者では、HBV DNA量とHBsAg力価は低いが、肝内HBsAg発現量は高かった(図1D)。 その上、II型GGHを示す肝組織では、肝壊死炎症と線維化活性が有意に高く、肝内HBsAg発現量も高かった(図1E)。
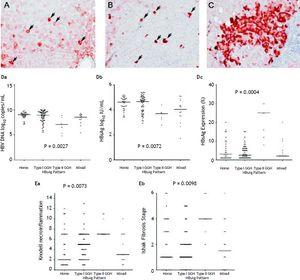
HBsAgの染色パターン。 A. 弱く染色された肝細胞の背景に、中程度から強い均質な細胞質のHBsAg染色された肝細胞(矢印)がいくつかある。 均一に染色された各肝細胞の核は、細胞の中心に位置していた。 B. 球状あるいは「包接様」HBsAg染色(矢印)が濃厚なI型ground glass hepatocyte(GGH)が肝実質内に散在していた。 C. II型GGHの一群は、細胞の縁あるいは周辺部にHBsAg染色を示した。 HBsAg発現パターンと血清HBV DNA量(Da),血清HBsAg量(Db),肝内HBsAg発現量(Dc)との相関. HBsAg発現パターンとKnodell necroinflammation grade(Ea)およびIshake fibrosis stage(Eb)の関連性。 群間の比較はKruskal-Wallis ANOVAで解析した。
HBsAg発現分布パターンによる人口動態の特徴。
| HBsAg パターン(n = 105) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 混合(n = 14) | 均質 | タイプII GGH | P値 | ||||||
| (n = 34) | (n = 50) | (n = 7) | |||||||
| 年齢(年)± SD | 36.3 ± 9.2 | 36.3 ± 10.0 | 39.2 ± 12.7 | 40.0 ± 7.9 | 0.104 | ||||
| 性別(男・女) | 11/3 | 26/11 | 35/15 | 6/1 | 0.720 | ||||
| 平均AST値(U/L)±SD | 64.9 ± 56.5 | 61.1 ± 38.6 | 49.9 ± 28.3 | 122.0 | 6.0 ± 1.5 | 6.0 ± 2.0 | 6.0 ± 2.0 | 6.0 ± 2.04 ± 168.7 | 0.474 |
| Mean ALT level (U/L) ± SD | 116.7 ± 112.4 | 114.6 ± 91.1 | 91.5 ± 63.8 | 259.1 ± 447.6 | 0.651 | ||||
| HBV genotype (B/C) | 10/4 | 15/19 | 22/28 | 1/6 | 0.085 | ||||
| Precore.B | HBV genotype (B/C) | 0/14 | 3/31 | 4/46 | 0/7 | 0.594 | |||
| BCP:* mutant/wild | 4/10 | 4/30 | 12/38 | 6/1 | 0.0.001 | ||||
| HBV DNA (log copies/mL) | 3.9 ± 1.0 | 4.5 ± 0.5 | 4.4 ± 0.7 | 3.6 ± 0.5 | 0.001 | ||||
| HBsAg level ((log IU/mL) | 8.2 ± 1.0 | HBsAg level ((log IU/mL) | 8.4 ± 0.7 | 3.6 ± 0.71 | 8.9 ± 0.7 | 8.7 ± 1.1 | 6.9 ± 1.5 | ||
| Knodell necroinflammation grade ± SD | 4.2 ± 2.9 | 4.2 ± 3.3 | 4.7 ± 2.7 | 8.6 ± 2.0 | 0.003 | ||||
| Ishak fibrosis stage ± SD | 1.9 ± 1.9 | 1.5 ± 1.3 | 4.1 ± 1.5 | 0.1 |
Mutant, T1762 and A1764; Wild, A1762 and T1764. χ2検定は性別、HBV遺伝子型、プレコアおよびベーサルコアのプロモーター変異を変数に、その他の変数はマン・ホイットニーU検定を用いている。 AST:Aspartate aminotransferase。 ALT:alanine aminotransferase(アラニンアミノトランスフェラーゼ)。 BCP:basal core promoter。 HBV: hepatitis B virus.
HBsAg expression level
図2A〜2Dは、HBsAg発現量の半定量測定の説明図である。 本研究では、HBsAg発現量スケール4+の患者は存在しなかった。 また、ウイルス増殖と肝組織像の間には相関が認められた。 HBsAg発現スケール2+/3+の患者は、HBsAg発現スケール1+でHBsAg染色が陰性の患者に比べ、HBsAg力価およびHBV DNAレベルは低かったが、壊死性炎症グレードおよび線維化ステージが有意に重かった(図2E)。 Knodell necroinflammation grade ≥ 5 scoreまたはIshake fibrosis stage ≥ 1を示した患者は、HBsAg発現率が有意に高かった(図3)。
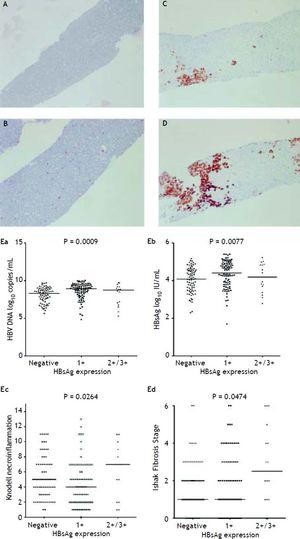
HBsAg発現は、免疫標識細胞の割合に応じて、0から3+のスケールで半定量的に測定され、検査した肝細胞の(A)0%(0)、(B)1-10%(C)11-25%(2+)、(D)25-50%(3+)の陽性に対応している。 HBsAg発現量と血清HBV DNA量(Ea)およびHBsAg量(Eb)、Knodell壊死性炎症グレード(Ec)およびIshak線維化ステージ(Ed)の相関。 群間比較はKruskal-Wallis ANOVAで解析した。

肝内HBsAgの発現とKnodell necroinflammation grade (A) および Ishak fibrosis stage (B) との相関。 群間比較はMann-Whitney U testで解析した。
HBsAg発現の臨床的特徴
まず、ウイルス性因子とHBcAg/HBsAg発現の関連について検討した。 HBcAg発現ではなくHBsAg発現はprecore変異がある場合、有意に低い値を示した(P=0.001)。 ジェノタイプCの患者は,より大きな肝線維化ステージを示した(P = 0.004). BCP T1762/A1764変異のある患者では,壊死性炎症グレードと線維化ステージが有意に高く,HBcAgの発現は細胞質でも核でも低かった. これらの観察結果はすべて、活発な肝損傷を示唆していた。 さらに、BCP T1762/A1764変異を持つ患者は、高い肝内HBsAg発現を示した(9.3 ± 8.0% vs 4.3 ± 5.0%, P = 0.008) (Table 3)。 さらに、HB-sAgの発現量と関連する可能性のある因子についても検討した。 表4では、HBsAg発現が2+/3+の患者が16人、1+の患者が89人であった。 単変量解析の結果、HBsAg発現量が2+/3+スケールであることは、BCP T1762/A1764変異や、より重度の肝壊死・線維化と関連していることがわかった。 多変量解析の結果、BCP T1762/A1764変異は肝内HBsAg発現2+/3+スケールと関連する独立因子であった。
ウイルス変異を有する/有さない患者の臨床的、ウイルス的、組織的特徴。
| プレコア変異 | P value | BCP mutations | P value | |||||
|---|---|---|---|---|---|---|---|---|
| No (n = 98) | Yes (n = 7) | No (n = 79) | Yes (n = 26) | |||||
| Age (yr)±SD | 37.0.8 ±11.0 | 40.0 ± 13.7 | 0.541 | 36.0 ± 10.6 | 43.8 ± 11.1 | 0.005 | ||
| 性別(男/女) | 70/28 | 5/2 | 1.000 | 54/25 | 21/5 | 0.005 0.318 | ||
| 平均AST値(U/L)±SD | 60.0 ± 58.3 | 71.3 ± 30.5 | 0.072 | 51.5 ± 32.1 | 87.3 ± 95.6 | 0.007 | ||
| Mean ALT level (U/L) ±SD | 112.2 ± 143.6 | 131.6 ± 39.1 | 0.031 | 98.2 ± 77.9 | 160.0 ± 242.1 | 0.007 | 98.2 ± 77.9 | 0.080 |
| HBV genotype (B/C) | 45/53 | 3/4 | 1.000 | 44/35 | 4/22 | |||
| Precore.B | HBV genotype (B/C) G1896/A1896 | 6/73 | 1/25 | 0.678 | ||||
| BCP:* mutant/wild | 25/73 | 1/6 | 1/6 | 1/6 | ||||
| HBV DNA (log copies/mL) | 3.9 ± 1.0 | 4.5 ± 0.0.5 | 0.959 | 4.5 ± 0.6 | 3.7 ± 0.6 | |||
| HBsAg level ((log IU/mL)) | 8.2 ± 1.1 | 8.9 ± 0.7 | 0.892 | 8.8 ± 0.9 | 7.7 ± 1.4 | 4.6 ± 3.0 | 6.6 ± 1.4 | 8.9 ± 0.5 | 7.7 ± 1.5 | 8.8 ± 1.5 | 0.142 | 3.9 ± 2.7 | 7.2 ± 2.7 |
| Ishak fibrosis stage ± SD | 1.8 ± 1.8 | 2.1 ± 0.9 | 0.1 ± 0.0 | 1.3 ± 1.4 | 3.4 ± 1.6 | |||
| HBcAg 細胞質発現 (%) | 53.6 ± 25.8 | 44.3 ± 30.5 | 0.402 | 56.3 ± 25.0 0.4 | 42.7 ± 25.8 | 0.018 | ||
| HBcAg nuclear expression (%) | 13.5 ± 17.3 | 17.6 ± 31.6 | 0.800 | 17.6 ± 20.0 | 2.3 ± 4.0.1 | |||
| HBsAg expression (%) | 5.8 ± 6.5 | 2.4 ± 1.5 | 0.274 | 4.3 ± 5.0 | 9.3 ± 8.0 | 0.3 ± 0.0003 | ||
Mutant, T1762 and A1764; wild, A1762 and T1764. χ2検定は性別、HBV遺伝子型、プレコアおよびベーサルコアのプロモーター突然変異の変数に使用、その他の変数にはマン・ホイットニーU検定が使用されています。 AST:Aspartate aminotransferase。 ALT:alanine aminotransferase(アラニンアミノトランスフェラーゼ)。 BCP:basal core promoter。 HBV: hepatitis B virus.
デモグラフィック特性とHBsAg発現度合いの関連性.
| 単変量 | 多変量 | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HBsAg expression, scale | 1+ (n = 89) | 2+/3+ (n = 16) | P value | Odds ratio (95% CI) | P value | ||||||||||||
| Age | 38.2 ±11.2 | 36.6 ±11.1 | 0.608 | 0.963 (0.903-1.026) | 0.242 | ||||||||||||
| 性別(男/女) | 63/26 | 12/4 | 1.000 | 1.026 (0.991〜1.) | AST level (U/L) | 55.0 ± 37.7 | 90.4 ± 113.2 | 0.234 | 1.026 (0.991〜1.) | 1.027 (0.991〜0.)063) | 0.142 | ||||||
| ALT level (U/L) | 103.3 ± 84.4 | 170.1 ± 297.2 | 0.386 | 0.991 (0.978∼1.1) | 0.392 (0.998∼1.2) | 0.992 (0.998∼1.0) | 0.992 (0.999∼1.1)005) | 0.216 | |||||||||
| HBV genotype (B/C) | 42/47 | 6/10 | 0.589 | 0.994 (0.234∼4.231) | 0.994(0.234∼1.005) | 0.589994 | |||||||||||
| Precore A1896変異(±) | 7/82 | 0/16 | 0.592 | 0.000 (0.000∼) | 0.000.999 | ||||||||||||
| BCP:*mutant/Wild | 17/72 | 9/7 | 0.003 | 6.356 (1.204∼33.356) | 0.356 (0.003) | 6.356 (0.003) | 0.356 (0.003)029 | ||||||||||
| HBsAg level (log10IU/mL) | 4.3 ± 0.7 | 4.2 ± 0.8 | 0.180 | 2.096 (0.598∼7.349) | 0.029 (1.0) | 0.096 (1.0) 0.029 (1.0)247 | |||||||||||
| Serum HBV DNA (log10 copies/mL) | 8.6 ± 1.1 | 8.1 ± 1.4 | 0.135 | 0.731 (0.386∼1.383) | 0.6 ± 1.399 | ||||||||||||
| Knodell necroinflammation grading | 4.4 ± 2.9 | 6.3 ± 3.3 | 0.027 | Ishak fibrosis stage | 1.0 | ||||||||||||
| Knodell necroinflammation grade | 4.4 ± 2.9 4.0 ± 2.0 | 6.0 ± 2.0 | 6.1 | 6.0 ± 2.07 ± 1.6 | 2.9 ± 2.1 | 0.041 | HBcAg 細胞質発現(%) | 53.0 | 52.3 ± 28.5 | 0.915 | 核発現量(%) | 14.4 ± 18.3 | 10.1 ± 0.3 | 10.1 ± 19.3 | 0.389 | ||
Mutant, T1762 and A1764; Wild, A1762 and T1764. 単変量解析:性別,HBV遺伝子型,プレコア,ベースコアプロモーター変異の変数にはχ2検定を,その他の変数にはMann-Whitney U検定を使用した。 多変量解析。 ロジスティック回帰分析:95%信頼区間およびP値を伴うOdds ratioで表した。 AST:アスパラギン酸アミノトランスフェラーゼ。 ALT:alanine aminotransferase(アラニンアミノトランスフェラーゼ)。 BCP:basal core promoter。 HBV: hepatitis B virus.
Discussion
肝内HBsAg発現は慢性B型肝炎の自然経過における異なる複製段階および疾患の進展と関連している7,10,23. 本研究では、II型GGHはより重症の肝組織学と関連し、血清HBV DNAレベルおよびHBsAg力価が有意に低く、肝内HBsAg発現レベルが比較的高いことが示された。 HB-sAgの発現パターンは、HBVの複製制御や肝細胞からの表面抗原の分泌障害に影響を及ぼすウイルス変異と関連していることが報告されている9,24。 この研究では、血清HBsAgとHBV DNAの相関をII型GGH患者の間で行った。 25 この研究では、血清 HBsAg と HBV DNA の相関を II 型 GGH の有無で調べたところ、この 2 つの HBV 複製指標には中程度の相関が見られた (r = 0.686, P 26,27) 。 28
HBsAgの発現パターンに加え、発現量が多いほど肝組織学的な活性が高く、BCP T1762/A1764変異の割合が高いことを見出した。 BCP T1762/A1764変異は,重度の肝組織学的活動や肝癌と強い相関がある29,30。 一方、BCP T1762/A1764変異はHBsAg発現量と強い相関が見られた。 ウイルス変異に関しては、BCP T1762/A1764変異は、pre-S欠失やBCP T1762/A1764変異の存在下で頻繁に起こる複合変異を含む他のHBV変異の基盤となる可能性がある。 複合型HBV変異体は、e、コア、表面タンパク質の発現と分泌に部分的または完全な欠損を示した31。B型肝炎表面抗原の分泌低下は、ERにおける表面タンパク質の異常な局在と相関し、HBsAgの高い発現を引き起こした。 また、BCP T1762/A1764変異は、宿主の免疫監視の淘汰圧のため、ウイルスの体力が低下した結果であると考えられている。 同様に、II型GGHに潜むpre-S2変異は、ヒト白血球抗原に制限されたT細胞およびB細胞のエピトープと一致する32。通常、II型GGHの周囲には細胞の壊死やTリンパ球の浸潤は見られないことから、pre-S2欠失変異が出現したHBVも新規エスケープ変異体である可能性が示唆されている33。 しかし、肝細胞への表面抗原の蓄積は、pre-SやSゲノム、表面プロモーターに既知のウイルス変異を持たずとも起こりうる。31,34 したがって、HBsAg発現はウイルス変異の有無に関係なく一連の流れとなりうる。 本研究での観察はレトロスペクティブな横断的デザインに基づくものであり、縦断的な追跡調査は行われていない。 肝細胞におけるHBsAgの発現レベルや組織学的重症度は、一人の患者の肝臓の様々な部位で異なる可能性がある。肝生検自体は、生検コア以外の肝臓組織を正確に表すことはできない。
以上のことから、II型GGHパターンまたは肝臓内HBsAg発現レベルが高い患者は、より重症の肝臓組織活性と低いHBV複製能に相互関係があることが示された。 肝内HBsAg発現とBCP T1762/A1764変異の強い関連性から,HBsAg発現は宿主免疫圧下でのHBVゲノム進化の過程での組織学的発現と見なすことができる可能性が示唆された。
GGH: ground glass hepatocyte.
HBcAg: hepatitis B core antigen.
HBeAg: hepatitis B e antigen.
はHBcAgのことで、HBc抗原はB型肝炎のコア抗原である。
HBsAg: hepatitis B surface antigen.
HBV: hepatitis B virus.
Conflicts of Interest
T.L.T. C.は、ギリアド・サイエンス、ブリストル・マイヤーズスクイブ・カンパニー、グラクソ・スミスクライン、メルク・シャープ&ドーム(アイ・エー)・コーポレーション、ファイザー・インクから研究資金を受け取っている。 残りの著者には利益相反はない
。