原子中のすべての電子は、4つの量子数によって一意に識別することができる。

その発見は高度な数学を必要としましたが、それらはすべて従来の数です:そのうちの3つは単純な整数値しか取れません;4番目は単純な分数です。
最初の3つの量子数は、シュレーディンガー方程式を解くことによって得られる波動関数Ψから生じます。
4番目の量子数である電子スピンは、電子には2つの可能な向きがあるという発見から生じたものである。
各数値とその定義は次の通りである。
量子数
| 量子数 | 名前 | 取りうる値 | 情報 |
|---|---|---|---|
| n | 主要な量子数 | 電子が占有するエネルギー殻を定義する。 nはマグネシウムのような電子配置で最初に書かれる数字です: 1s2 2s2 2p6 3s2 |
|
| l | 軌道角運動量量子数 (方位角量子数ともいう) |
0、1、2、…。…, (n-1) | エネルギー副殻を定義する-複数の電子を持つ系では、副殻は異なるエネルギーを持つ。lは電子配置における副殻の文字を定義する。 例えば 1s2 2s2 2p6 3s2 l=0はsサブシェル、 l=1はpサブシェル、 l=2はdサブシェル、など。 |
| ml | 磁気量子数 | -l, (l+1), …, 0, …・・・。 , (l+1), l | 副殻軌道の向きを定義する。 p副殻はl = 1で、3つのml値を持つ。 -これらは3つのp軌道、すなわちpx、py、pz軌道が存在することを示しています。 |
| ms | 電子スピン量子数 | -½ or +½ | 電子は2通りのスピン方向を持つ可能性があります。 |
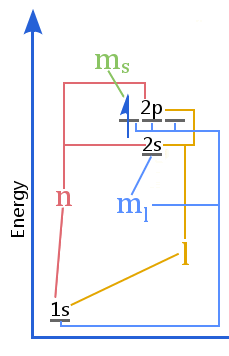
The relationship between quantum numbers and levels in an orbital energy level diagram
the energy level diagram shows the relation between quantum numbers vs the shell, subshells, orbitals and electron spin in an atom.
No electron in an atom has shared all four quantum numbers.If you have a spin orientation.
すべての電子はその量子数によって一意に識別できる。
軌道の形状は量子数によって与えられるのではなく、確率密度、つまり99%の確率で電子が見つかる原子核周辺の空間の3次元マップである。軌道の形は波動関数Ψ2の2乗から得られます。どの電子の正確な位置と運動量も知ることはできません。ハイゼンベルクの不確定性原理を参照してください。