結合の強さ。 共有結合
安定した分子が存在するのは、共有結合が原子を結びつけているからです。 共有結合の強さは、それを破るのに必要なエネルギー、つまり結合している原子を分離するのに必要なエネルギーで測ります。 結合している原子のペアを分離するにはエネルギーが必要で、結合が強いほど分離に必要なエネルギーは大きくなる。 気体分子1モル中の特定の共有結合を切断するのに必要なエネルギーは、結合エネルギーまたは結合解離エネルギーと呼ばれる。 2原子分子の結合エネルギーは、吸熱反応の標準エンタルピー変化量として定義される。
例えば、純粋な共有結合であるH-H結合の結合エネルギー、 \(\Delta_{H}) はH-H結合1モルあたり436kJで、
結合が切れると必ず分子にエネルギーを加えなければならない。
3個以上の原子を持つ分子には2個以上の結合がある。 このような分子のすべての結合エネルギーの合計は、分子内のすべての結合を切断する吸熱反応の標準エンタルピーの変化に等しくなる。 例えば、CH4の4つのC-H結合エネルギーの合計1660kJは、反応の標準エンタルピー変化に等しい:
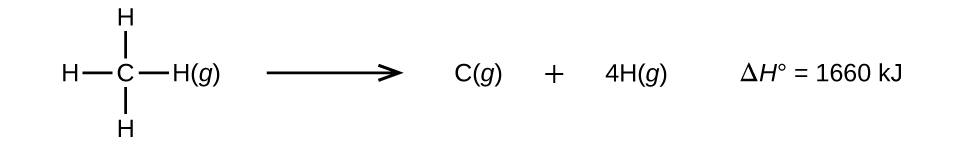
反応1モル当たり4モルのC-H結合が切れるので、平均C-H結合エネルギーは1660/4=415 kJ/molである。 4つのC-H結合は元の分子では等価ですが、それぞれ同じエネルギーを必要とするわけではなく、最初の結合が壊れると(439 kJ/mol必要)、残りの結合はより簡単に壊れるようになります。 415 kJ/molの値は平均値であり、1つの結合を切断するのに必要な正確な値ではない。
2つの原子間の結合の強さは、結合中の電子対の数が増加するにつれて増加する。 一般に、結合の強さが増すと、結合の長さは短くなる。 したがって、同じ2つの原子間では、三重結合は二重結合より強く、短いことがわかります。同様に、同じ2つの原子間では、二重結合は単結合より強く、短いことがわかります。 表 ⑭にいくつかの共通結合の平均結合エネルギー、表 ⑯にいくつかの共通結合の結合長と結合強度の比較を示す。 ある原子がグループ内の様々な原子と結合する場合、結合強度はグループの下に行くほど小さくなるのが一般的である。 例えば、C-Fは439 kJ/mol、C-Clは330 kJ/mol、C-Brは275 kJ/molです。
| Bond | Bond Energy | Bond Energy | Bond | Bond Energy | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| H-H | 436 | 260 | 255 | |||||||
| H-C | S | 436 | C | C | C | C415 | C-Cl | 330 | F-Br | 235 |
| H-N | 390 | C-Br | 275 | Si-Si230 | ||||||
| H-O | 464 | C-I | 240 | Si-P | 215 | |||||
| H-F | 569 | N-N | 160 | Si-S | 225 | |||||
| H-Si | 395 | (\mathrm{N=N}) | 418 | Si-Cl | 359 | |||||
| H-P | 320 | Item(\mathrm{N≡N}) | 946 | Si-Br | 290 | |||||
| H-S | 340 | N-O | 200Si-I | 215 | ||||||
| H-Cl | 432 | N-F | 270 | P-P | 215 | |||||
| H-Br | 370 | N-P | 210 | P-S | 230 | |||||
| H-I | 295 | N-Cl | 200 | P-Cl | 330 | |||||
| C-C | 345 | N-Br | 245 | P-Br | 270 | |||||
| \(\mathrm{C=C}) | 611 | O-O | 140 | P-I | 215 | |||||
| (\mathrm{C≡C}) | 837 | 498 | S・・ | 215 | ||||||
| C-N | 290 | O-F | 160 | S-Cl | 250 | |||||
| (\mathrm{C=N}) | 615 | O-Si | 370 | S-Br | 215 | |||||
| (\mathrm{C≡N}) | 891 | O-P | 350 | Cl-Cl | 243 | |||||
| C-O | 350 | O-Cl | 205 | Cl-Br | 220 | |||||
| (\mathrm{C=O}) | 741 | O-I | 200 | Cl-I | 210 | |||||
| (\mathrm{C≡O}) | 1080 | F-F | 160 | Br-Br | 190 | |||||
| C-F | F-Si | 540 | Br-I | 180 | ||||||
| C-Si | 360 | F-P | 489 | I-I | 150 | |||||
| C-P | 265 | F-S | 285 |
| Bond | Bond Length (Å) | Bond Energy (kJ/mol) |
|---|---|---|
| C-C | 1.C | 345 |
| That(\mathrm{C=C}) | 611 | |
| Filter(\mathrm{C≡C}) | 1.20 | 837 |
| C-N | 1.43 | 290 |
| 십(\mathrm{C=N} ) | 1.0 | 615 |
| Filter(\mathrm{C≡N}) | 1.16 | 891 |
| C-O | 1.43 | 350 |
| NT(\mathrm{C=O}) | 1.42 1.4223 | 741 |
| \(\mathrm{C≡O}) | 1080 |
結合のエンタルピーがない反応では、結合エネルギーで近似的にエンタルピー変化の計算ができる。 このタイプの計算はまた、反応が発熱性か吸熱性かを教えてくれる。
- 発熱反応 (ΔH 負、発生した熱) は、生成物の結合が反応物の結合より強いときに生じる。
- 吸熱反応 (ΔH 正、吸収した熱) は、生成物の結合が反応物の結合より弱いときに生じる。
化学反応のエンタルピー変化ΔHは、反応物のすべての結合を切断するのに必要なエネルギー(エネルギー「in」、正の符号)と生成物にすべての結合が形成されたときに放出されるエネルギー(エネルギー「out」、負の符号)の和にほぼ等しい。 これは数学的に次のように表現できる:
この式で、記号 \Sigma は「the sum of」を意味し、D は結合エネルギーをキロジュール/モルで表し、常に正の数である。 結合エネルギーは表から求めますが、その結合が単結合、二重結合、三重結合のいずれであるかによって異なります。 したがって、この方法でエンタルピーを計算する場合、すべての反応物、生成物の結合を考慮することが重要です。 D 値は通常、多くの異なる分子の 1 種類の結合の平均であるため、この計算は反応のエンタルピーについて正確な値ではなく、おおよその推定値を提供する。
次の反応を考えてみよう。 これらの結合を切るのに必要なエネルギーは、H-H結合の結合エネルギー(436kJ/mol)とCl-Cl結合の結合エネルギー(243kJ/mol)の合計である。 反応中、2モルのH-Cl結合が形成され(結合エネルギー=432 kJ/mol)、2×432 kJ; すなわち864 kJが放出される。 生成物の結合は反応物の結合より強いので、反応は消費するよりも多くのエネルギーを放出する:
-2D_{H-Cl}} {7367>&={-2(432)=-185}:kJ}
end {align*}
この過剰エネルギーは熱として放出するので反応は発熱性である。 表T2は、HCl(g)の標準モル生成エンタルピー, \(ΔH^circ_ce fttp), -92.307 kJ/molの値を示しています。 その2倍の値は-184.6kJであり、先に得られた2モルのHClの生成の答えとよく一致する。
Example ㊞(\PageIndex{1}): Using Bond Energies to Approximate Enthalpy Changes
メタノール(CH3OH)は優れた代替燃料となり得る。 水蒸気と炭素の高温反応により一酸化炭素(CO)と水素(H2)の混合ガスが生成され、そこからメタノールを製造することができる。 表中の結合エネルギーを用いて、この反応のエンタルピー変化ΔHを計算しなさい:
Solution
まず、反応物と生成物のルイス構造を書く必要がある:
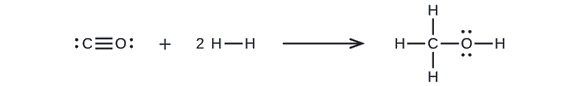
ここから、この反応のΔHは、C-O三重結合とH-H単結合を2つ壊すのに必要なエネルギーと、C-H単結合、C-O単結合、O-H単結合を3つ生成することによって生じるエネルギーが含まれていることがわかる。 これを(EQ3}式で)表すと、
-}
end {align*}]
表の結合エネルギー値を使って、
&=ce{-107}
EQ2}EQ3}EQ4}EQ5>EQ5>EQ5>EQ3>EQ3>EQ5>EQ6>-end {align*}
この値を付録Gのデータから算出した値と比較する:
end {align*}}
2種類の方法で計算した値の間にはかなり大きな開きがあることに注意してください。 これは、D値が異なる結合強度の平均値であるため、他のデータと大まかにしか一致しないことが多いためです。
練習問題 \(PageIndex{1})
エチルアルコール(CH3CH2OH)は人間が意図して合成した最初の有機化学物質の1つである。 工業的な用途も多く、アルコール飲料に含まれるアルコールもエチルアルコールである。 砂糖の発酵によって得られるか、または以下の反応でエチレンの水和によって合成されます:

表中の結合エネルギーを用いて、この反応のエンタルピー変化ΔHを近似的に計算しなさい。
Summary
Video \(\PageIndex{2}}): 原子結合の復習。
共有結合は、電子が原子間で共有され、両方の原子の原子核に引き寄せられることによって形成されます。 純粋な共有結合では、電子は等しく共有される。 極性共有結合では、一方の原子が他方の原子より強く電子を引きつけるので、電子は不均等に共有される。
共有結合の強さは、その結合解離エネルギー、つまり分子のモルでその特定の結合を壊すのに要するエネルギー量によって測定される。 同じ原子間でも単結合より多重結合の方が強い。 反応のエンタルピーは、結合を切断するのに必要なエネルギー入力と、新しい結合が形成されたときに放出されるエネルギーに基づいて推定することができる。
Key Equations
- 2原子分子の結合エネルギー。 \(\ce{XY}(g)⟶\ce{X}(g)+\ce{Y}(g)\hspace{20px}\ce{D_{X–Y}}=ΔH°\)
- Enthalpy change: ΔH = ƩDbonds broken – ƩDbonds formed
Footnotes
- この問題は化学高等課程試験から取られ、教育テストサービスの許可の下で使用されています。
用語集
結合エネルギー(結合解離エネルギーとも)気体中の共有結合を切断するのに要するエネルギー
投稿者
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F.). Austin State University)と寄稿者です。 OpenStax Collegeが制作した教科書のコンテンツは、Creative Commons Attribution License 4.0ライセンスの下で提供されています。 ダウンロードはhttp://cnx.org/contents/85abf193-2bd…[email protected])
- Fuse School, Open Educational Resource free of charge, under a Creative Commons License: Attribution-NonCommercial CC BY-NC (View License Deed: https://creativecommons.org/licenses/by-nc/4.0/)
- Crash Course Chemistry (クラッシュ コース ケミストリー)。 Crash CourseはComplexlyの一部門であり、ビデオは教育目的のために自由にストリーミングできます。
Adelaide Clark, Oregon Institute of Technology
Feedback
このテキストについてフィードバックをお持ちですか? ここをクリックしてください。
Find a typo and want extra credit? ここをクリック