Introduction
髄膜腫は最も多い中枢神経系(CNS)原発新生物で、すべての原発脳腫瘍の37%以上を占めている(1)。 髄膜腫の管理オプションには、観察、手術、および放射線療法が含まれる(2、3)。 髄膜腫の中には世界保健機関(WHO)悪性度IIおよびIIIを含む侵攻性のものが少数ありますが、80%以上はWHO悪性度Iであり、しばしば「良性」と呼ばれます(4)。 しかし、WHOグレードIの髄膜腫でさえも再発することがあり、過去の研究では長期間の追跡で最大47%の再発率が強調されています(4、5)。 髄膜腫の再発は、しばしば追加手術や救済的な放射線治療を必要とし、潜在的な病的状態につながります(6、7)。
切除時に達成されたシンプソングレードに加えて、多くの腫瘍特性が病理組織学的所見に焦点を当てた再発の予測因子として評価されている(8)。 これらには,MIB-1指数(細胞増殖のマーカー),脳浸潤,および細胞数の増加,シーティング,自然壊死の病巣,核異型などの非定型的な組織学的特徴の存在がある(9-13)。 実際、2016年のWHO分類では、腫瘍の悪性度を決定するために病理所見のみが用いられ、悪性度IIは脳浸潤と4/10高出力視野(HPF)以上の有糸分裂増加によって定義されています(4)。 また、3つの非定型的な特徴を合わせると、腫瘍のグレードが上昇します(4)。 将来的には、髄膜腫の分子的特徴は最近、再発リスクと関連しており、将来的に髄膜腫の等級付けに使用される可能性が高い(14-16)。
WHOの分類は、腫瘍等級間の明確な区分を作成するために利用できる文献を総合しているが、WHO等級I髄膜腫再発に関する文献は依然として混合している。 例えば、脳浸潤は単独でWHO悪性度I-IIから腫瘍悪性度の上昇をもたらすが、その後の多くの研究では脳浸潤と再発の関係は見つかっておらず、再発の予測因子に関するさらなる研究の必要性が強調されている(10、17、18)。 髄膜腫の再発予測におけるMIB-1指数の有用性についても議論がある。WHO悪性度Iの髄膜腫における研究では、MIB-1指数>3%で再発リスクが高いことだけが示唆されたが、すべてのWHO悪性度を含む他の文献では>5%または>10%で再発の発生率が高いことが示されている(9-11)。 また、以前の研究では、シンプソンIIまたはIII切除の患者においてのみ、>3%のMIB-1カットオフを提案しており、MIB-1カットオフとその使用法が多様であることがさらに示されている(13)。 それに比べ、WHOグレードI髄膜腫の再発における非定型的特徴の影響を調査した研究は限られている;しかしながら、病理学的解析で非定型的特徴を示すWHOグレードI腫瘍の再発リスクが高いことを示唆している(9)。 WHOグレードIの髄膜腫におけるMIB-1の使用に関するコンセンサスがないため、我々はまた、MIB-1インデックスの臨床的に適切なカットオフを特定するために再帰的分割分析を利用する。 その後、WHOグレードI腫瘍における早期および中期以降の再発の予測因子を特定する。
Methods
患者集団
2007年から2017年にWHOグレードI髄膜腫の治療を受けた患者を、施設のデータベースを使ってレトロスペクティブに特定した。 本研究は,カリフォルニア大学サンフランシスコ校の施設審査委員会(IRB#13-12587)により正式に承認された。 電子カルテでMIB-1指標値が利用できない患者は除外した。 研究期間の初期には、MIB-1は主治医の神経病理学者の裁量で取得されたが、時間の経過とともに、すべてのWHOグレードIの髄膜腫患者についてMIB-1を取得した。
臨床データ
患者の人口統計学、臨床、および治療特性、病理組織学データ、および臨床結果が、レトロスペクティブレビューされて集められた。 収集した臨床データには、患者の年齢、性別、治療時のカルノフスキーパフォーマンスステータス(KPS)、臨床症状、髄膜腫治療の既往歴が含まれる。 病理組織学的データには、MIB-1指標、シート状/構造喪失、細胞数増加、壊死、核異型度、骨浸潤の有無が含まれた。 プロゲステロン受容体(PR)、上皮膜抗原(EMA)、CD34、S100、グリア線維性、酸性タンパク質(GFAP)染色結果は、入手可能な場合に収集された。 病理学的データは、外科的介入時に作成された病理報告書から抽出した。 腫瘍の位置、大きさ、および術前の腫瘍周囲の浮腫の有無は、術前のMRI画像を用いて決定した。 前方-後方(AP)、上方-下方(SI)、横方向(TV)の直径が収集された。 術前腫瘍体積は非球形腫瘍体積の方程式を用いて算出した。 治療の種類も同様に収集した。 Simpson gradeは手術報告書により決定した。 Gross total(GTR)とSubtotal resection(STR)は、術後の磁気共鳴画像(MRI)スキャンを使用して決定した。 再発は、術後のX線写真で局所再発または残存腫瘍の進行として判断した。 再発までの期間は、患者の治療日から決定した。 フォローアップ期間は、治療日から脳神経外科クリニックの最終診察日までとした。 副次的アウトカムには、早期再発と中央部以降の再発が含まれた。 早期再発は、初回治療から2年以内と定義した(19)。 4340>
統計解析
カテゴリー変数と連続変数の比較には、それぞれカイ二乗とスチューデントのt検定が利用された。 単変量解析でp<7306>0.200の変数を用いて、再発の多変量逆尤度Cox回帰モデルが構築された。 同様に、一変量解析でp < 0.200の変数を用いて、早期および中央値後の再発を予測する多変量後方尤度バイナリロジスティックモデルが構築された。 再帰的分割分析(RPA)を使用して、全体、早期、および中央値後の髄膜腫再発の主要なリスク因子をさらに特定した。 p < 0.050が統計的有意性の閾値として用いられた。 すべての統計分析はSPSS 26で行った。
Results
Overall Patient Demographics and Clinical Outcomes
全体の患者の人口統計学、病理組織学的特徴、および臨床結果は表1に見ることができます。 合計で、WHOグレードIの髄膜腫患者239人がこの研究に組み入れられた。 平均年齢は60.0歳で、患者の69.5%が女性であった。 最も一般的な提示症状は頭痛(30.5%)で、次いで局所的な神経学的欠損(27.6%)であった。 手術単独が98.3%と最も多く、放射線療法(0.8%)、ガンマナイフ(0.8%)の補助治療が各2例であった。 術前MRIで腫瘍周囲の浮腫を認めた患者は38.1%であった。 計算上の平均腫瘍体積は30.6cm3(範囲=0.23-215.73cm3)、平均最大腫瘍寸法は3.8cm(範囲=0.6-11.3cm)であった。 全体として、91 (38.1%) の腫瘍は頭蓋底に位置し、57 (23.8%) は凸部腫瘍、43 (18.0%) は鎌状/傍矢状位置、55 (23.0%) はその他の位置であった。 ほとんどの患者は肉眼的全切除を受けた(63.6%)。 Simpson I、II、III、IV切除の発生率はそれぞれ31.4、29.7、2.5、35.6%であった。 非典型的特徴は多くの患者に認められ、最も一般的な非典型的特徴は、骨浸潤(18.0%)およびsheeting/loss of architecture(8.4%)であった。 平均追跡期間は41.1カ月(範囲:0~147カ月)
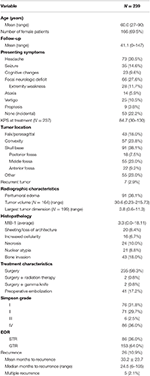
Table 1. 患者特性、病理組織学的特徴、X線撮影、および転帰。
Predictors of WHO Grade I Meningioma Recurrence
合計26人が再発し、再発までの期間の中央値は24.5カ月であった(表1)。 再発した患者とそうでない患者の比較は表2にある。 腫瘍が再発した患者と再発しなかった患者の間には、年齢(60.2 vs. 58.8, p = 0.582)、女性の性別(61.5 vs. 70.4%, p = 0.353)の差はなかった。 治療特性は各群で類似しており、各群のほとんどの患者が手術のみを受けた(100.0 vs. 98.1%, p = 1.000)。 しかし、再発腫瘍の患者では、STRの発生率が高く(61.5 vs. 32.7%, p = 0.004)、Simpson grade I切除の発生率は低かった(11.5 vs. 34.1%, p = 0.019)。 腫瘍周囲の浮腫の発生率、腫瘍の大きさ、腫瘍体積は両群間で同様であった。 病理組織学的解析では、再発した患者は核異型度が増加する傾向があった(19.2 vs. 7.5%、p = 0.061)。 また,再発した患者は平均追跡期間が長かった(68.9カ月対37.7カ月,p=0.001)。
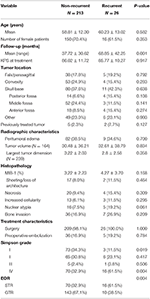
Table 2. 再発髄膜腫患者 vs 非再発髄膜腫患者の比較。
その後の逆尤度Cox-回帰分析では、再発と後窩腫瘍位置との独立した関係が強調された(HR = 5.25, CI 1.71-16.17, p = 0.004),MIB-1 index(HR = 1.18, CI 1.05-1.34, p = 0.008),Nuclear atypia(HR = 5.24, CI 1.73-15.92, p = 0.003),STR(HR = 5.66, CI 1.30-13.92, p < 0.001; 表3)の独立関係が浮き彫りになった。 後頭蓋窩の位置(p=0.007),核異型度(p=0.137),切除範囲(p=0.001),MIB-1<9591>4.5%(p=0.001)についての無再発生存率を強調するカプラン・マイヤー曲線を図1A~Dに示す。 再発のCox回帰分析。

Figure 1.再発のCox回帰分析。 WHOグレードI髄膜腫の再発の危険因子のKaplan Meier曲線。 (A)核異型度(青線)対核異型度なし(赤線)(X2 = 2.21, p = 0.137)。 (B)後窩腫瘍の位置(青線) vs その他の位置(赤線)(X2 = 10.36、p = 0.001)。 (C)MIB-1指数<9591>4.5%(青線) vs ≦4.5%(赤線)(X2 = 6.17, p = 0.013)。 (D) STR (青線) vs. GTR (赤線) (X2 = 10.46, p = 0.001).
Predictors of Early vs. Post-median WHO Grade I Meningioma Recurrence
Non Recurrent patients and patients with tumors that recurred early or post-median between a comparison is shown in Table 4.A. 早期再発の患者では亜全切除の発生率が高かった(76.9 vs. 32.7%、p = 0.001)。 また、病理組織学的に核異型度(23.1 vs. 7.5%, p = 0.084)が高い傾向にあった(Table 4)。 中央部以降に再発した患者では、後頭蓋窩腫瘍の位置が高く(23.1 vs 6.6%, p = 0.063)、骨浸潤が高い(38.5 vs 16.9%, p = 0.064 )、また MIB-1 index が高い (5.55 vs. 3.22%, p = 0.098)傾向がみられた。 中央部以降に再発した患者と非再発の患者では、Simpson gradingやGTR率に有意差はなかった(表4)。
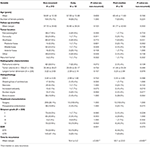
Table 4. 早期対中央値後の再発。
早期対中央値後の再発の予測因子を特定するために、2つの多変量後方尤度バイナリロジスティックモデルを使用した(表5)。 早期腫瘍再発の独立した予測因子には、病理組織学上の核異型度(OR = 6.45, CI 1.34-31.07, p = 0.020) およびSTR(OR = 8.92, CI 2.18-36.46, p = 0.002) が含まれていた。 中央部以降の再発の唯一の独立した予測因子はMIB-1指数(OR = 1.24, CI 1.05-1.45, p = 0.010)だったが、後窩の位置は有意に近づいた(OR = 4.42, CI 0.954-20.49, p = 0.058; 表5)。 中央部以降と早期の腫瘍再発の2値ロジスティックモデル。
Recursive Partitioning Analysis of Recurrence
RPA は髄膜腫再発の主要な危険因子を特定するために行った(図2参照)。 cox-回帰分析と一致し、STRは全再発を予測する際の最初のパーティションであった。 STR切除を受けた患者の18.6%が再発したのに対し、GTR切除を受けた患者では6.5%であった。 MIB-1>4.5%の患者の18.8%が再発したのに対し、MIB-1≤4.5%の患者の3.3%であった(図2A)。 特に中央部以降の再発に関しては、RPAはMIB-1のカットオフを5.83%として最初の判定節を特定した。 MIB-1<9591>5.83%の患者の22.2%が再発したのに対し、MIB-1≦5.83%の患者の3.3%が再発した。 その後の判定ノードでは、後頭蓋窩の腫瘍位置が利用された。 後頭蓋窩腫瘍の13.3%が再発したのに対し、他の部位では2.5%であった(図2B)。 早期再発のRPAでは、一次判定ノードとして切除範囲が特定された。 STR患者の11.6%が再発したのに対し、GTR患者の2.0%が再発した。 次の判断材料は鎌状部または傍矢状部であった。 図2C)。
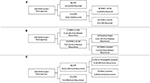
Figure 2.STR、GTR、Parasagittal、Parasagittalの3つの腫瘍の再発率。 (A)全再発、(B)中央部以降の再発、(C)早期再発の主要リスク因子を強調する再帰的分割分析
考察
Key Results
WHOグレードI髄膜腫再発はMIB-1指数、後窩腫瘍位置、核異型度の存在、STRと独立して関連しています。 より具体的には、4.5%のMIB-1指数は、GTR後のWHOグレードI髄膜腫患者のリスク層別化において臨床的に適切なカットオフ値として同定された。 MIB-1指数が4.5%未満でWHOグレードIの髄膜腫のGTRを行った患者は、STRを行った患者と同等の再発リスクを有していました。 4340>
Predictors of WHO Grade I Meningioma Recurrence
Previous studies have similarly assessed between histopathological features, clinical characteristics, and recurrence in all meningioma WHO grades.これまでの研究では、すべての髄膜腫WHOグレードにおいて、病理組織学的特徴、臨床的特徴、再発の関係を同様に評価している。 901人の患者(716人のWHOグレードI、174人のグレードII、および11人のグレードIII)の研究において、Gousias et al. は、MIB-1指数が<9591>10%、WHO悪性度が高い、腫瘍サイズが<9591>6cm、腹壁または海綿状洞の位置、および多発性の髄膜腫で再発のリスクが高いことを示している(11)。 しかしながら、Gousias elseは組織学上の非定型的特徴の存在と腫瘍の再発との関係を評価していない。 特にWHOグレードIの髄膜腫では、Marciscanoらは完全な病理学的解析を行ったWHOグレードIの髄膜腫患者148人のコホートを利用して、再発リスクに対する非定型病理的特徴の影響に焦点を当て、再発に関連する変数を特定した(9)。 興味深いことに、彼らはMIB-1 index >3%およびSimpson resectionに加えて、非定型的特徴の存在を独立したリスク因子として同定している。 我々の研究でも同様に、外科的GTRと非定型的特徴の一つである核異型度を独立した再発予測因子として強調している(表3)が、我々はそれぞれの非定型的特徴を独立して評価している。 我々は、Cox-回帰モデルにおいて腫瘍の位置も考慮し、さらに腫瘍の後窩の位置を再発の独立した危険因子として同定している。 Marciscanoらは進行予測因子の分析に腫瘍の位置を含めなかったが、Gousiasらは同様に、すべてのWHO髄膜腫グレードを考慮した場合ではあるが、腫瘍の位置が再発の危険因子として石灰化したことを示している(9、11)。 後頭蓋窩の位置に関連する高い再発リスクは、後頭蓋窩におけるNF2突然変異の有病率の増加によるものかもしれない(14、15、20)が、我々の施設では髄膜腫の遺伝子検査を日常的に行っていないため、これを十分に調査することはできない。 4340>
MIB-1インデックスとWHOグレードI髄膜腫の再発
先行研究(9、11、13、21)と同様に、腫瘍のMIB-1インデックスとその再発リスクの関係も評価しました。 まず、先に述べたように全再発のCox-regressionモデルでMIB-1 indexを評価した。 これまでの研究と一致し、MIB-1 indexが高いほど、全体的な再発リスクの上昇と独立して関連していることがわかった。 MIB-1のカットオフ値は文献と研究室間のばらつきがあるため、我々はまずMIB-1を連続変数として評価した。 次に、RPAを使用して全体の再発をモデル化することにより、我々の患者集団におけるMIB-1インデックスのカットオフ値を決定しようとしたところ、GTR患者におけるMIB-1のカットオフ値は4.5%と判明しました(図2A)。 興味深いことに、これらの患者の再発リスクはSTRの患者と同程度であり、GTR後の患者におけるMIB-1の有用性が示された。 GTRおよびMIB-1 >4.5%の患者における18.8%の再発率は、これらの患者の綿密なサーベイランス、あるいは患者の希望に応じて補助放射線療法を考慮する必要性を強調している。 WHOグレードIの髄膜腫に対する切除後の補助放射線療法は、特にSTR後の再発を減少させることが示されているが(23-25)、STR後の観察は依然として標準的な治療法である(8)。 SoyuerらはWHO悪性度Iの髄膜腫92例の研究で、STR後に補助放射線療法を受けた患者の無増悪生存率(PFS)は91%で、補助放射線療法を受けなかった患者のPFS38%より有意に高いことを示した(24)。 本研究のSTR患者は、GTRとMIB-1>4.5%の患者と同等の再発リスクを有していたため、両群に対するアジュバント放射線療法は妥当であると思われる。 しかし、我々のMIB-1カットオフと関連する臨床的意味をさらに検証するために、より大規模な研究が必要である。 WHOグレードI髄膜腫における補助放射線療法の使用を調査する前向き研究も必要である。
Predictors of Early and Post-median WHO Grade I Meningioma Recurrence
MIB >4.5% が高い患者の再発が遅い傾向を考えると、MIB >4.5%(図1C)であったことから、早期再発(治療後2年以内と定義)または中央値以降(治療後2年未満で9591再発した人)の患者間の予測因子の違いを調査することを目指した。 髄膜腫の早期再発の予測因子について調査した研究は文献上ほとんどない。 Budohoskiらによる研究では、220人の非定型髄膜腫のコホートにおいて早期再発の予測因子としてパラファルシン位置、STR、およびX線画像上の腫瘍周囲の浮腫が同定されている(26)。 WHOグレードIの髄膜腫におけるMailloらによる同様の研究では、早期再発(治療後2.5年と定義)の危険因子を同定するために間期蛍光in situハイブリダイゼーション(FISH)と病理的特徴を利用し、腫瘍サイズの増大、核型異常、患者年齢および10番染色体の異常は再発のリスク増大と関連するとした(19)。 しかし、著者らは病理検査での異型度の有無やMIB-1指標は考慮していない。 病理学的および臨床的データがより詳細なWHOグレードIの髄膜腫患者のコホートを用いて、二元ロジスティック回帰モデリングにより、切除範囲と病理上の核異型度を早期再発の独立した予測因子として同定した(表5)。 RPAでも同様に、早期再発のリスク層別化において切除範囲の重要性が明らかになった(図2C)。 興味深いことに、Budohoskiら(26)の知見と同様に、鎌状/傍矢状腫瘍の位置に関連するリスクの増加も強調された。 二元ロジスティック回帰モデリングで中央部以降の腫瘍再発の唯一の有意な予測因子はMIB-1指数であったが、腫瘍の後窩の位置は有意に近づいた。 このことは、RPAでさらに実証された(図2B)。 驚くべきことに、切除範囲は中央部以降の再発の独立した予測因子ではなく、中央部以降の再発の大部分はGTRを受けたものであった。 中央部以降の再発は、MIB-1指標の上昇と後窩の位置から、分子生物学的に侵攻性が高く、GTRを行っても再発するWHOグレードI髄膜腫のカテゴリーを強調しているのかもしれない。 早期再発は切除範囲に大きく影響され、その結果、中央部以降の再発に見られるような、以前に完全に切除された腫瘍の再発とは対照的に、残存腫瘍の継続的な増殖を示すと思われる。 したがって、今回の結果は、2つの異なる分子的WHOグレードI髄膜腫サブタイプを示す可能性がある。 しかし、早期再発と中央部以後の再発の分子変化の根本的な違いをさらに調査するために、より大規模な患者コホートと分子腫瘍データを用いた今後の研究が必要である。 また、本研究は2007年から始まった患者を含み、その結果、2007年と2016年のWHO CNS分類スキームの両方にまたがっている。 しかし、2つの分類の間の唯一の重要な変更は、WHOグレードII状態の単独の基準として脳浸潤が追加されたことである。 我々のコホートに含まれる患者のうち、病理学的分析で脳浸潤が認められたのは2例のみであり、いずれの患者も再発しなかった。 その結果、2007年版の分類を用いた患者を組み入れたことは、我々の結果に大きな影響を及ぼさなかったと考えられる。 さらに、本研究では、病理スライドの中央再レビューを行わず、初回切除後の病理報告書に依存している。 このことは、観察者間のばらつきを示す核異型度や他の類似の病理所見などの病理学的変数のばらつきの増加につながる可能性がある(27、28)。 しかし、MIB-1は比較的客観的な指標であり、同じ病理検査室内で同じ方法を用いる病理医間の観察者間変動は小さい(29)。 MIB-1検査に関する実施形態も、病理医によって異なる個々の病理医の好みから、全患者を対象とした検査へと、調査期間中に変化している。 病理医がMIB-1検査の実施を決定する際に考慮した要因には、本研究に含まれる非典型的な特徴が含まれており、その結果、我々の所見に対する潜在的な影響を最小限にすることができた。 さらに、本研究に含まれる髄膜腫はすべてWHOグレードIである。その結果、これらの診療パターンの変化に基づき本研究にもたらされるバイアスは最小限であると考えられる。 最後に、我々は詳細な臨床的および病理学的特徴を含んでいるが、我々の患者コホートには腫瘍の転帰に重大な影響を与えることが示されている腫瘍の遺伝子および分子の変化に関する情報が欠けている(15、30-32)。 したがって、WHOグレードI髄膜腫の全再発を予測する場合、従来の病理学的および臨床的変数に加えて、分子/遺伝学的データを用いた大規模多施設共同研究をさらに行う必要性が残っている。 これには、ゲノム全体のメチル化パターン(33、34)、TERTプロモーター変異(35)、および追加の腫瘍分子データなどの分子/遺伝学的予後予測因子の考察が含まれる。
にもかかわらず、我々の研究は、特にWHOグレードIの髄膜腫における再発の臨床的および病理組織学的予測因子に関する詳細な洞察を提供するものである。 さらに、MIB-1 >4.5%の患者をGTR後の再発リスクが高い患者として同定した。 さらに、このデータを活用して、WHOグレードI髄膜腫の早期再発と中期以降の再発の違いに関する洞察を提供し、異なるWHOグレードI髄膜腫の分子サブグループを特定する可能性があります。 我々の結果は、病理学的解析でMIB-1指数が高く、核異型度が高く、腫瘍の位置が後窩洞で、STRを有する患者は、再発のリスクが高く、より詳細なフォローアップ、あるいは補助放射線治療を考慮すべきことを示唆する。 さらに、MIB-1が4.5%以上の患者は、腫瘍のSTRを受けた患者と同様の再発リスクを有し、また潜在的に補助放射線療法を考慮すべきである<4340> <9237> 結論<7758> WHOグレードI髄膜腫の再発の特定の予測因子に関する文献は依然として少ない。 本研究の知見は、グレードIの髄膜腫の再発と独立して関連するものとして、後窩腫瘍の位置、MIB-1指数、核異型度、および切除の範囲を強調するものである。 また、MIB-1 >4.5% およびGTRを有する患者はSTRを有する患者と同等の再発リスクを有することが示された。 最後に、早期および中央部以降の再発の差分解析により、中央部以降の再発ではMIB-1指数と後窩の位置との関連が明らかになったが、早期再発では切除範囲の影響がより顕著であった。 WHOグレードI髄膜腫の再発の追加予測因子を同定するために、我々の知見を検証し、分子/遺伝子データを含む追加研究が必要である。
Data Availability Statement
本論文の結論を裏付ける生データは、著者により不当な予約なしに利用可能となる。
Ethics Statement
ヒト参加者を含む研究はUCSF施設審査委員会によって審査・承認されている。
Author Contributions
AH: Conceptization, methodology, formal analysis, investigation, writing-original draft, writing-review and editing, and visualization.本調査は、国内法および施設の要求に従い、書面による参加同意は必要ないものとした。 JY:概念化、方法論、執筆-レビューと編集。 IKとSSは調査。 J-SC:可視化、形式分析。 DRとMM:ライティング・レビューと編集。 SM:レビューと編集、コンセプト作り、方法論。 MA:執筆・校閲・編集・監修。 著者全員が論文に貢献し、投稿版を承認した。
Conflict of Interest
著者らは、潜在的な利益相反と解釈できる商業的または金銭的関係がない状態で研究が行われたことを宣言した。
レビューアBBは著者DR、MM、SMとの過去の共著を取り扱い編集者に申告した。
1. Ostrom QT, Cioffi G, Gittleman H, Patil N, Waite K, Kruchko C, et al. CBTRUS統計報告:2012-2016年に米国で診断された原発脳およびその他の中枢神経系腫瘍.CBTRUS統計報告. Neuro Oncol. (2019) 21:v1-100. doi: 10.1093/neuonc/noz150
PubMed Abstract | CrossRef Full Text | Google Scholar
2.この論文では、CBTRUSの統計報告として、2012年から2016年にかけて米国で診断された原発性脳腫瘍、その他の中枢神経系腫瘍を紹介します。 Karsy M, Guan J, Cohen A, Colman H, Jensen RL. 髄膜腫の内科的管理。 髄膜腫の医学的管理。現状、失敗した治療法、および有望な展望。 Neurosurg Clin N Am. (2016) 27:249-60. doi: 10.1016/j.nec.2015.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Brastianos PK, Galanis E, Butowski N, Chan JW, Dunn IF, Goldbrunner R, et al. Advances in multidisciplinary therapy for meningiomas. Neuro Oncol. (2019) 21:I18-31. doi: 10.1093/neuonc/noy136
PubMed Abstract | CrossRef Full Text | Google Scholar
4.本論文では、髄膜腫に対する集学的治療の進歩について述べる。 Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. 2016 World Health Organization classification of tumors of the central nervous system: a summary(中枢神経系の腫瘍に関する2016年世界保健機関分類:要約). Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar
5.日本における中枢神経系腫瘍の分類は、以下の通りである。 Pettersson-Segerlind J, Orrego A, Lönn S, Mathiesen T. 手術で治療した傍矢状髄膜腫の長期25年フォローアップ。 World Neurosurg. (2011) 76:564-71. doi: 10.1016/j.wneu.2011.05.015
PubMed Abstract | CrossRef Full Text | Google Scholar
6.手術で治療した傍矢状髄膜腫の長期25年追跡調査。 Van Alkemade H, De Leau M, Dieleman EMT, Kardaun JWPF, Van Os R, Vandertop WP, et al. 良性髄膜腫の生存障害と長期神経学的問題. Neuro Oncol. (2012) 14:658-66. doi: 10.1093/neuonc/nos013
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Buerki RA, Horbinski CM, Kruser T, Horowitz PM, James CD, Lukas RV.は、Buerki RA、Horbinski CM、 Kruser、PM、James CD、Lukas RV.を含む。 髄膜腫の概要。 Futur Oncol. (2018) 14:2161-77. doi: 10.2217/fon-2018-0006
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Rogers L, Barani I, Chamberlain M, Kaley TJ, McDermott M, Raizer J, et al.髄膜腫:知識ベース、治療成果、および不確実性。 RANOのレビュー。 J Neurosurg. (2015) 122:4-23. doi: 10.3171/2014.7.JNS131644
PubMed Abstract | CrossRef Full Text | Google Scholar
9.邦訳:「髄膜腫:治療成績の知識ベース、不確実性。 Marciscano AE, Stemmer-Rachamimov AO, Niemierko A, Larvie M, Curry WT, Barker FG, et al. 非定型の組織的特徴を有する良性髄膜腫(WHOグレードI):組織学的特徴と臨床転帰の相関性。 J Neurosurg. (2016) 124:106-14. doi: 10.3171/2015.1.JNS142228
PubMed Abstract | CrossRef Full Text | Google Scholar
10.邦訳:「良性髄膜腫のWHOグレードIの病理組織学的特徴と臨床転帰の相関」(日本神経学会雑誌)(2009年11月)。 このような場合、「臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行う前に、臓器移植を行ってください。 Acta Neuropathol. (2016) 132:479-81. doi: 10.1007/s00401-016-1598-1
PubMed Abstract | CrossRef Full Text | Google Scholar
11.脳侵襲は腫瘍の再発を予知しない。 Gousias K, Schramm J, Simon M. Simpson grading revisited: aggressive surgery and its place in modern meningioma management(シンプソン・グレーディング再考:現代の髄膜腫管理における積極的な手術とその位置づけ). J Neurosurg. (2016) 125:551-60. doi: 10.3171/2015.9.JNS15754
PubMed Abstract | CrossRef Full Text | Google Scholar
12.シンプソングレーディングの再考:現代の髄膜腫管理の位置づけ. 松野 敦、藤巻 孝、佐々木 孝、長島 崇、井手 哲夫、浅井 晃、他:再発および非再発髄膜腫の増殖能に関する臨床的および病理組織学的解析. Acta Neuropathol. (1996) 91:504-10. doi: 10.1007/s004010050458
PubMed Abstract | CrossRef Full Text | Google Scholar
13.篠原淳子(筑波大学):1.1.2. 大矢 聡、川井健司、中冨 裕、斉藤直樹:現代の髄膜腫手術におけるSimpson grading systemの意義:WHO Grade I髄膜腫の再発予測の鍵としてのグレードとMIB-1 labeling indexの統合-臨床論文-. J Neurosurg. (2012) 117:121-8. doi: 10.3171/2012.3.JNS111945
PubMed Abstract | CrossRef Full Text | Google Scholar
14.邦訳:「髄膜腫の手術のシステム:グレードとMIB-1ラベリングインデックスの統合と再発予測の鍵」。 湯澤慎一郎、西原浩之、田中慎一郎:髄膜腫のジェネティック・ランドスケープ. Brain Tumor Pathol. (2016) 33:237-47. doi: 10.1007/s10014-016-0271-7
PubMed Abstract | CrossRef Full Text | Google Scholar
15.西原弘之:髄膜腫の遺伝的ランドスケープ. Karsy M, Azab MA, Abou-Al-Shaar H, Guan J, Eli I, Jensen RL, et al. meningioma genomic insights の臨床的可能性:神経外科医のための実用的レビュー。 Neurosurg Focus. (2018) 44:E10. doi: 10.3171/2018.2.FOCUS1849
PubMed Abstract | CrossRef Full Text | Google Scholar
16.邦訳:「髄膜腫ゲノムインサイトの臨床的可能性」(日本経済新聞出版社)。 このような場合、「DREAM複合体」の発現を抑制することが重要である。 Proc Natl Acad Sci USA. (2019) 116:21715-26. doi: 10.1073/pnas.1912858116
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Spille DC, Heß K, Sauerland C, Sanai N, Stummer W, Paulus W, et al. 髄膜腫における脳浸潤:発生率と臨床変数および予後との相関。 World Neurosurg. (2016) 93:346-54. doi: 10.1016/j.wneu.2016.06.055
PubMed Abstract | CrossRef Full Text | Google Scholar
18.脳侵襲と予後の関係. PiŽem J, Velnar T, Prestor B, Mlakar J, Popović M. meningiomaにおける脳浸潤評価可能性はmeningiomaサイズとグレードに関係し、外科的に摘出したmeningioma標本の広範囲なサンプリングにより改善することが可能である。 Clin Neuropathol. (2014) 33:354-63. doi: 10.5414/NP300750
PubMed Abstract | CrossRef Full Text | Google Scholar
19. 組織学的に良性/グレード I の髄膜腫の早期再発は、腫瘍が大きいことと、祖先の腫瘍細胞クローンにモノソミー 14 と del(1p36) が併存していることと関連している。 Neuro Oncol. (2007) 9:438-46. doi: 10.1215/15228517-2007-026
PubMed Abstract | CrossRef Full Text | Google Scholar
20. ヤングブラッド MW、デュラン D、モンテジョ JD、リ C、オメイ SB、エズドゥマン K、シェス AH、他。 3000 以上の髄膜腫のコホートにおけるゲノムサブグループと臨床特徴の相関関係。 J Neurosurg. (2019). doi: 10.3171/2019.8.jns191266. .
PubMed Abstract|CrossRef Full Text|Google Scholar
21. このような場合、「手術と補助放射線治療後の非定型髄膜腫の局所制御を予測する組織学的特徴」が重要となる。 J Neurosurg. (2019) 130:443-50. doi: 10.3171/2017.9.JNS171609
PubMed Abstract | CrossRef Full Text | Google Scholar
22.邦訳:「非定型髄膜腫の手術と補助放射線療法後の局所制御を予測する病理組織学的特徴」. ペリーA、スタッフォードSL、シャイタウアーBW、スマンVJ、ローゼCM. 完全切除された原発性髄膜腫におけるMIB-1、p53、DNAフローサイトメトリーの予後的意義。 Cancer. (1998) 82:2262-9. doi: 10.1002/(SICI)1097-0142(19980601)82:11<2262::AID-CNCR23>3.0.CO;2-R
PubMed Abstract | CrossRef Full Text | Google Scholar
23. 頭蓋底髄膜腫の長期手術成績と生物学的予後因子:臨床論文. J Neurosurg. (2011) 114:1278-87. doi: 10.3171/2010.11.JNS10701
PubMed Abstract | CrossRef Full Text | Google Scholar
24.篠原恭子(2007)・篠原恭子(2007)
・篠原恭子(2010) Soyuer S, Chang EL, Selek U, Shi W, Maor MH, DeMonte F. 良性脳髄膜腫に対する手術後の放射線療法。 Radiother Oncol. (2004) 71:85-90. doi: 10.1016/j.radonc.2004.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
25.脳腫瘍の手術の後の放射線療法。 J Cancer Res Clin Oncol. (2019) 145:1351-60. doi: 10.1007/s00432-019-02891-6
PubMed Abstract | CrossRef Full Text | Google Scholar
26.邦訳:「頭蓋底髄膜腫に対するリスクグループ適応の放射線治療」(日本経済新聞社)。 Budohoski KP, Clerkin J, Millward CP, O’Halloran PJ, Waqar M, Looby S, et al. 外科治療を受けた非定型髄膜腫の早期進行の予測因子. Acta Neurochir. (2018) 160:1813-22. doi: 10.1007/s00701-018-3593-x
PubMed Abstract | CrossRef Full Text | Google Scholar
27.邦訳:「非定型髄膜腫の手術治療による早期進行の予測」(日本経済新聞出版社)。 De La Monte SM, Flickinger J, Linggood RM. 亜全切除後の髄膜腫の再発を予測する病理組織学的特徴。 Am J Surg Pathol. (1986) 10:836-43. doi: 10.1097/00000478-198612000-00002
PubMed Abstract | CrossRef Full Text | Google Scholar
28.再発を予測する組織病理の特徴。 Backer-Grøndahl T, Moen BH, Torp SH. ヒト髄膜腫の病理組織学的スペクトラム。 Int J Clin Exp Pathol. (2012) 5:231-42.
PubMed Abstract | Google Scholar
29. Rezanko T, Akkalp AK, Tunakan M, Sari AA. 髄膜腫のMIB-1計数方法と病理医間の一致。 Anal Quant Cytol Histol. (2008) 30:47-52.
PubMed Abstract | Google Scholar
30. Pérez-Magán E, Campos-Martín Y, Mur P, Fiaño C, Ribalta T, García JF, et al. Meningiomaの進行と再発に関連する遺伝子変化。 J Neuropathol Exp Neurol. (2012) 71:882-93. doi: 10.1097/NEN.0b013e31826bf704
PubMed Abstract | CrossRef Full Text | Google Scholar
31.遺伝子変異は、髄膜腫の進行と再発と関連しています。 Linsler S, Kraemer D, Driess C, Oertel J, Kammers K, Rahnenführer J, et al. meningioma progression and recurrenceの分子生物学的決定。 PLoS ONE. (2014) 9:e94987. doi: 10.1371/journal.pone.0094987
PubMed Abstract | CrossRef Full Text | Google Scholar
32. 組織学的に良性な髄膜腫における予後を示す遺伝子の変化。 Clin Neuropathol. (2013) 32:311-7. doi: 10.5414/NP300580
PubMed Abstract | CrossRef Full Text | Google Scholar
33.邦訳:「神経変性疾患における遺伝子の変化と予後」。 Gao F, Shi L, Russin J, Zeng L, Chang X, He S, et al. Meningiomaの悪性化におけるDNAメチル化。 PLoS ONE. (2013) 8:e54114. doi: 10.1371/journal.pone.0054114
PubMed Abstract | CrossRef Full Text | Google Scholar
34.邦訳:「髄膜腫の悪性化におけるDNAメチル化」。 Vengoechea J, Sloan AE, Chen Y, Guan X, Ostrom QT, Kerstetter A, et al. Methylation Markers of malignant potential in meningioma. J Neurosurg. (2013) 119:899-906. doi: 10.3171/2013.7.JNS13311
PubMed Abstract | CrossRef Full Text | Google Scholar
35.邦訳:「髄膜腫の悪性腫瘍マーカー」邦訳:「髄膜腫の悪性腫瘍マーカー」邦訳:「邦訳:髄膜腫の悪性腫瘍マーカー」。 Lu VM, Goyal A, Lee A, Jentoft M, Quinones-Hinojosa A, Chaichana KL. 髄膜腫におけるTERTプロモーター変異の予後的意義:系統的レビューとメタアナリシス。 J Neurooncol. (2019) 142:1-10. doi: 10.1007/s11060-018-03067-x
PubMed Abstract | CrossRef Full Text | Google Scholar