はじめに
イネは胚性根と胚性後根が混在した複雑な根構造を持っています。 発芽時にはまず根粒が出現し、その後すぐに胚性冠根が出現する(Rebouillat et al.2009; Coudert et al.2010)。 シュート頂端分裂組織の活動によって生じる最初の胚軸後不定根は、実生の発芽から数日後に出現する。 不定根は冠根とも呼ばれ、植物の一生を通じて作られる。
イネの根の内部の解剖学は、特に実生の段階でよく説明されている(Rebouillat et al.、2009)。 表皮と維管束組織の間には、いくつかの同心円状の組織(周辺部から茎まで)が存在する(図1)。 これらの組織は「地上組織」と総称され、「皮質」とも呼ばれることがある(Lux et al., 2004)。 ここでは、外胚葉、扁平上皮、皮質、内胚葉の各組織を総称して、「地上組織」と呼ぶことにする。 また、内皮と扁平上皮の間にある組織を「皮質」と呼ぶことにする。 生後6日目のニッポンバレ根粒の解剖学的構造。 (A)固定されパラプラストで埋め込まれた放射状核の縦断面。 バー=100μm。 (B)紫外線照射下で観察された新鮮なラディクルの横断面。 バー = 50 μm. (C)Bの極座標変換図。組織の層は次のように表示されている:茎(st)、複数の細胞層からなる地上組織(gt):1層の内皮(ed)、数層の皮質(c)、1層の柔毛(sc)、および1層の外皮(ex)。 内胚葉層(ed)と外胚葉層(ex)は、これらの細胞の細胞壁中心部の蛍光がない/減少していることで容易に識別することができる。 橈骨は1層の表皮(ep)で保護されている。 内皮 (ed) に隣接する内皮 (ic) と、最終的に海綿 (ae) を形成する外皮 (oc) の2種類の皮質層が確認できる。 茎では、6本のメタキシルム(x)血管に囲まれた大きな中心メタキシルム(cx)の存在に注目。
地上組織は、同じ柔組織由来でありながら異なる固有の性質を持ついくつかの層の組織からなり、根においてさまざまで重要な構造と機能の役割を担っています。 例えば、外皮と内皮は、土壌から光合成器官への水と養分の放射状の輸送を制御するアポプラズムバリアであり、この機能は主にスベリンラメラの堆積と二次細胞壁の分化によってもたらされる(Gregory、2006年)。 スクリーンチマは木質化した細胞であり、いくつかの金属に対する重要なバリアとなり、おそらく機械的な支持の役割を果たす(Huang et al.) これらの3つの単層組織とは対照的に、イネ胚軸の皮質組織は4〜5層で構成されている。 この組織は中皮質あるいは中皮とも呼ばれ、空間が分裂的に形成されていることが特徴で、イネでは海綿が形成される (Justin and Armstrong, 1991; Kawai et al., 1998)。 海綿体は氾濫条件への耐性に大きな役割を果たし、シュートから根への連続的な酸素の流れを確保し、無酸素条件下での根の成長を可能にする。 皮質は、多数の種の根の生理学において重要だが可変的な機能を持ち、貯蔵、洪水耐性、あるいは共生的相互作用に関与する(Luxら、2004)。
根粒と冠根は、小側根(SLR)と2種類の大側根という3種類の側根を作り出す(川田と芝山、1965;Konoら、1972;Rebouillatら、2009)。 この区分は、(i) 根の直径に基づいている。 SLR は最も小さく(50-60μm),L-LLR は最も大きい(120-150μm),(ii) 茎は LLR にのみ観察される,(iii) LLR のみ中心メタキシルムが存在する,そして (iv) L-LLR のみスクリーニマ層が存在する(Kono et al., 1972; Kawata et al.) このように分類されているにもかかわらず、側根、特にSLRにおける根の内部組織の正体は依然として不明である。 実際,Rebouillat ら (2009) と Kawata ら (1977) は,SLR の地上組織は内皮,柔組織,外皮(内側から外側に向かって)で構成されていると主張し,Kono ら (2009) は,内皮,柔組織,外皮(内側から外側に向かって)で構成されていると主張している。 (540>
このジレンマを解決し、一般に特定の組織の発生と機能を研究するためには、同一性マーカーの使用が必要である。 これまで用いられてきた組織マーカーの多くは、形態学的マーカーや組織化学的染色であり、細胞のアイデンティティを特徴づける有用な手段であった。 ベルベリンは細胞壁中のスベリンの存在を明らかにし、このスベリンは個々の内胚葉細胞を取り囲むカスパーストリップにほぼ独占的に存在するため、内胚葉の同一性の間接的なマーカーとして優れている(Brundettら、1988)。 A. thalianaにおいても、遺伝子組換え植物において、レポーター遺伝子(GUSおよび/またはGFP)と融合した組織特異的プロモーターを用いて、組織特異的マーカーが開発された。 例えば、SCARECROWプロモーターは、内胚葉のアイデンティティマーカーとして用いられている(Sugimoto et al.) また、QC25およびQC46エンハンサートラップGUS系統(Sabatini et al., 2003)およびイネのQHB(Kamiya et al., 2003)は、そのQC特異的発現から静止期センター(QC)マーカーとして同定されている。 これらのマーカーは注目されているにもかかわらず、利用可能なものはわずかであり、ほとんどA. thalianaのみである。 また、これらには欠点もある。 例えば、SCARECROW(SCR)プロモーターを「内胚葉」マーカーとして用いることの妥当性は、SCRおよびSHORT ROOT(SHR)の地上組織分化における役割に関する特定の問題を取り上げる際に、議論の余地がある。 実際、SCRおよびSHR遺伝子は、内胚葉/皮質の形成にそれ自体関与している(Wu and Gallagher, 2014)。 A. thalianaでは、根の皮質マーカーはCo2およびCo3プロモーターのみである(Heidstraら、2004;Ten Hoveら、2010)。 イネでは、Co2およびCo3遺伝子の明確なオルソログが存在しないため、これらの皮質マーカーはまだ使用されていない。 イネでは、皮質の同一性を示すaerenchyma formationのような間接的な形態学的マーカーだけが今日まで使用されてきた(Rebouillat et al. これらのマーカーはこれまでほとんど使用されてこなかったが、その有効性は実証されている。 例えば、CCRC-M2及びJIM13細胞壁抗体は、A. thalianaにおいて、scr突然変異体の地上組織層が複数の同一性を示す一方で、shr突然変異体に存在する内部組織の単一層が皮質同一性を有することを示すために用いられた(Di Laurenzio等、1996;Helariutta等、2000)。 これらのマーカーには多くの利点がある:その単純さと、自家蛍光との重複を制限するために異なる蛍光色素と結合した二次抗体を組み合わせることができること、遺伝子変換を必要としないこと、他のクラスのマーカーを補完するために使用できることである。 このプロトコルを用いて、174の細胞壁抗体の大規模なライブラリでイネの放射状切片をスクリーニングした。 その結果、8つの皮質特異的なマーカーを同定し、イネには2種類の皮質組織があり、それぞれ異なるアイデンティティを持つことを明らかにした。 根の切片の解剖学的位置から、これらの層を内側皮質と外側皮質と名づけた。 これらの皮質特異的マーカーの有用性を示すために、これらの抗体のうち3つを用いて側根の地上組織の同一性を明らかにした。 特にSLRでは、内部の組織層が外側の皮質と同一であることを示す。 本プロトコルは、トランスジェニック植物を作製することなく、あらゆる種における組織マーカーの開発に利用できる汎用性の高いものである。 このプロトコルは、新鮮なシュート、葉、根、あるいは他の植物のどの組織にも容易に適用でき、組織特異的マーカーを同定する簡単で容易な方法である。 さらに、これらのマーカーは他の分子マーカーと組み合わせて使用することができる。
結果
Immunoprofiling of Cell Wall Antibodies in Rice Root Radial Sections Reveins Cortex Layers
皮質細胞の抗体ベースマーカーを同定する目的で、まず新鮮なイネ根の放射状切片の中量免疫標識法を確立した(詳細は材料と方法および補足図1参照)。 次に、細胞壁成分(Complex Carbohydrate Research Center (CarboSource Services, Athens Georgia, USA) および Paul Knox Cell Wall lab (University of Leeds, UK) から)に対するモノクローナル抗体でスクリーニングを行い、大脳皮質マーカーを同定した(詳細は、材料と方法を参照のこと)。 試験した 174 種類の抗体から、皮質特異的と思われるものを 12 種類だけ保持した。 さらに2回の実験を行い、その再現性を検証した結果、8つの抗体が3つの複製間で類似した強固なプロフィールを示した(図2)。 5つの抗体(JIM7, M14, M38, M130, M131)は、皮質において同じ免疫標識パターンを示した。 隣接しない細胞壁のみが標識され、皮質細胞全体が単一な「ダイヤモンド型」の標識となった。 他の3つの抗体(LM5、M133、M107)では、特にLM5とM107の抗体で、皮質と時には篩骨細胞で標識が検出された。 信号は皮質細胞壁上で均一であったが,皮質内層(内胚葉層に隣接する皮質の層)では,皮質外層よりもはるかに弱かった。 このように、皮質組織と相補的なプロファイルを持つこれらの抗体はすべて、皮質細胞のアイデンティティを解析するために用いることができる特異的なマーカーである。 さらに、2つの異なる皮質ラベルは、2つの皮質下領域を定義しており、外層と内層が、これらの抗体によって明らかにされた明確な分子アイデンティティを有することを示唆している<540><9254>図2<7046><7072><7120>図2. モノクローナル細胞壁抗体ライブラリーからスクリーニングされた174のうち、8つの特異的皮質抗体(JIM7、M14、M38、M130、M131、LM5、M133、M107)を同定したものである。 各抗体について、免疫組織学的標識後に共焦点顕微鏡下で横断面のマージ画像を得た:黄色は561 nmでの抗体パターン、青色は紫外線下での細胞壁の自家蛍光である。 5つの抗体(JIM7, M14, M38, M130, M131)は、染色されたすべての皮質細胞層内で同様のプロファイルを示す(菱形)。 3つの抗体(LM5, M133, M107)は皮質細胞壁を均質に標識した。 これらの抗体では、内側の皮質(ic)層は外側の皮質(oc)層と比較して染色されないことに注意されたい。 挿入図は、対応する画像のクローズアップである。 バー=20μm.
ImageJソフトウェア(http://imagej.nih.gov/ij/)の「polar transformer」プラグインを用いて根の切片の画像を見ると、これら2つの皮質下層のいくつかの特定の特徴が強調された(図1B、C;Schneiderら、2012;Lartaudら、2014)。 内側の細胞は、外側の細胞に比べ細胞壁が厚く、細胞壁の融合に起因する様々な含気空洞が見られることが特徴的であった。 また、内側の皮質細胞は内胚葉細胞に似た扁平な形状をしており、外側の細胞が丸みを帯びているのとは対照的であった。 この変形した写真では、細胞の内側から外側へ走る壁である放射状の細胞壁、内胚葉細胞と外胚葉細胞の自家蛍光が見えないが、これはキャスパリアンストリップが存在するためと推定される。 同様に、より少ない程度ではあるが、内皮細胞の放射状の細胞壁にも自家蛍光の小さな穴のexemptが見られた。
すべての側根タイプは外側皮質組織のみを有する
皮質マーカーの有用性を示し、細胞のアイデンティティを特徴付けるために、3つのイネ側根タイプ(L-LLR、T-LLR、SLR)をこれらの抗体のうち3つ(M107、M133、M14)で標識した。 本実験では、L-LLRはシャーレ上で発生することが少ないため、水耕条件下で2週間栽培したイネ苗から側根を採取した。 まず、根の切片の横方向と極方向から細胞壁の自家蛍光を観察し、各タイプの側根の地上組織編成を解析した(図3)。 この最初の分析により、3種類の側根について、内部の放射状の解剖学的構造がわずかに異なることがわかった。 紫外線下で見た根管切片と同様に、内胚葉組織と外胚葉組織は、根管細胞壁の中央の蛍光消光によって識別できる。 この2つの組織は、すべての側根に存在した。 内胚葉と外胚葉の間には、L-LLRとT-LLRではいくつかの組織層が存在したが、SLRでは単一の(未同定の)細胞層しか存在しなかった。 L-LLRの解剖学的構造は精根のように見え、内皮の外側には、数層の皮質組織があり、海綿状組織が形成されていることが容易に確認できた。 さらに、広い細胞壁を持つ密着した細胞で形成されたsclerenchyma層が観察された。 実験によっては、この細胞層は必ずしも完全に発達していない。 T-LLRの切片では、外層は皮質組織に似ており、内層はSLRの単一(未同定)層に似ていた。
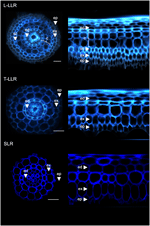
Figure 3. Large Lateral Rootタイプ(Large-LLRとThin-LLR)とSmall Lateral Root(SLR)の組織構成。 苗は水耕条件下で2週間栽培した。 横切片の細胞壁自発蛍光とUV光下での極座標変換表示。 組織は以下のようにラベルされている:表皮 (ep), 外皮 (ex), 皮質 (c), 内皮 (ed)。 表皮(ep)は実験中にしばしば断片化したことに注意。 Bars = 20μm。
SLRおよびT-LLR地上組織に存在する細胞層を特定し、L-LLRにおける皮質の同一性を確認するために、3つの皮質特異的抗体(M107、M133およびM14;図4)で側根切片を免疫標識化した。 M107とM133抗体は、すべての側根で内皮と外皮の間に位置するすべての細胞層を標識した。 これらの抗体に対する根粒の染色から、これらの細胞層は扁平組織または皮質の同一性を持ちうることが示唆された。 しかし、特にSLRの切片では、M14もこれらの層を免疫標識していたことから、これらの層が外皮の同一性を持っていることが明確に示された

Figure 4. M107、M133、M14で免疫標識した大側根型(Large-LLR、Thin-LLR)と小側根型(SLR)の切片の合成画像。 苗は水耕栽培条件下で2週間育成した。 黄色は561 nmでの抗体標識、青色は紫外線下での自家蛍光。 組織は、表皮(ep)、外皮(ex)、皮質(c)、内皮(ed)のように標識されている。 表皮 (ep) は実験中にしばしば断片化したことに注意。 バー=20μm。
皮質細胞外層の数の変動(SLRで1層、T-LLRで2層、L-LLRで3層、根粒で4〜5層)は、イネの根径に大きな役割を担っている(図5)。 側根と根粒組織の模式図。
結論
植物の皮質下領域を修飾するために、すでにさまざまな用語が使用されてきた。 例えば,今回研究したものと同等の「内側」の木質化した皮質層の存在は,すでに野生イネで報告されている(Yang et al, 2014)。 トウモロコシでは、2つの皮質ドメインは異なる定義がなされている(Baluška et al.、1993)。 内側」ドメインはaerenchymaを形成し、ここでの外側皮質に相当し、「中間-外側」皮質は木化した支持組織であり、sclerenchymaである可能性がある。 シロイヌナズナでは、皮質単層と内皮の間に位置する「中皮質」細胞層も報告されている (Baum et al., 2002; Paquette and Benfey, 2005)。 最近の結果では、この皮質層はGA、酸化ストレス、SHRやSCRなどによって形成が制御され、耐環境性に関与していることが示唆されている(Paquette and Benfey, 2005; Cui and Benfey, 2009; Pauluzzi et al, 2012; Wu and Gallagher, 2014)。 興味深いことに、この層は典型的な形状をしたらせん状の層であるとも言われている(Baum et al.) このシロイヌナズナの「中間皮質」層は、機能的にも構造的にも、イネ胚軸の内側皮質層と似ているのだろうか? イネの縦断面や横断面では、内側皮質層は通常らせんを形成しており、この2つの組織層が類似している可能性が示唆される。 シロイヌナズナでは、「中間皮質」層は内皮の周縁分裂に由来し、発芽後7〜14日の間にQCから離れたところに現れる(Paquette and Benfey, 2005)。 イネにおいてこれらの重要なパラメータを検証するためには、新しいツールが必要であろう。 例えば、この層の形成時期に影響を与える変異体は、これまで報告されていない。 さらに、イネのQCをイメージングする技術的な進歩も必要である。 しかしながら、私たちの皮質特異的マーカーは、内皮質(イネ)と「中皮質」(シロイヌナズナ)の形成に関わる機能と分子ネットワークを比較する新しいツールを提供するものである。 現在、私たちの研究室では、イネの根における皮質形成の制御の第一候補として、SCRとSHRのイネオーソログを用いて、内側と外側の皮質形成の分子決定要因を明らかにする研究が行われている(Pauluzzi et al.. 2012)。
材料と方法
植物材料
6日齢の苗
種子は、Oryza sativa L. ssp. japonica Nipponbareの種子を滅菌シャーレ(Corning, 431301; 20 × 20 cm)中で制御条件下(昼夜リズム:12/12 h, 28/25°C, 光強度:500 μE m-2 s-1)で垂直方向に栽培した。 まず、種子を70%エタノールで1分間洗浄し、表面殺菌を行った。 次に、エタノールの代わりに、40%の漂白剤を蒸留水に溶かし、3滴のtween 80 (Sigma-Aldrich P4780-500 mL)を加えた溶液を使用した。 種子をこの溶液に穏やかに攪拌しながら30分間浸し、滅菌蒸留水で少なくとも4回すすいだ。 オートクレーブ滅菌した高温(~50℃)の半量ムラシゲ・スクーグ(MS/2)培地(250 mL)をペトリ皿に注ぎ、~45分間固化させる。 MS/2培地は、2.15 g.L-1 のMS培地塩基性混合物(Duchefa Biochemie, M0221)、75 mg.L-1 のMSビタミン混合物(Duchefa Biochemie, M0409)、8 g.L-1 のアガロースII型(Sigma-Aldrich, A6877)から構成される。 その後、無菌種子を固化したMS/2培地に、放射状に下向きにして押し込む。 根は生育6日後に収穫した。
4週齢植物
水中で3日間発芽させた後、制御条件下(昼夜リズム:12/12時間、28/25℃、光強度:500μE m-2 s-1、相対湿度:55%)で水耕システムに移行させた。 水耕栽培システムは、30Lの水耕栽培溶液を含む50Lのプラスチックボックスからなり、その上に1cm厚の発泡マットレスが敷かれている。 発泡スチロールマットレスは、苗の茎の根元を維持するために隙間を空けてある。 水耕栽培用培地は、(NH4)2SO4 (0.5 mM), MgSO4.7H2O (1.6 mM), Ca(NO3)2.4H2O (1.2 mM), KNO3 (0.7 mM), FeSO4 (0.1 mM), Na2EDTA (0.1 mM), MnSO4.2H2O (0.3 mM), MnSO4.2H2O (1.3 mM) から構成されています。 H2O (1.7 μM), (NH4)6Mo7O24.4H2O (0.2 μM), ZnSO4.7H2O (0.2 μM), CuSO4.5H2O (0.2 μM), H3BO3 (1.4 μM), および KH2PO4 (0.6 mM)を含む。 この溶液はプラスチックボックスの底に設置したポンプで通気し、10日ごとに交換する。 pHは5.4±0.2に調整・維持した。
新鮮根の切片作成
成長した根粒または側根(2cm)の先端を鋭い刃物で切り、根端を揃えるように平行に置いた(補足図1A,B)。 それらを1滴の3%溶融アガロース(50℃;補足図1C)に包埋した。 根端を含むパッチを、3%溶融アガロースで満たした3×1×1cmのウェルに挿入した(補足図1D)。 固化後、ブロックのサイズを変更し、ビブラトームプレートに接着してスライスした。 ビブラトーム(Hm650v (Thermo Scientific Microm))のパラメータは、速度30、周波数70、振幅0.8、厚さ60μmであった(補足図1E)。 切片を免疫染色用のチャンバースライド(Lab-teak 177402)に移すか(補足図1F)、1Xアルカリリン酸緩衝液(PBS、Sigma-Aldrich P3813)で加湿した観察用スライドに移す。
Immunolocalization
チャンバースライド上に置いた切片(1室あたり3枚)をまず1XPBSで補足した0.1Mグリシン中で洗浄し、続いて1XPBSで各10分、2回洗浄した。 その後、組織を5%ウシ胎児血清を含むPBS溶液(ブロッキング液、Thermo Fisher 37520)に4℃で一晩、攪拌下に浸漬した。 このブロッキング液で1/10に希釈した一次抗体を、4℃で一晩、攪拌下で塗布した。 その後、切片をPBS 1Xで10分間3回リンスした。 根の切片は、ブロッキング溶液で500倍に希釈した二次抗体とともに、攪拌下で2時間インキュベートした。 これらの抗体は、Alexa 546抗ラット抗体(Invitrogen A11081)またはAlexa 546抗マウス抗体(Invitrogen A11060)という蛍光色素と結合していた。 その後,切片を1×PBSで10分間ずつ,攪拌下で3回再洗浄した. チャンバーを取り除き、モビオールマウントメディア(Sigma-Aldrich 81381)を数滴加えた。
パラプラスト固定
ペトリ皿で6日間生育した大根を4%パラホルムアルデヒド(PBS 1X中)で4℃、一晩固定し、PBS 1Xを用いて2回リンスした(Jackson, 1991)。 固定した組織をエタノールで脱水し、Histochoice Clearing Agent (HistoClear, Sigma Aldrich) で清拭し、Paraplast (Fisher) で包埋した。 組織はLeica RM2255ミクロトームで切片化し(厚さ6μm)、SuperfrostPlusスライド(Fisher)にマウントした。
顕微鏡検査
明視野および自家蛍光観察はLeica DM4500顕微鏡を用いて実施した。 自家蛍光は “A “フィルターキューブで撮影した(励起範囲。 UV;励起フィルター。 BP 340-380,抑制フィルター. LP 425)で撮影した。 免疫染色された切片は共焦点顕微鏡で観察した。 Zeiss LSM 510 または Leica SP8 で観察した。 細胞壁は、まず自家蛍光を使用して可視化した。 二次抗体は、543nmまたは561nmのHelium/Neonレーザーを用いて可視化した。 写真はカラーRetiga 2000Rカメラ(QIMAGING、カナダ)で撮影し、Volocity画像取得ソフトウェア(Improvision、英国)を実行した。
著者貢献
SH, FD, MB, CB: データ取得、SH、CP、ADはデータ解析、SH、EG、CP、ADは原稿の下書き。
利益相反声明
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で行われたことを宣言する。
謝辞
免疫局在、共焦点および多光子イメージングについて技術支援をいただいたMRI (Montpellier RIO Imaging plateform), PHIVおよびLa Gaillarde Plateformsに感謝の意を表します。 SHはCIRAD博士研究員の支援を受けている。
補足資料
本論文の補足資料は、以下のサイトに掲載されている。 https://www.frontiersin.org/article/10.3389/fpls.2015.01139
略語
ae, aerenchyma; c, cortex; ed, endodermis; ep, epidermis; ex, exodermis; gt, ground tissue; ic, inner cortex.を使用。 L-LLR, Large-type Large Lateral Root; oc, outer cortex; sc, sclerenchyma; SLR, Small Lateral Root; st, stele; T-LLR, Thin-type Large Lateral Root; x, xylem.と続く。
Baluška, F…, Brailsford, R. W., Hauskrecht, M., Jackson, M. B., and Barlow, P. W. (1993). トウモロコシ根皮質における細胞二型性:分裂後の成長帯における細胞挙動の分化における微小管、エチレンおよびジベレリンの関与. Bot. Doi: 10.1111/j.1438-8677.1993.tb00766.x
CrossRef Full Text | Google Scholar
Baum, S. F., Dubrovsky, J. G., and Rost, T. L. (2002)(Baum, S. F., ダブロスキー、ロスト、T. L. シロイヌナズナ(アブラナ科)の根における頂膜組織と皮質・維管束の成熟。 Am. J. Bot. 89, 908-920. doi: 10.3732/ajb.89.6.908
PubMed Abstract | CrossRef Full Text | Google Scholar
Brundett, M. C., Enstone, D. E., and Peterson, C. A. (1988). 植物組織中のスベリン,リグニン,カロースのベルベリン-アニリンブルー蛍光染色法。 Protoplasma 146, 133-142. doi: 10.1007/BF01405922
CrossRef Full Text | Google Scholar
Coudert, Y., Périn, C., Courtois, B. , Khong, N. G., and Gantet, P. (2010). モデル穀物であるイネにおける根の発達の遺伝的制御. また、このような研究成果をもとに、「イネにおける根の発達の遺伝的制御」を研究する。 シロイヌナズナの根の地上組織パターニングにおけるSCARECROW、GA、LIKE HETEROCHROMATIN PROTEIN 1の相互作用。 doi: 10.1111/j.1365-313X.2009.03839.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Laurenzio, L., Wysocka-Diller, J., Malamy, J. E., Pysh, L., Helariutta, Y., Freshour, G., et al.(1996).この論文では、D.ローレンツィオ、M.ラミ、L., Wysocka-Diller, J., Malamy, L., L., Helariutta, Y., L., Freshour, G., et al. SCARECROW遺伝子は、シロイヌナズナの根の放射状組織を生成するのに必須な非対称細胞分裂を制御している。 Cell 86, 423-433. doi: 10.1016/S0092-8674(00)80115-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Gregory, P. J. (2006). 植物の根。 成長、活動、および土壌との相互作用。 オックスフォード;エイムズ,IA. Blackwell Pub.
Google Scholar
Heidstra, R., Welch, D., and Scheres, B. (2004).を参照。 このように、シロイヌナズナのSCARECROWは非対称な細胞分裂を行うことが知られているが、その作用はモザイク解析によって明らかにされている。 Genes Dev. 18, 1964-1969. doi: 10.1101/gad.305504
PubMed Abstract | CrossRef Full Text | Google Scholar
Helariutta, Y., Fukaki, H., Wysocka-Diller, J., Nakajima, K. , Jung, J. , Sena, G., and al. (2000). SHORT-ROOT遺伝子は、シロイヌナズナの根の放射状パターニングを放射状シグナルによって制御している。 Cell 101, 555-567. doi: 10.1016/S0092-8674(00)80865-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang,C. F., Yamaji, N., Ono, K., and Ma, J. F. (2012). ロイシンリッチリピート受容体様キナーゼ遺伝子は、イネの根における外細胞層の仕様に関与している。 plant j. 69, 565-576. doi: 10.1111/j.1365-313X.2011.04824.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Jackson, D. (1991). 「植物におけるin-situ hybridization” in Molecular Plant Pathology: Google Scholar
Justin, S. H. F. W., and Armstrong, W. (1991). イネ(Oryza sativa L.)の不定根におけるaerenchyma形成にエチレンが関与していることの証拠。 New Phytol. 118, 49-62. doi: 10.1111/j.1469-8137.1991.tb00564.x
CrossRef Full Text | Google Scholar
Kamiya, N., Nagasaki, H., Morikami, A., Sato, Y. and Matsuoka, M. (2003). 根端分裂組織の静止中心細胞で特異的に発現するイネWUSCHEL型ホメオボックス遺伝子の単離と特性解析。 また、この遺伝子は、イネの根端分裂組織の休止期中心に特異的に発現する。 イネ根の海溝形成過程における皮質細胞死の分解パターンの細胞学的解剖。 doi: 10.1007/s004250050257
CrossRef Full Text | Google Scholar
Kawata, S., Sasaki, O., and Yamazaki, K. (1977). イネにおける冠根と側根の構造および両者間の血管接続について. Jpn. J. Crop. Sci. 46, 569-579. doi: 10.1626/jcs.46.569
CrossRef Full Text | Google Scholar
Kawata, S. and Shibayama, B. (1965). イネの冠根における側根原基の形成について. Proc. 作物学会誌(日本). 33, 423-431. doi: 10.1626/jcs.33.423
CrossRef Full Text | Google Scholar
Kono, Y., Igeta, M. and Yamada, N.Y. (1972). イネ精根における側根の発生生理に関する研究. Jpn. J. Crop. Sci. 41, 192-204. doi: 10.1626/jcs.41.192
CrossRef Full Text
Lartaud, M., Perin, C., Courtois, B., Thomas, E., Henry, S., Bettembourg, M., et al.(2014)の記事。 PHIV-RootCell: a supervised image analysis tool for rice root anatomical parameter quantification(PHIV-RootCell:イネ根の解剖学的パラメータ定量化のための教師付き画像解析ツール). Front. Plant Sci. 5:790. doi: 10.3389/fpls.2014.00790
PubMed Abstract | CrossRef Full Text | Google Scholar
Lux, A., Luxova, M., Abe, J., and Morita, S. (2004). 根皮質:構造的・機能的変動と環境ストレスへの応答. Root Res. 13, 117-131. doi: 10.3117/rootres.13.117
CrossRef Full Text | Google Scholar
Paquette, A.J., and Benfey, P.N. (2005). 根の地上組織の成熟はジベレリンとスケアクロウによって制御され、SHORT-ROOTを必要とする。 Plant Physiol. 138, 636-640. doi: 10.1104/pp.104.058362
PubMed Abstract | CrossRef Full Text | Google Scholar
Pauluzzi, G., Divol, F., Puig, J., Guiderdoni, E., Dievart, A., and Périn, C. (2012). 根の地上組織遺伝子ネットワークに沿ったサーフィンを行う。 Dev. Biol. 365, 14-22. doi: 10.1016/j.ydbio.2012.02.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Rebouillat, J., Dievart, A., Verdeil, J., Escoute, J., Giese, G., Breitler, J.他 (2009).Scripted. イネの根の発達に関する分子遺伝学的研究。 イネ根の発生に関する分子遺伝学(Rice 2, 15-34) doi: 10.1007/s12284-008-9016-5
CrossRef Full Text | Google Scholar
Sabatini, S., Heidstra, R., Wildwater, M., and Scheres, B. (2003). SCARECROWはシロイヌナズナの根の分裂組織における幹細胞ニッチの位置決めに関与している。 Genes Dev. 17, 354-358. doi: 10.1101/gad.252503
PubMed Abstract | CrossRef Full Text | Google Scholar
Schneider, C.A., Rasband, W.S., and Eliceiri, K.W. (2012). NIH ImageからImageJへ:画像解析の25年。 Nat. Methods 9, 671-675. doi: 10.1038/nmeth.2089
PubMed Abstract | CrossRef Full Text | Google Scholar
Sugimoto, K., Jiao, Y. , and Meyerowitz, E. M. (2010). シロイヌナズナは根の発生経路を経由して複数の組織から再生する。 Dev. Cell 18, 463-471. doi: 10.1016/j.devcel.2010.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Ten Hove, C. A., Willemsen, V., de Vries, W. J., Van Dijken, A., Scheres, B., and Heidstra, R. (2010). SCHIZORIZAは、シロイヌナズナの根における幹細胞分裂の非対称性を制御する核内因子をコードしている。 Curr. Biol. 20, 452-457. doi: 10.1016/j.cub.2010.01.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S. and Gallagher, K. L. (2014). 非細胞自律性転写因子、SHORT-ROOTの移動は内膜系に依存している。 Plant J. 80, 396-409. doi: 10.1111/tpj.12640
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, C., Zhang, X. , Li, J. , Bao, M. , Ni, D. , and Seago, J. L. (2014). 野生イネ(Zizania latifolia Griseb.)の根と芽の解剖学と組織化学(Anatomy and histochemistry of roots and shoots in wild rice). J. Bot. 2014, 9. doi: 10.1155/2014/181727
CrossRef Full Text|Google Scholar
.