Introducción
La infección por el virus de la hepatitis B (VHB) es la causa más común de cirrosis hepática y carcinoma hepatocelular en la mayor parte de Asia.1,2 La patogénesis de la hepatitis crónica está mediada por la interacción de la reacción inmunitaria del huésped y los hepatocitos que presentan antígenos del VHB.3,4 Estudios anteriores han demostrado que la expresión de antígenos del VHB por parte de los hepatocitos está relacionada de forma importante con el estadio y la actividad de la enfermedad hepática crónica. En la fase de tolerancia inmunitaria, los antígenos del núcleo de la hepatitis B (HBcAg) se encuentran principalmente en el núcleo y se correlacionan con la replicación del VHB, mientras que, en la fase de eliminación inmunitaria subsiguiente, se produce un desplazamiento intrahepático del HBcAg del núcleo al citoplasma y se asocia con las actividades histológicas de la hepatitis crónica.5,6 En los casos de expresión intrahepática del antígeno de superficie de la hepatitis B (HBsAg), se han descrito tres patrones: el tipo homogéneo, el hepatocito de vidrio esmerilado (GGH) tipo I y el GGH tipo II. Se han observado patrones homogéneos en presentaciones agrupadas, discretas o tenues en pacientes con alta viremia o hepatitis activa. Los GGH de tipo I suelen estar dispersos individualmente en los lóbulos hepáticos con una expresión homogénea densa similar a la de una inclusión, mientras que los GGH de tipo II expresan antígenos de superficie en la periferia de los hepatocitos, que se agrupan en grupos, y suelen estar presentes durante la fase de baja replicación y se vuelven prevalentes desde la hepatitis activa hasta la cirrosis hepática y el carcinoma hepatocelular.7-10 Por lo tanto, tanto las expresiones intrahepáticas de HBcAg como de HBsAg están estrechamente relacionadas con el curso natural de la infección y la replicación del VHB.
Entre las fases de la hepatitis B crónica, la fase de limpieza inmunológica o denominada hepatitis B crónica HBeAg-positiva suele darse en la población más joven, presenta actividades histológicas menos graves y alberga menos tasas de mutación precore A1896 y mutaciones basales del promotor del núcleo (BCP) T1762/A1764 que la hepatitis B crónica HBeAg-negativa.11-14 El curso de la hepatitis B crónica es dinámico y es el resultado de la interacción entre la replicación viral y el sistema inmunitario del huésped. En consecuencia, en los pacientes con HBeAg positivo suele observarse una diversidad de características clínicas o actividades histológicas. Por ejemplo, entre el 34 y el 55% de los pacientes presentan fibrosis en puente o cirrosis en la histología del hígado, mientras que el resto de los pacientes presentan una fibrosis leve.15,16 Se ha demostrado que la acumulación de HBsAg en los hepatocitos se asocia con mutaciones virales específicas y se relaciona con las activi-dades de la enfermedad.8,9 Es interesante investigar las características de la expresión del HBsAg intrahepático en pacientes con diferente gravedad de la histología del hígado.
Los mutantes virales suelen evolucionar bajo la presión de la vigilancia inmunitaria del huésped. Entre los mutantes naturales del VHB, las mutaciones BCP T1762/A1764 se hicieron prevalentes con la progresión de la enfermedad y se han encontrado frecuentemente asociadas a la enfermedad hepática avanzada y al carcinoma hepatocelular.17,18 Los patrones de expresión intrahepática del HBsAg también cambiaron durante el curso natural de la hepatitis B crónica. La asociación de las mutaciones BCP T1762/A1764 y la expresión intrahepática del HBsAg es aún desconocida y queda por estudiar.
En este estudio se incluyeron retrospectivamente 181 pacientes positivos al antígeno de la hepatitis B (HBeAg) sin tratamiento que cumplían los criterios de inclusión. Los criterios de inclusión fueron una edad mayor de 18 años y menor de 70, HBsAg sérico positivo durante más de 6 meses y nivel de ADN del VHB sérico ≥ 100.000 copias/mL, nivel anormal de alanina aminotransferasa sérica, ninguna otra etiología explicable de hepatitis crónica incluyendo el alcohol, la hepatitis autoinmune o los marcadores de infección por el virus de la hepatitis C, el virus de la hepatitis D o el virus de la inmunodeficiencia humana, y la falta de antecedentes de tratamiento contra el VHB y de una muestra de biopsia hepática disponible para la evaluación histológica. Se tomaron muestras de suero y de biopsia hepática de todos los pacientes antes de los tratamientos antivirales, y las muestras se almacenaron a -70 oC hasta su análisis. Este estudio fue aprobado por la Junta de Revisión Institucional del Hospital Universitario Nacional Cheng Kung (nº: ER-99-398). Se obtuvo el consentimiento informado, de acuerdo con la Declaración de Helsinki.
Ensayos virológicos del VHB
La genotipificación del VHB se realizó mediante la reacción en cadena de la polimerasa multiplex, como se describe en otro lugar.19 El nivel de ADN del VHB en suero se midió utilizando la prueba COBAS Amplicor HBV Monitor (ensayo COBAS-AM, Roche Diagnostics, Branchburg, NJ). El nivel de HBsAg en suero se cuantificó mediante Abbott Architect HB-sAg QT (Abbott Diagnostics, Rungis, Francia) con un rango dinámico de 0,05-250,0 UI/mL. Las muestras con niveles de HBsAg > 250 UI/mL se volvieron a analizar en diluciones de 1:20 y 1:1000.
Reacción en cadena de la polimerasa y secuenciación de las regiones precore y BCP
El ADN del VHB se extrajo de 50 μL de suero utilizando Blood and Tissue Genomic Mini Kit (VIOGENE, Taipei, Taiwán). La primera ronda de PCR se realizó en las siguientes condiciones: 96 oC durante 2 min, 94 oC durante 1 min, 54 oC durante 1 min y 72 oC durante 2 min con los cebadores 5′-ACCTGCACGTAGCATGG (adelante) y 3′-GGATTAAAGACGTAGTAGAAG (atrás). La segunda ronda de PCR se realizó en las mismas condiciones con los cebadores 5′-ATGTCAACGACCGACCTTGA (forward) y 3′-TTCCCACCTTATGAGTCCAAG (reverse). Los productos de PCR purificados se secuenciaron directamente utilizando un secuenciador de ADN automatizado ABI 310 y el kit de reacción ABI PRISM Big Dye Terminator Cycle Sequencing Ready (Applied Biosystems) con el cebador directo que se utilizó durante la segunda ronda de PCR.
Histología del hígado
La histología del hígado fue evaluada por un único patólogo que desconocía los antecedentes de los pacientes. La necroinflamación y la fibrosis se evaluaron según el grado de necroinflamación de Knodell (que va de 0 a 18)20 y el estadio de fibrosis de Ishak (que va de 0 a 6),21 respectivamente.
La tinción inmunohistoquímica se realizó como se describe en otro lugar.22 Brevemente, se incubaron secciones desparafinadas de 5 μm de grosor con anti-HBsAg monoclonal de ratón (clon 3E7, Dako Corp., Carpinteria, EE.UU.) y anti-HBcAg (Novocastra Laboratories, Newcastle, Reino Unido) durante la noche a 4°C. La dilución óptima de anti-HBsAg o anti-HBcAg se determinó utilizando tejido hepático de un portador del VHB como control positivo. Se utilizó el kit StrAviGen Super Sensitive MultiLink (BioGenex) para detectar el complejo inmunitario resultante. La actividad de la peroxidasa se visualizó con un kit de sustrato de aminoetil carbazol (Zymed Laboratory, Inc, San Francisco, CA). Por último, las secciones se contrateñaron con hematoxilina. Como control negativo, la inmunoglobulina de ratón no inmune fue sustituida por el anticuerpo primario en la incubación. Se registraron los patrones de expresión del HBcAg por el núcleo, el citoplasma o ambos. Los patrones de expresión del HBsAg se clasificaron como homogéneos, GGH de tipo I, GGH de tipo II.22 Los hepatocitos teñidos homogéneamente se identificaron como hepatocitos con tinción citoplasmática homogénea de moderada a fuerte; los GGH de tipo I se identificaron como hepatocitos con tinción densa globular o «tipo inclusión», y los GGH de tipo II se identificaron como hepatocitos con tinción del antígeno de superficie en los márgenes o la periferia celular.6,22 Los GGH de tipo I se dispersan individualmente o se agrupan en los lóbulos hepáticos, mientras que los GGH de tipo II se agrupan sistemáticamente en nódulos. Los niveles de expresión de HBcAg y HBsAg se puntuaron de forma semicuantitativa según la proporción de células inmunomarcadas, en una escala de 0 a 4+, correspondiente a la positividad en 0, 1-10, 11-25, 25-50% y más del 50% de los hepatocitos examinados.
Análisis estadísticos
Los datos se expresaron como media ± desviación estándar. Las variables continuas se compararon mediante la prueba U de Mann-Whitney o el ANOVA de Kruskal-Wallis para el análisis univariante. Las variables categóricas se analizaron mediante la prueba de la χ2 o la prueba exacta de Fisher. Los factores independientes que se asociaron con los niveles de expresión del HBsAg intrahepático se llevaron a cabo mediante un análisis de regresión logística multivariante. El tratamiento de los datos y los análisis estadísticos se realizaron con el software SPSS para Windows, versión 17.0 (SPSS Inc., Chicago, IL).
ResultadosCaracterísticas de los pacientes inscritos
La tabla 1 recoge las características demográficas de los 181 pacientes inscritos. La mayoría de los pacientes eran varones (69,1%) y el 63,0% de ellos presentaban el genotipo C del VHB. La mutación precore A1896 se detectó en 20 pacientes (11,0%) y las mutaciones BCP T1762/A1764 se detectaron en 38 pacientes (21,0%). De los 181 pacientes, se detectó una tinción positiva del HB-sAg en 105 pacientes (58,0%). Los pacientes con tinción de HBsAg mostraron un HBsAg sérico significativamente mayor (P
Características clínicas, virológicas e histológicas de los 181 pacientes.
| Características | Valor | |||
|---|---|---|---|---|
| Expresión de HBsAg | Valor P | |||
| Todos los pacientes (n = 181) | Negativos (n = 76) | Positivos (n = 105) | ||
| Edad (años) ± SD | 36.4 ± 10.5 | 34,2 ± 9,2 | 38,0 ± 11,2 | 0,009 |
| Género (hombre/mujer) | 125/56 | 50/26 | 75/30 | 0.418 |
| Nivel medio de AST (U/L) ± SD | 59,7 ± 51,2 | 58,7 ± 42,5 | 60,5 ± 56.8 | 0,634 |
| Nivel medio de ALT (U/L) ± DE | 116,3 ± 124,2 | 120,2 ± 100,8 | 113,5 ± 139.1 | 0,282 |
| Genotipo del VHB (B/C) | 114/67 | 66/10 | 48/57 | |
| Precore: G1896/A1896 | 20/161 | 13/63 | 7/98 | 0.027 |
| BCP:* mutante/salvaje | 38/143 | 12/64 | 26/79 | 0.144 |
| ADN del VHB (log copias/mL) | 8,4 ± 1.1 | 4,0 ± 0,7 | 4,3 ± 0,7 | |
| Nivel de HBsAg ((log IU/mL) | 4,2 ± 0.7 | 8,1 ± 1,0 | 8,6 ± 1,1 | 0,003 |
| Grado medio de necroinflamación de Knodell ± SD | 5.0 ± 3,0 | 5,3 ± 2,8 | 4,7 ± 3,0 | 0,128 |
| Estado medio de fibrosis de Ishak ± DE | 1,8 ± 1,6 | 1,7 ± 1,2 | 1,9 ± 1,7 | 0.703 |
Mutante, T1762 y A1764; salvaje, A1762 y T1764. Se utilizó la prueba de la χ2 para las variables de género, genotipo del VHB, mutaciones del precordio y del promotor del núcleo basal, mientras que la prueba de la U de Mann-Whitney se utilizó para otras variables. AST: aspartato aminotransferasa. ALT: alanina aminotransferasa. BCP: promotor del núcleo basal. VHB: virus de la hepatitis B.
Patrones de distribución de la expresión del HBsAg
Respecto a los 105 pacientes que presentaron expresión del HBsAg, se detectó un patrón homogéneo (figura 1A) en 34 (32.El patrón homogéneo (figura 1A) se detectó en 34 (32,4%) pacientes, el patrón de tipo I (figura 1B) se detectó en 50 (47,6%), el patrón de tipo II (figura 1C) se detectó en 7 (6,7%), y el patrón mixto se detectó en 14 (13,3%). Como se indica en la tabla 2, se observó una mayor prevalencia de mutaciones BCP T1762/A1764 en el tipo II GGH (P =0,001) en comparación con otros patrones. Hubo una relación recíproca entre la expresión del HBsAg y los marcadores de replicación viral en suero. En la figura 1D se muestra que los pacientes con expresión de GGH tipo II tenían niveles de ADN del VHB y títulos de HBsAg más bajos, pero niveles de expresión de HBsAg intrahepáticos más altos (figura 1D). Además, la histología del hígado con expresión de GGH de tipo II presentaba actividades de necroinflamación y fibrosis hepática significativamente más graves, y un mayor nivel de expresión de HBsAg intrahepático (Figura 1E).
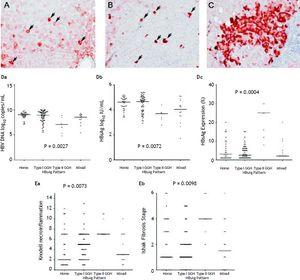
Patrones de retención del HBsAg. A. Algunos hepatocitos teñidos de HBsAg con citoplasma homogéneo de moderado a fuerte (flechas) en un fondo de hepatocitos débilmente teñidos. El núcleo de cada hepatocito teñido homogéneamente se encontraba en el centro de la célula. B. El hepatocito de vidrio deslustrado (GGH) de tipo I con tinción densa de HBsAg de tipo globular o «de inclusión» (flechas) estaba disperso en el parénquima hepático. C. Un grupo de GGH de tipo II mostraba tinción de HBsAg en el margen o la periferia de la célula. Correlaciones de los patrones de expresión del HBsAg y el nivel de ADN del VHB en suero (Da), el nivel de HBsAg en suero (Db) y el nivel de expresión del HBsAg intrahepático (Dc). La asociación de los patrones de expresión del HBsAg y el grado de necroinflamación de Knodell (Ea) y el estadio de fibrosis de Ishake (Eb). Las comparaciones entre grupos se analizaron mediante ANOVA de Kruskal-Wallis.
Características demográficas según los patrones de distribución f de expresión del HBsAg.
| Patrón de HBsAg (n = 105) | |||||
|---|---|---|---|---|---|
| Mixto (n = 14) | Homogéneo | Tipo I GGH | Tipo II GGH | Valor P | |
| (n = 34) | (n = 50) | (n = 7) | |||
| Edad (años) ± DE | 36.3 ± 9.2 | 36.3 ± 10.0 | 39.2 ± 12.7 | 40.0 ± 7.9 | 0.104 |
| Género (masculino/femenino) | 11/3 | 26/11 | 35/15 | 6/1 | 0.720 |
| Nivel medio de AST (U/L) ± SD | 64,9 ± 56,5 | 61,1 ± 38,6 | 49,9 ± 28,3 | 122.4 ± 168,7 | 0,474 |
| Nivel medio de ALT (U/L) ± DE | 116,7 ± 112,4 | 114,6 ± 91,1 | 91,5 ± 63,8 | 259,1 ± 447.6 | 0,651 |
| Genotipo del VHB (B/C) | 10/4 | 15/19 | 22/28 | 1/6 | 0,085 |
| Precore: G1896/A1896 | 0/14 | 3/31 | 4/46 | 0/7 | 0.594 |
| BCP:* mutante/salvaje | 4/10 | 4/30 | 12/38 | 6/1 | 0.001 |
| ADN del VHB (log copias/mL) | 3,9 ± 1,0 | 4.5 ± 0,5 | 4,4 ± 0,7 | 3,6 ± 0,5 | 0,001 |
| Nivel de HBsAg ((log IU/mL) | 8,2 ± 1.1 | 8,9 ± 0,7 | 8,7 ± 1,1 | 6,9 ± 1,5 | |
| Grado de necroinflamación de Knodell ± SD | 4.2 ± 2.9 | 4.2 ± 3.3 | 4.7 ± 2.7 | 8.6 ± 2.0 | 0.003 |
| Estado de fibrosis de Ishak ± DE | 1,9 ± 1,9 | 1,9 ± 1,9 | 1,5 ± 1,3 | 4,1 ± 1,5 | 0.007 |
Mutante, T1762 y A1764; salvaje, A1762 y T1764. Se utilizó la prueba de la χ2 para las variables de género, genotipo del VHB, mutaciones del precordio y del promotor del núcleo basal, mientras que la prueba de la U de Mann-Whitney se utilizó para otras variables. AST: aspartato aminotransferasa. ALT: alanina aminotransferasa. BCP: promotor del núcleo basal. VHB: virus de la hepatitis B.
Nivel de expresión del HBsAg
La figura 2A a 2D muestra la ilustración de la medición semicuantitativa de la expresión del HBsAg. En este estudio no hubo ningún paciente con una escala 4+ de expresión de HBsAg. Se observó una relación recíproca entre la replicación viral y la histología hepática. Los pacientes con escalas 2+/3+ de expresión de HBsAg tenían niveles más bajos de títulos de HBsAg y niveles de ADN del VHB, pero un grado de necroinflamación y un estadio de fibrosis significativamente más graves que los pacientes con escala 1+ de expresión de HBsAg y tinción negativa de HBsAg (figura 2E). Aquellos pacientes que presentaban una puntuación de grado de necroinflamación de Knodell ≥ 5 o un estadio de fibrosis de Ishake ≥ 1 tenían porcentajes significativamente mayores de expresión de HBsAg (Figura 3).
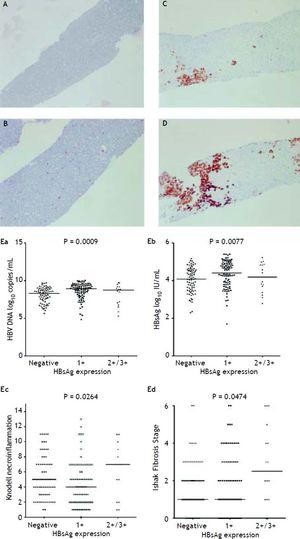
Expresión de HBsAg medida semicuantitativamente según la proporción de células inmunomarcadas, en una escala de 0 a 3+, que corresponde a la positividad en (A) 0% (0), (B) 1-10% (C) 11-25% (2+), y (D) 25-50% (3+) de los hepatocitos examinados. Correlaciones entre el nivel de expresión del HBsAg y los niveles séricos de ADN del VHB (Ea) y HBsAg (Eb), y el grado de necroinflamación de Knodell (Ec) y el estadio de fibrosis de Ishak (Ed). Las comparaciones entre grupos se analizaron mediante ANOVA de Kruskal-Wallis.

Correlación de la expresión del HBsAg intrahepático con el grado de necroinflamación de Knodell (A) y el estadio de fibrosis de Ishak (B). Las comparaciones entre grupos se analizaron mediante la prueba U de Mann-Whitney.
Características clínicas de la expresión del HBsAg
En primer lugar, se examinó la asociación de los factores virales y la expresión del HBcAg/HBsAg. La expresión del HBsAg, y no la del HBcAg, mostró un nivel significativamente menor en presencia de la mutación del precordio (P = 0,001). Los pacientes con genotipo C mostraron un mayor estadio de fibrosis hepática (P = 0,004). En los pacientes con mutaciones BCP T1762/A1764, hubo un grado de necroinflamación y un estadio de fibrosis significativamente mayores, así como una menor expresión de HBcAg tanto en el citoplasma como en el núcleo. Todas estas observaciones indicaban una lesión hepática activa. Además, los pacientes con mutaciones BCP T1762/A1764 presentaban una mayor expresión de HBsAg intrahepático (9,3 ± 8,0% frente a 4,3 ± 5,0%, P = 0,008) (Tabla 3). Además, examinamos los factores que pueden asociarse con los niveles de expresión del HB-sAg. En la tabla 4, había 16 pacientes que presentaban escalas 2+/3+ de expresión de HBsAg y 1+ en la de 89 pacientes. Un análisis univariante mostró que las escalas 2+/3+ de expresión del HBsAg estaban asociadas a las mutaciones BCP T1762/A1764, y a una necroinflamación y fibrosis hepática más graves. Un análisis de regresión multivariante reveló que las mutaciones BCP T1762/A1764 eran el factor independiente que se asociaba con escalas 2+/3+ de expresión de HBsAg intrahepático.
Características clínicas, virológicas e histológicas de los pacientes con o sin mutantes virales.
| Mutación en el núcleo | Valor P | Mutaciones en el BCP | Valor P | |||
|---|---|---|---|---|---|---|
| No (n = 98) | Sí (n = 7) | Sí (n = 26) | ||||
| Edad (años) ± SD | 37.8 ±11.0 | 40.0 ± 13.7 | 0.541 | 36,0 ± 10,6 | 43,8 ±11,1 | 0,005 |
| Género (masculino/femenino) | 70/28 | 5/2 | 1,000 | 54/25 | 21/5 | 0.318 |
| Nivel medio de AST (U/L) ± SD | 60,0 ± 58,3 | 71,3 ± 30,5 | 0,072 | 51,5 ± 32,1 | 87,3 ± 95.6 | 0,007 |
| Nivel medio de ALT (U/L) ±SD | 112,2 ± 143,6 | 131,6 ± 39,1 | 0,031 | 98,2 ± 77,9 | 160,0 ± 242.0 | 0,080 |
| Genotipo del VHB (B/C) | 45/53 | 3/4 | 1,000 | 44/35 | 4/22 | |
| Precore: G1896/A1896 | 6/73 | 1/25 | 0,678 | |||
| BCP:* mutante/salvaje | 25/73 | 1/6 | 0.678 | |||
| ADN del VHB (copias log/mL) | 3,9 ± 1,0 | 4,5 ± 0.5 | 0,959 | 4,5 ± 0,6 | 3,7 ± 0,6 | |
| Nivel de HBsAg ((log IU/mL) | 8.2 ± 1,1 | 8,9 ± 0,7 | 0,892 | 8,8 ± 0,9 | 7,7 ± 1,4 | |
| Grado de necroinflamación de los nódulos ± DE | 4,6 ± 3,0 | 6.1 ± 3,1 | 0,142 | 3,9 ± 2,7 | 7,2 ± 2,7 | |
| Estado de fibrosis de Shak ± SD | 1,8 ± 1,8 | 2,1 ± 0,9 | 0.286 | 1,3 ± 1,4 | 3,4 ± 1,6 | |
| Expresión citoplasmática de HBcAg (%) | 53,6 ± 25,8 | 44,3 ± 30,5 | 0,402 | 56,3 ± 25.4 | 42,7 ± 25,8 | 0,018 |
| Expresión nuclear de HBcAg (%) | 13,5 ± 17,3 | 17,6 ± 31,6 | 0,800 | 17,6 ± 20,0 | 2,3 ±4.1 | |
| Expresión de HBsAg (%) | 5,8 ± 6,5 | 2,4 ± 1,5 | 0,274 | 4,3 ± 5,0 | 9,3 ± 8,0 | 0.003 |
Mutante, T1762 y A1764; salvaje, A1762 y T1764. Se utilizó la prueba de la χ2 para las variables de género, genotipo del VHB, mutaciones del precordio y del promotor del núcleo basal, mientras que la prueba de la U de Mann-Whitney se utilizó para otras variables. AST: aspartato aminotransferasa. ALT: alanina aminotransferasa. BCP: promotor del núcleo basal. VHB: virus de la hepatitis B.
La asociación de las características demográficas y los grados de expresión del HBsAg.
| Univariante | Multivariante | ||||
|---|---|---|---|---|---|
| Expresión de HBsAg, escala | 1+ (n = 89) | 2+/3+ (n = 16) | Valor P | Razón de probabilidad (IC 95%) | Valor P |
| Edad | 38.2 ±11.2 | 36.6 ±11.1 | 0.608 | 0,963 (0,903-1,026) | 0,242 |
| Género (masculino/femenino) | 63/26 | 12/4 | 1.000 | ||
| Nivel de AST (U/L) | 55,0 ± 37,7 | 90,4 ± 113,2 | 0,234 | 1,026 (0,991∼1.063) | 0,142 |
| Nivel de ALT (U/L) | 103,3 ± 84,4 | 170,1 ± 297,2 | 0,386 | 0,991 (0,978∼1.005) | 0,216 |
| Genotipo del VHB (B/C) | 42/47 | 6/10 | 0,589 | 0,994 (0,234∼4,231) | 0.994 |
| Mutación del núcleo A1896 (+/-) | 7/82 | 0/16 | 0,592 | 0,000 (0,000∼) | 0.999 |
| BCP:*mutante/salvaje | 17/72 | 9/7 | 0,003 | 6,356 (1,204∼33,356) | 0.029 |
| Nivel de HBsAg (log10IU/mL) | 4,3 ± 0,7 | 4,2 ± 0,8 | 0,180 | 2,096 (0,598∼7,349) | 0.247 |
| ADN del VHB en suero (log10 copias/mL) | 8,6 ± 1,1 | 8,1 ± 1,4 | 0,135 | 0,731 (0,386∼1,383) | 0.335 |
| Grado de necroinflamación de Knodell | 4,4 ± 2,9 | 6,3 ± 3,3 | 0,027 | ||
| Estado de fibrosis de Ishak | 1.7 ± 1,6 | 2,9 ± 2,1 | 0,041 | ||
| Expresión citoplasmática de HBcAg (%) | 53.1 ± 25,8 | 52,3 ± 28,5 | 0,915 | ||
| Expresión nuclear de HBcAg (%) | 14,4 ± 18,3 | 10.1 ± 19,3 | 0,389 | ||
Mutante, T1762 y A1764; salvaje, A1762 y T1764. Análisis univariante: se utilizó la prueba de χ2 para las variables de sexo, genotipo del VHB, mutaciones del promotor del núcleo precordillerano y del núcleo basal, mientras que la prueba U de Mann-Whitney se utilizó para las demás variables. Análisis multivariado: Análisis de regresión logística expresado como Odds ratio con un intervalo de confianza del 95% y valores P. AST: aspartato aminotransferasa. ALT: alanina aminotransferasa. BCP: promotor del núcleo basal. VHB: virus de la hepatitis B.
Discusiones
La expresión del HBsAg intrahepático se asocia a diferentes estadios replicativos y a la evolución de la enfermedad durante el curso natural de la hepatitis B crónica.7,10,23 El GGH de tipo I se presenta predominantemente en la fase de hepatitis activa, mientras que el GGH de tipo II se presenta principalmente en la fase inactiva o de cirrosis.8 En este estudio demostramos que el GGH de tipo II se asocia con una histología hepática más grave, acompañada de niveles de ADN del VHB y títulos de HBsAg en suero significativamente más bajos, y niveles relativamente más altos de expresión de HBsAg intrahepático. Esta relación recíproca entre la histología hepática y la replicación del VHB indica que la aparición del GGH de tipo II podría ser un marcador de enfermedad hepática avanzada durante la evolución de la enfermedad en la hepatitis B crónica positiva al HBeAg. Se ha informado de que los patrones de expresión del HB-sAg están relacionados con distintas mutaciones víricas que repercuten en la regulación de la replicación del VHB y en el defecto de secreción del antígeno de superficie de los hepatocitos.9,24 El GGH de tipo II albergaba sistemáticamente mutaciones de deleción Pre-S2 que disminuían la síntesis de proteínas de superficie medias y luego daban lugar a la acumulación de grandes proteínas de superficie en los hepatocitos y al defecto de secreción de HBsAg.25 En este estudio realizamos una correlación del HBsAg sérico y del ADN del VHB entre los pacientes con o sin GGH de tipo II. Se observó una correlación moderada entre los dos indicadores de replicación del VHB en los pacientes sin GGH de tipo II (r = 0,686, P 26,27 La deleción de Pre-S podría conducir al estrés del RE y activar la transducción de señales relacionadas con el estrés. El daño oxidativo del ADN de los hepatocitos y la posterior estimulación de los mecanismos de reparación del ADN podrían dar lugar a una inestabilidad genómica que empeora el daño hepático y predispone a la carcinogénesis.28
Además de los patrones de expresión del HBsAg, encontramos que los niveles de expresión más elevados se acompañan de actividades histológicas hepáticas más graves y de una mayor tasa de mutaciones BCP T1762/A1764. Las mutaciones BCP T1762/A1764 están fuertemente asociadas a actividades histológicas hepáticas graves y al cáncer de hígado.29,30 Hasta donde sabemos, existe una fuerte relación entre el genotipo C y la presencia de mutaciones BCP T1762/ A1764.30 En este estudio, el genotipo C no parecía desempeñar ningún papel en el nivel de expresión del HBsAg. En cambio, las mutaciones BCP T1762/A1764 mostraron una fuerte relación con la expresión del HBsAg. Con respecto a la mutación viral, las mutaciones BCP T1762/A1764 pueden proporcionar las bases para otras mutaciones del VHB, incluida la deleción pre-S y los mutantes complejos que se encuentran con frecuencia en presencia de las mutaciones BCP T1762/ A1764. Los mutantes complejos del VHB mostraron defectos parciales o completos en la expresión y secreción de la proteína e, del núcleo y de la superficie.31 La reducción de la secreción del antígeno de superficie de la hepatitis B se correlacionó con la localización aberrante de las proteínas de superficie en el RE y dio lugar a una elevada expresión del HBsAg. Además, se considera que la mutación BCP T1762/A1764 es una consecuencia de la aptitud viral debido a la presión de selección de la vigilancia inmunitaria del huésped. Del mismo modo, las mutaciones pre-S2, que se alojan en los GGH de tipo II, coinciden con los epítopos de células T y B restringidos por el antígeno leucocitario humano.32 Por lo general, no hay necrosis celular ni infiltración de linfocitos T alrededor de los GGH de tipo II, lo que sugiere que el VHB con la aparición de la mutación de deleción pre-S2 es también un mutante de escape posiblemente novedoso.33 Sin embargo, la acumulación del antígeno de superficie en los hepatocitos podría producirse sin ser portador de ninguna de las mutaciones virales conocidas en los genomas pre-S o S o en los promotores de superficie.31,34 Por lo tanto, la expresión del HBsAg podría ser una secuencia en asociación con las mutaciones virales o sin ellas.
Este estudio tenía varias limitaciones potenciales. Las observaciones de este estudio se basaron en un diseño transversal retrospectivo, pero no se realizó un seguimiento longitudinal. El nivel de expresión del HBsAg en los hepatocitos y la gravedad histológica pueden variar entre diversas partes del hígado en un mismo paciente; la biopsia hepática per se no puede representar con exactitud ningún tejido hepático, excepto el núcleo de la biopsia.
En resumen, los pacientes que presentaban un patrón GGH de tipo II o niveles más altos de expresión del HBsAg intrahepático mostraban la relación recíproca entre actividades histológicas hepáticas más graves y una menor capacidad de replicación del VHB. La fuerte asociación entre la expresión de HBsAg intrahepático y las mutaciones BCP T1762/A1764 indicaba que la expresión de HBsAg posiblemente podría considerarse como la manifestación histológica durante la evolución genómica del VHB bajo la presión inmunitaria del huésped.
Abreviaturas
- –
BCP: promotor del núcleo basal.
- –
GGH: hepatocito de vidrio molido.
- –
HBcAg: antígeno del núcleo de la hepatitis B.
- –
HBeAg: antígeno e de la hepatitis B.
- –
HBsAg: antígeno de superficie de la hepatitis B.
- –
HBV: virus de la hepatitis B.
Conflictos de intereses
T.-T. C. ha recibido financiación para investigación de Gilead Sciences, Bristol-Myers Squibb Company, Glaxo-SmithKline, Merck Sharp & Dohme (I.A.) Corporation y Pfizer Inc. Los demás autores no tienen ningún conflicto de intereses.