En Exelead, abordamos la fabricación por contrato con una experiencia centrada en las formulaciones liposomales y PEGiladas para tratar enfermedades raras y poblaciones pequeñas o desatendidas. Estamos especializados en el desarrollo y la fabricación de productos farmacéuticos parenterales basados en lípidos, y nuestro equipo cuenta con más de 20 años de experiencia trabajando con una amplia gama de clientes de fabricación por contrato preclínica, clínica y comercial.
¿Qué son los liposomas y cómo se utilizan en la administración de fármacos?
Los liposomas son vehículos de administración especializados que cumplen múltiples funciones para mejorar las capacidades de los ingredientes farmacéuticos activos (API). En primer lugar, pueden proteger un fármaco de la detección del sistema inmunitario del organismo, imitando las membranas biológicas y dando al fármaco más tiempo para llegar a su destino. En segundo lugar, sirven para ayudar a solubilizar moléculas de fármacos altamente lipofílicos o para modular la farmacocinética y la biodistribución del API, ayudando así a minimizar los efectos secundarios y a mejorar el perfil de seguridad del producto.
Los liposomas poseen una estructura vesicular única. Estas vesículas están compuestas por una bicapa lipídica que se forma en forma de esfera hueca que abarca una fase acuosa. Como tal, cualquier carga de interés puede encapsularse dentro de los liposomas, ya sea en el compartimento acuoso (si es hidrosoluble/hidrófilo) o dentro de la bicapa lipídica (si es liposoluble/lipófilo).
Algunos de los lípidos primarios utilizados para hacer liposomas son los fosfolípidos y los esfingolípidos. Estas dos categorías de lípidos son únicas en cuanto a un grupo de cabeza que es amante del agua/hidrófilo y un grupo de cola que es amante del agua/lipófilo. Debido a su naturaleza anfifílica, estas moléculas se autoensamblan espontáneamente para formar liposomas y otras estructuras 3D únicas cuando se añaden a soluciones acuosas. La forma o morfología de las estructuras 3D depende de una serie de factores diferentes -por ejemplo, la composición lipídica, la temperatura, el pH o la presencia de otros tampones, sales y azúcares en el agua.

Fuente de la imagen: Chem Libre Texts
¿Cómo interactúa un fármaco con el cuerpo y está disponible para su uso cuando se formula como un producto farmacológico liposomal?
En los últimos años, los liposomas han atraído una atención significativa como una clase confiable de vehículos de entrega de medicamentos. Sus estructuras autocerradas pueden encapsular múltiples fármacos a la vez, protegiendo la carga encerrada de la hidrólisis y la descomposición. Además, las proteínas de orientación y los ligandos funcionales de superficie en la capa exterior de la bicapa lipídica pueden añadir una nueva funcionalidad, permitiendo la entrada selectiva de los liposomas en las células, ya sea a través de anticuerpos o de ligandos dirigidos a receptores. Estos ligandos se unen a los receptores celulares que están sobreexpresados en ciertas células enfermas, permitiendo la entrada del fármaco a través de la membrana celular.
«Los liposomas protegen a las moléculas de fármacos cargados de la degradación externa, y su similitud con las membranas biológicas proporciona oportunidades únicas para entregar moléculas de fármacos en las células o compartimentos subcelulares … Además, varias propiedades fisicoquímicas de los liposomas -incluyendo su tamaño, carga y ligandos funcionales de superficie- pueden alterarse, dando lugar a funcionalidades que favorecen tareas específicas de administración de fármacos. Estas ventajas han convertido a los liposomas en una plataforma líder de administración de fármacos con una amplia gama de usos en la clínica.»
– Nanoestructuras similares a liposomas para la administración de fármacos | Gao W, Hu C-MJ, Fang RH, Zhang L 1
Típicamente, los liposomas se fabrican como inyectables estériles para su administración en el torrente sanguíneo, y la liberación del fármaco tiene lugar cuando las envolturas lipídicas se rompen-lo que puede ocurrir en entornos extracelulares o intracelulares.
Se han empleado diversas estrategias para diseñar liposomas convencionales con capacidad de liberación desencadenada, mejorando la eficacia terapéutica al hacer que los liposomas liberen el API o «carga» encapsulada en función de un estímulo. Esta liberación es impulsada por la descomposición convencional de los liposomas, o por estímulos activos y señales ambientales, como la energía térmica, el gradiente de pH y la tensión de cizallamiento.1
Las formulaciones orientadas a la liberación en entornos intracelulares pueden incluir lípidos sensibles al pH que cambian la estructura liposomal o se degradan dentro de los compartimentos ácidos, permitiendo la liberación del fármaco encapsulado. Alternativamente, a veces se incluyen componentes termosensibles o fotosensibles para permitir la descomposición y la modulación de la estructura debido a los cambios de temperatura o a la reacción a la luz de ciertas longitudes de onda.
Los portadores de fármacos tipo liposoma pueden presentarse en muchas variedades diferentes, exhibiendo una amplia gama de propiedades bioquímicas y biofísicas. Si bien esto es ventajoso y permite que estas partículas basadas en lípidos asuman aplicaciones útiles en cientos de entornos diferentes, el número de variaciones potenciales hace que sea imperativo un control riguroso de la fabricación.2
Exelead lleva fabricando fármacos basados en lípidos desde principios de la década de 1990, comenzando con Abelcet. La anfotericina B, el principio activo de Abelcet, se mantiene dentro de un complejo lipídico y se fusiona selectivamente con las membranas de los hongos para dirigirse a las células enfermas.
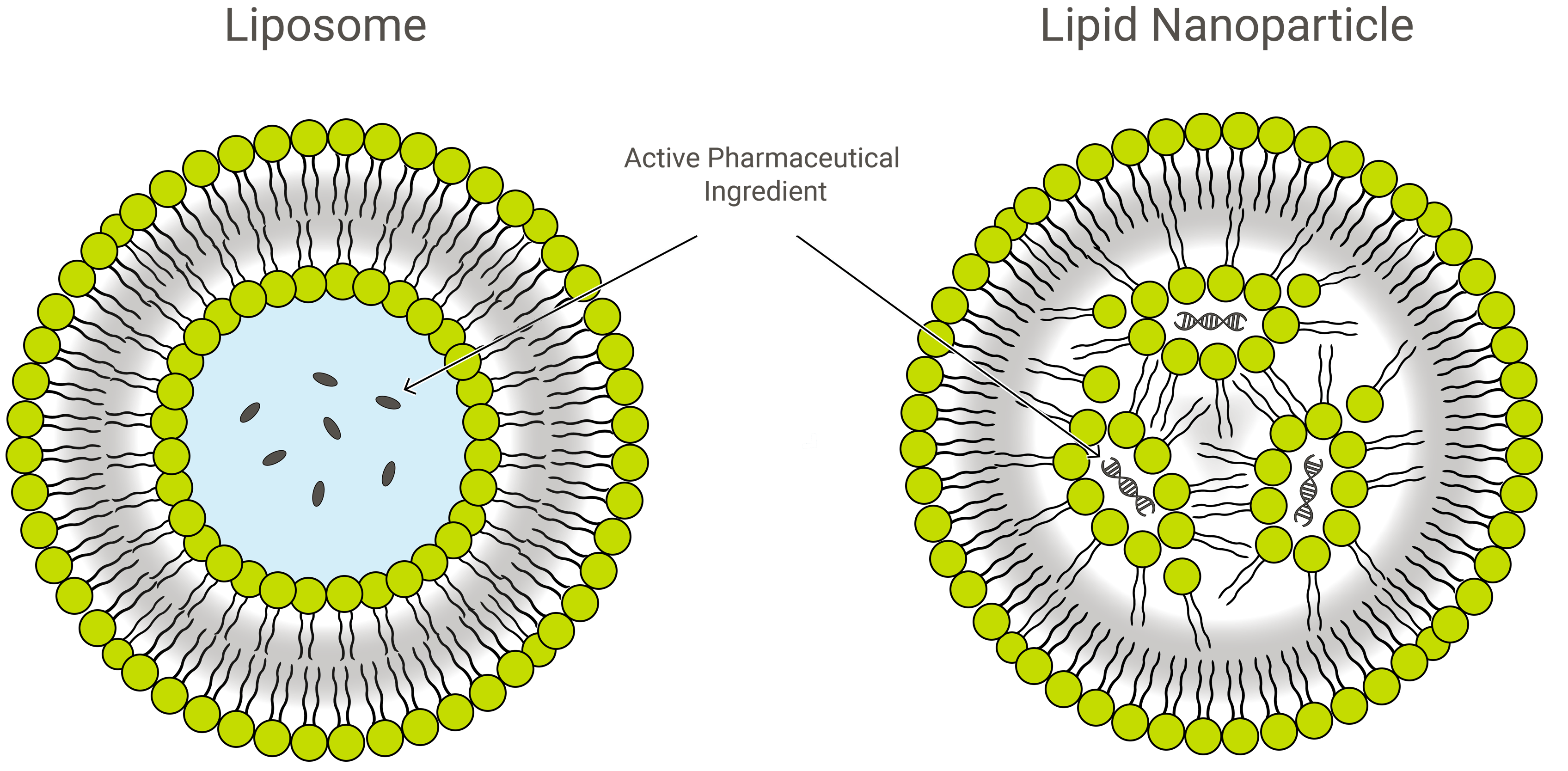
Liposomas frente a nanopartículas lipídicas
Los liposomas y las nanopartículas lipídicas (LNP) son similares por su diseño, pero ligeramente diferentes en cuanto a su composición y función. Ambas son nanoformulaciones lipídicas y excelentes vehículos de administración de fármacos, que transportan la carga de interés dentro de una capa exterior protectora de lípidos. En la aplicación, sin embargo, las LNP pueden adoptar una variedad de formas.
Las LNP son estructuras similares a los liposomas especialmente orientadas a encapsular una amplia variedad de ácidos nucleicos (ARN y ADN); y como tales, son el sistema de administración de genes no virales más popular. Exelead desarrolla y fabrica LNPs para encapsular diferentes tipos de cargas genéticas, incluyendo siRNA, mRNA y saRNA.
Liposomas tradicionales incluyen uno o más anillos de bicapa lipídica que rodean una bolsa acuosa, pero no todas las LNPs tienen una bicapa contigua que las califique como vesículas lipídicas o liposomas. Algunas LNP adoptan una estructura similar a la de las micelas, encapsulando moléculas de fármacos en un núcleo no acuoso.
Pegilación de LNP y estructuras de administración de fármacos similares a los liposomas
Las LNP se componen principalmente de lípidos catiónicos (véase la terapia génica más adelante) junto con otros ingredientes lipídicos. Estos suelen incluir moléculas de fosfolípidos neutros pertenecientes a la clase de la fosfatidilcolina (PC) y esteroles, como el colesterol. Otro ingrediente lipídico común es lo que se conoce como fosfolípido PEGilado-un polímero de polietilenglicol (PEG) unido covalentemente al grupo de cabeza de un fosfolípido.

Los fosfolípidos PEGilados se utilizan en muchos portadores de fármacos basados en lípidos principalmente porque ofrecen lo que se conoce como un efecto de ocultación del producto farmacéutico mientras circula dentro del cuerpo. El sistema inmunitario humano se empeña en proteger al organismo de cualquier objeto extraño, y las nanopartículas medicinales no son una excepción. Para contribuir a la eficacia de la administración y permitir que las moléculas lleguen a los lugares donde se encuentran las enfermedades, se añade PEG para proteger estas nanopartículas evitando que las proteínas del plasma sanguíneo se absorban en la superficie del liposoma, lo que aumenta la duración de la circulación en el torrente sanguíneo.1
La segunda ventaja de la PEGilación es el aumento de la estabilidad de las nanoestructuras similares a los liposomas. Los liposomas convencionales, especialmente los de tamaño inferior a 200 nm, pueden ser inestables por sí solos y tienden a fusionarse entre sí para reducir la tensión superficial. Esto puede provocar la pérdida del fármaco encapsulado o la mezcla desfavorable de la carga de las diferentes vesículas. Una de las formas en que los fabricantes de fármacos han aprendido a superar este problema es cubriendo el exterior de los liposomas con polímeros como el PEG.
Estas nanopartículas equipadas de forma sigilosa han dado lugar a una nueva generación de formulaciones liposomales y a múltiples productos aprobados clínicamente. Los liposomas y las LNP con PEG son actualmente el nuevo paradigma para la mayoría de las terapias contra el cáncer.
Las LNP en la terapia génica
Durante mucho tiempo, la forma más eficaz de administrar terapias basadas en genes a las células humanas era utilizar un virus modificado para transportar una carga medicinal en lugar de genes dañinos y autorreplicantes. Este método se sigue utilizando ocasionalmente en la actualidad y se denomina administración de genes virales. Sin embargo, la administración de genes no virales se ha popularizado en los últimos 20 años debido a la mejora de los perfiles de seguridad, la menor tasa de reacciones inmunológicas adversas y la facilidad de fabricación. Uno de los principales impulsores de este movimiento ha sido el desarrollo de portadores basados en lípidos y polímeros, de los cuales las LNP son los más populares.
Las LNP utilizadas para liberar genes se sintetizan principalmente utilizando lípidos catiónicos, o cargados positivamente, que se asocian con ácidos nucleicos aniónicos, o cargados negativamente. También se pueden añadir otros componentes basados en lípidos para modular la eficacia de la entrega y la liberación de la carga genética. Las LNP también proporcionan estabilidad mecánica, una morfología controlada y una distribución de tamaño reducida.1
Se han explorado materiales inorgánicos, materiales orgánicos e hidrogeles como núcleos de nanopartículas liposomales, encapsulados dentro de un número variable de capas de lípidos que forman la cubierta. Una de las variantes más exitosas de estas nanopartículas híbridas incorpora polímeros PLA o PGLA dentro de una monocapa lipídica. Estos dos biopolímeros centrales son especialmente útiles en la administración de fármacos porque facilitan la liberación controlada de los mismos.1

La formulación de nanopartículas mostrada arriba es un híbrido de lípido-polímero con un núcleo de PGLA hidrofóbico y una cubierta de lípido-PEG hidrofílica.
Un campo en expansión
«Los liposomas han recorrido un largo camino para convertirse en una clase de portadores de fármacos validados… Se está desarrollando una variedad cada vez mayor de nanoestructuras parecidas a los liposomas, cada una de ellas con ventajas únicas adecuadas para tareas específicas de administración de fármacos. Mientras tanto, la comprensión de las interacciones entre estas nanoestructuras y los sistemas biológicos avanza rápidamente. Se ha obtenido una gran cantidad de información sobre su tiempo de circulación, su acumulación en los tejidos y su potencial toxicidad. Es seguro que los nanotransportadores similares a los liposomas desempeñarán un papel más importante en la administración de fármacos en un futuro próximo»
– Nanoestructuras similares a los liposomas para la administración de fármacos | Gao W, Hu C-MJ, Fang RH, Zhang L 1
Aunque se está trabajando mucho en el desarrollo de agentes medicinales nanocompartimentados de liberación controlada, los liposomas y las LNP son opciones especialmente prometedoras. Estas estructuras proporcionan una morfología única, naturalmente estable y similar a la de las células para los nanomedicamentos, y están preparadas para avanzar hacia estrategias terapéuticas más avanzadas. Exelead está asumiendo estos retos, incluido el desarrollo de nanogeles que incorporan una serie de productos biológicos y pequeñas moléculas.
Desde que se propusieron por primera vez los liposomas como sistema de administración de fármacos a finales de la década de 1960, han surgido variaciones en su estructura y funcionalidad, lo que ha proporcionado valiosos avances en términos de focalización de enfermedades. Los fármacos LNP han aparecido en la industria farmacéutica como terapias diseñadas para administrar agentes anticancerígenos, antibióticos, medicamentos genéticos, anestésicos y antiinflamatorios.3
«En las aplicaciones clínicas, los fármacos liposomales han demostrado ser más útiles por su capacidad de acumularse «pasivamente» en los lugares de mayor permeabilidad de la vasculatura, cuando su diámetro medio está en el rango ultrafiltrable (<200 nm de diámetro), y por su capacidad de reducir los efectos secundarios de los fármacos encapsulados en relación con los fármacos libres. Esto ha dado lugar a un aumento global del índice terapéutico, que mide la eficacia sobre la toxicidad.»
– Sistemas de administración de fármacos liposomales: del concepto a las aplicaciones clínicas | Allen TM, Cullis PR 3
Aplicaciones en la medicina personalizada: una nueva era en las estrategias terapéuticas
En contraste con los enfoques tradicionales de las grandes farmacéuticas para el tratamiento de las enfermedades, la medicina personalizada tiene en cuenta las diferencias individuales en el estilo de vida, el entorno y la biología, incluida la genética del paciente.
Esto es extremadamente aplicable a enfermedades como el cáncer. Incluso dentro de un mismo tipo de cáncer, los tipos de tumores difieren de un paciente a otro, y la comprensión de la mutación genética concreta que ha desarrollado un paciente permite a los médicos emplear tratamientos más específicos y precisos.4
Con la llegada de las terapias genéticas personalizadas, los médicos y los científicos pueden adaptar eficazmente un ingrediente farmacéutico activo -a menudo el ARN o el ADN- para que coincida con el perfil específico de la enfermedad de un paciente concreto o de un pequeño grupo de pacientes. Este enfoque hiperespecífico de la enfermedad aumenta la eficacia y reduce los efectos secundarios no deseados en grupos de pacientes similares.
Las LNP como vehículos de administración de oligonucleótidos
Dado que gran parte del creciente campo de la medicina personalizada se centra en las terapias genéticas, las LNP se han vuelto especialmente útiles como plataforma de administración de fármacos. En teoría, cualquier oligonucleótido podría encapsularse en un liposoma o LNP, pero los siRNA son actualmente la carga más común en este tipo de productos farmacológicos.
En teoría, los segmentos de siRNA pueden diseñarse para silenciar cualquier gen, lo cual es un concepto emocionante tanto para los médicos como para los investigadores. Desgraciadamente, la administración de ARN libre y sin encapsular en las células humanas es difícil, ya que son grandes, inestables en el suero y propensos a la degradación por nucleasas.5
Aunque los investigadores han hecho intentos de estabilizar el ARNsi en el suero añadiendo enlaces de fosforotioato, se necesitan dosis elevadas para silenciar eficazmente los genes en los seres humanos. Las LNP han aportado una solución a este problema al proporcionar medios flexibles y fáciles de encapsulación, protegiendo los segmentos de ARNsi hasta que lleguen a su destino previsto y facilitando su entrega en las células diana.5
«Las LNP que contienen lípidos catiónicos ionizables tienen una serie de características necesarias para la entrega sistémica de ácidos polinucleicos, incluyendo tamaños pequeños, estabilidad en el suero, bajos potenciales zeta superficiales a pH fisiológico y carga catiónica a valores de pH ácido (por ejemplo, en endosomas). Además, al aprovechar los procesos de focalización «endógena» debido a la asociación con la ApoE tras la administración, se puede lograr una captación altamente eficiente en los hepatocitos tras la administración i.v., lo que conlleva una excelente capacidad de silenciamiento génico.»
– Sistemas de administración de nanopartículas lipídicas para terapias basadas en siRNA | Wan C, Allen TM, Cullis PR 5
Tamaños de lote más pequeños
Los productos farmacéuticos personalizados se fabrican a menudo en tamaños de lote pequeños para pacientes individuales o poblaciones pequeñas y pueden resultar frecuentemente en menos de un litro de producto. En cambio, los lotes tradicionales de fabricación de productos farmacéuticos convencionales suelen producir miles de litros de medicamento a escala. La medicina personalizada requiere un enfoque único, y cada lote debe ser fabricado bajo estrictas condiciones cGMP.
Como la medicina personalizada se ha convertido en un foco prominente en el desarrollo de fármacos, muchas empresas de la industria de fabricación de productos farmacéuticos han adaptado sus líneas de producción para dar cabida a lotes más pequeños destinados a pequeños grupos de pacientes, además de la producción tradicional de fármacos a gran escala.
En Exelead, se han hecho grandes esfuerzos para dar cabida a estas terapias de lotes pequeños, que a menudo requieren una API costosa y un tiempo de entrega rápido. Los medicamentos específicos para pacientes o antígenos no dejan mucho tiempo desde el momento en que el oligonucleótido es secuenciado hasta el momento en que el producto debe ser formulado en nuestro centro. Estas previsiones a corto plazo, a veces de sólo seis semanas, suponen un reto que hemos podido superar perfeccionando nuestros sistemas actuales e incorporando técnicas de formulación innovadoras.
Aplicaciones generalizadas
Aunque la medicina personalizada tiene el potencial de tratar casi cualquier enfermedad, la investigación actual se ha centrado principalmente en 1) inmunoterapias, 2) terapias convencionales aumentadas a través de la farmacogenómica y 3) tratamientos contra el cáncer relacionados con biomarcadores. Los liposomas y las LNP tienen aplicación como vehículos de entrega para cada una de estas categorías de medicamentos, lo que los convierte en un activo indispensable en este nuevo campo del desarrollo farmacéutico.

Artículos de referencia
- Gao W, Hu C-MJ, Fang RH, Zhang L. Liposome-like Nanostructures for Drug Delivery. Journal of materials chemistry B, Materials for biology and medicine. 2013;1(48):10.1039/C3TB21238F. doi:10.1039/C3TB21238F.
- Kraft JC, Freeling JP, Wang Z, Ho RJY. Tendencias emergentes de investigación y desarrollo clínico de los sistemas de administración de fármacos con liposomas y nanopartículas lipídicas. Revista de ciencias farmacéuticas. 2014;103(1):29-52. doi:10.1002/jps.23773.
- Theresa M. Allen, Pieter R. Cullis. Sistemas de administración de fármacos liposomales: Del concepto a las aplicaciones clínicas. Advanced Drug Delivery Reviews. 2013 Jan;65(1):36-48
- Esposito L. What Does Personalized Medicine Really Mean? US News: Health Care. 2018 Jan;
- Wan C, Allen TM, Cullis PR. Sistemas de entrega de nanopartículas lipídicas para terapias basadas en siRNA. Drug Deliv Transl Res. 2014 Feb;4(1):74-83. doi: 10.1007/s13346-013-0161-z.
- Vogenberg FR, Isaacson Barash C, Pursel M. Personalized Medicine: Parte 1: Evolución y desarrollo hacia la teranóstica. Pharmacy and Therapeutics. 2010;35(10):560-576.