Nos primeiros dias da química orgânica, os alcenos eram descritos como “insaturados” porque, em contraste com os alcanos “saturados”, eles reagiam prontamente com substâncias como halogênios, halogênios de hidrogênio, agentes oxidantes, e assim por diante. Portanto, a “afinidade química” dos alcenos foi considerada insatisfeita ou “insaturada”. (Veja também Seção 1-1I.)
Uma razão pela qual alcenos e alcinos reagem mais prontamente que alcanos é porque as ligações carbono-carbono de uma ligação múltipla são individualmente mais fracas que as ligações normais carbono-carbono simples. Considere as energias das ligações envolvidas. De acordo com a Tabela 4-3, as forças das ligações carbono-carbono simples, duplas e triplas são, respectivamente, 83 (83), 146 (146) e 200 (200): texto (kcal). A partir destes valores podemos calcular que a clivagem de metade de uma ligação dupla carbono-carbono deve requerer {(63: texto{kcal}) e a clivagem de um terço de uma ligação tripla carbono-carbono deve requerer {(54: texto{kcal}):

Como resultado, espera-se que as reacções de adição a ligações múltiplas sejam cerca de {20)-(30): \A diferença substancial nos aquecedores de reacção do etano, etileno e etino com bromo reflecte-se numa consideração prática muito importante no manuseamento do etino (acetileno), nomeadamente a sua estabilidade termodinâmica em relação ao carbono sólido e ao hidrogénio gasoso. Ao contrário do etano, tanto o eteno como o etino podem ser mostrados a partir de energias de ligação como sendo instáveis em relação à formação de carbono sólido e hidrogênio gasoso:
Embora isto não pareça oferecer problemas particulares com o eteno, pode ocorrer uma decomposição explosiva do etino ao carbono e hidrogênio se o gás for comprimido a \(10\)-(20 \: \texto{kg cm}^{-2}). Até mesmo o etino líquido (bp \sim 83 ^text{o}}) deve ser manuseado com cuidado. O etino não é usado comercialmente sob pressão, a menos que seja misturado com um gás inerte e manuseado em equipamento robusto. O etino queima com oxigênio puro para dar uma chama muito quente que é amplamente utilizada para a soldagem. Para este fim, o gás é dissolvido sob cerca de {15 }(15 {kg cm}^{-2}) em 2-propanona (acetona, 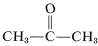 , bp {56,5 ^texto{o}) e contido em cilindros embalados com terra diatomácea.
, bp {56,5 ^texto{o}) e contido em cilindros embalados com terra diatomácea.
Por que é que o etino é muito menos estável que o eteno ou etano? Primeiro, as ligações não são tão fortes como as ligações de eteno. Portanto, normalmente é de esperar um ganho de estabilidade quando os laços são feitos à custa dos laços do eteno e do etano, cada um tem mais laços do que o eteno. Segundo, ethyne tem seis elétrons mantidos entre os dois carbonos e esses elétrons experimentam considerável repulsão intereletrônica mútua. Isto explica o facto da força média de ligação para a ligação tripla de um alqueno ser de 200/3 = 67: texto (kcal), comparado com 146/2 = 73: texto (kcal) para a ligação dupla de um alqueno e 83: texto (kcal) para uma ligação simples normal de um alqueno.
- John D. Robert e Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, segunda edição. W. A. Benjamin, Inc. (1977) , Menlo Park, CA. ISBN 0-8053-8329-8. Este conteúdo está protegido por direitos autorais sob as seguintes condições: “Você tem permissão para reprodução, distribuição, exibição e execução individual, educacional, de pesquisa e não-comercial deste trabalho em qualquer formato”