Kekulé Estrutura para Benzeno
Benzeno era conhecido por ter a fórmula molecular C6H6, mas a sua fórmula estrutural era desconhecida.
Se o benzeno fosse um hidrocarboneto insaturado em cadeia reta, deveria sofrer prontamente reações de adição (assim como outros alcenos e alcinos).
Por exemplo, bromo, Br2, deveria ser adicionado através da dupla ou tripla ligação como mostrado abaixo:
| reação de adição de estrutura de cadeia reta possível: | |||
| CH3-C≡C-C≡C-CH3 | + Br2 | → | CH3-CBr=CBr-C≡C-CH3 |
Mas, quando o bromo é adicionado ao benzeno a 25°C e 1 atm (101.3 kPa) pressão, nenhuma reação parece ocorrer.
Então, as possíveis estruturas para o benzeno envolvendo ligações duplas e/ou triplas dispostas em uma cadeia parecem mais improváveis, uma vez que estas devem sofrer reações de adição.
Se o bromo é adicionado ao benzeno na presença de FeBr3, ele sofre uma reação de substituição na qual um dos átomos de hidrogênio é substituído por um átomo de bromo para produzir um composto com a fórmula C6H5Br, como mostrado abaixo:
| reação de substituição conhecida: | ||||||||
| C6H6 | + Br2 | FeBr3 → |
C6H5Br | + HBr | ||||
A este respeito, O benzeno estava a comportar-se muito mais como um hidrocarboneto saturado (apenas ligações únicas entre átomos de carbono).
Então, a primeira estrutura proposta por Kekulé para o benzeno em 1865 não continha ligações duplas mas arranjou os 6 átomos de carbono num anel como mostrado abaixo:
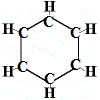
Kekulé percebeu que esta molécula quebra a regra da tetravalência para o carbono, ou seja, cada átomo de carbono está a formar apenas 3 ligações em vez de 4.
Então, em 1872 Kekulé propôs uma estrutura de benzeno composta por três ligações alternadas simples e duplas como se mostra abaixo:

Por favor note que embora os átomos de carbono não estejam escritos dentro da estrutura, é sempre entendido que existe um átomo cabon onde duas linhas do hexágono se juntam, de modo que existem 6 “junções”, 6 ângulos, e portanto 6 átomos de carbono.
Nesta estrutura cada átomo de carbono está ligado a um átomo de hidrogênio, e, a dois outros átomos de carbono. Uma das ligações carbono-carbono é uma ligação única, a outra ligação carbono-carbono é uma ligação dupla. Cada átomo de carbono fez 4 ligações.
Embora esta estrutura não explique porque é que o benzeno não sofre reacções de adição, pode explicar porque é que o benzeno forma apenas um isómero estrutural quando o benzeno reage com o bromo numa reacção de substituição, como se mostra abaixo:
 estrutura de benzeno proposta |
+ Br2 | → |  apenas 1 isómero estrutural |
+ HBr |
As outras estruturas anulares propostas para o benzeno teriam previsto mais de um isómero estrutural para o produto da reacção de substituição, como mostrado abaixo:
| outra proposta de reacção de estrutura em anel: | 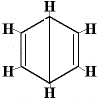 |
Br2 → |
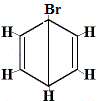 isómero estrutural 1 |
+ | 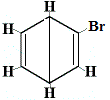 isómero estrutural 2 |
O que aconteceria se outro átomo de hidrogénio fosse substituído (substituído) por um átomo de bromo?
| C6H5Br | + Br2 | FeBr3 → |
C6H4Br2 | + HBr |
Quantos isómeros estruturais de C6H4Br2 seriam produzidos?
 |
Br2 → FeBr3 |
 isómero estrutural 1 |
+ | 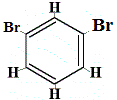 isómero estrutural 2 |
+ | 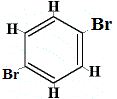 isómero estrutural 3 |
+ |  isómero estrutural 4 |
isómeros estruturais 1 e 4 são diferentes porque no isómero 1 os dois átomos de Br estão ligados a átomos de carbono num CLigação C, enquanto no isómero 4 os dois átomos de Br são ligados a átomos de carbono na ligação C=C.
No entanto, quando o C6H5Br feito de benzeno reage com bromo numa reacção de substituição, apenas 3 isómeros estruturais de C6H4Br2 são produzidos!
Para resolver este problema, Kekulé propôs que o anel de benzeno esteja em rápido equilíbrio entre estruturas nas quais as ligações duplas se encontram nas posições alternativas, como se mostra abaixo:
 |
⇋ | 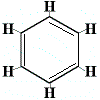 |
Assim, quando o bromo reage com C6H5Br numa reacção de substituição para produzir C6H4Br2, os pares de isómeros estruturais de C6H4Br2 estão em equilíbrio um com o outro.
Isto significa que os isómeros estruturais 1 e 4 mostrados acima, que diferem apenas no facto dos átomos de Br estarem ligados através de uma ligação simples ou dupla, estão agora em equilíbrio rápido entre si como se mostra abaixo:
| Br átomos em átomos C adjacentes, isómero estrutural 1 tem átomos de Br em C-C isómero estrutural 4 tem átomos de Br em C=C |
 isómero estrutural 1 |
⇋ |  isómero estrutural 4 |
De acordo com Kekulé, estes dois isómeros estruturais de C6H4Br2 estão em equilíbrio tão rápido que não podem ser separados como duas moléculas separadas, por isso parece que existem apenas 3 isómeros em vez de 4.
Embora esta estrutura de equilíbrio rápido para o benzeno, conhecida como estrutura Kekulé, provou ser útil, não explica a estabilidade única (falta de reactividade) do anel do benzeno, não explica porque é que o benzeno não sofre facilmente reacções de adição mas pode ser induzido a sofrer reacções de adição.
Compreende isto?
Junte AUS-e-TUTE!
Teste agora!