Introducción
La inmunofluorescencia (IF) utiliza anticuerpos y detección fluorescente para estudiar la localización, la expresión relativa y los estados de activación de las proteínas diana en células o tejidos fijados. La IF se utiliza ampliamente en diversos campos de estudio.
La IF puede utilizarse para responder a preguntas como:
- ¿Qué células o tejidos expresan mi(s) proteína(s) diana?
- ¿Cómo cambia la expresión y/o activación de mi proteína diana en respuesta a perturbaciones experimentales?
- ¿En qué parte de la célula/tejido está localizada la proteína diana?
- ¿Cuál es la relación espacial entre las diferentes proteínas diana en el contexto de la arquitectura celular o tisular?
La inmunofluorescencia engloba una serie de técnicas relacionadas que han evolucionado con el tiempo. Todas estas técnicas aprovechan el reconocimiento específico de las dianas biológicas mediante anticuerpos y la detección de reporteros fluorescentes en el análisis citométrico. Garantizar que la muestra biológica esté bien conservada mientras los antígenos diana son accesibles a los anticuerpos es importante, pero puede presentar retos que varían en función de la muestra, la diana y el anticuerpo.
En esta página, hemos recopilado recursos para ayudarle a navegar por los protocolos, responder a las preguntas más comunes y ayudarle a diseñar experimentos de IF con éxito.
Elegir la técnica y el protocolo de IF adecuados
La técnica/protocolo de IF óptima está influida por el tipo de material biológico, los pasos de procesamiento de la muestra, las propiedades del antígeno diana y el anticuerpo concreto que se utilice.
Las consideraciones incluyen:
- Los materiales de entrada pueden ser líneas celulares cultivadas, tejido congelado o tejido fijado en formol e incluido en parafina (FFPE).
- Para las líneas celulares cultivadas y las células primarias, busque anticuerpos validados para inmunofluorescencia-inmunocitoquímica (IF-IC).
- En muchos laboratorios, «inmunohistoquímica/IHC» se utiliza como un término general para incluir tejidos incluidos en parafina o congelados, y puede utilizarse para incluir la detección cromogénica y fluorescente. En cellsignal.com, las aplicaciones diferencian entre preparaciones de tejidos congelados (IF-F) e incluidos en parafina.
- Para las muestras de tejidos FFPE, los anticuerpos validados para inmunohistoquímica (IHC-P) también pueden utilizarse con detección fluorescente sin amplificación si el antígeno diana es abundante, o en IHC multiplexada (mIHC) con amplificación de la señal.
- Un anticuerpo puede estar validado para una o más de las aplicaciones enumeradas anteriormente. Las recomendaciones de los protocolos son el resultado de las pruebas realizadas por los científicos durante el proceso de validación.
- Los protocolos específicos de los productos pueden encontrarse en la página web de cada uno de ellos. Para los anticuerpos validados por IF, seleccione «IF» en la página del producto para ver los datos de validación de IF y el protocolo. La información básica (diluciones/concentración de trabajo, aplicaciones validadas, reactividad de las especies, especies huésped) para cada anticuerpo se incluye en la hoja de datos del producto.
- Los protocolos de IF más utilizados también se pueden encontrar en la página de protocolos.
- ¿No necesita o no quiere utilizar la detección por fluorescencia para sus muestras de tejido? Un enfoque alternativo es la detección cromogénica, tratada en la página de IHC.
Elegir anticuerpos para la IF: la importancia de la validación de anticuerpos
Los mejores anticuerpos producen una señal fuerte y específica con un fondo mínimo. Es importante elegir anticuerpos que hayan sido validados en la aplicación que vaya a utilizar. La validación de anticuerpos en IF puede incluir experimentos de expresión positiva y negativa (utilizando líneas celulares knockout, modelos genéticos, CRISPR o RNAi), la manipulación experimental de la localización de la proteína diana o las modificaciones postraduccionales, y la optimización del protocolo.
El rendimiento de un anticuerpo varía según la aplicación. Un anticuerpo que funciona bien en un experimento de western blot, por ejemplo, puede o no funcionar en IF. Durante las pruebas de nuevos anticuerpos, algunos mostrarán una unión menor fuera del objetivo; estos nunca se recomiendan para la IF u otras aplicaciones que no sean de WB. Además, un anticuerpo puede funcionar bien en tejido congelado pero no en tejido FFPE, o viceversa. La sensibilidad y el rendimiento del anticuerpo pueden cambiar dependiendo de cómo se fije y procese la muestra y de las condiciones de trabajo del anticuerpo.
Una vez que haya decidido qué tipo de muestras biológicas va a utilizar en su experimento y cómo se van a preparar, la forma más fácil de buscar anticuerpos en cellsignal.com es seleccionar primero la aplicación adecuada. A continuación, puede introducir términos de búsqueda o seleccionar otros atributos (como la especie huésped, el área de investigación, etc.) para refinar aún más su búsqueda y seleccionar un anticuerpo que haya sido validado en la aplicación que necesita.
Diseño de experimentos de control para IF
Para estar seguro de su diseño experimental y de los resultados, y de que su anticuerpo está informando fielmente sobre su objetivo, los experimentos de control positivo y negativo pueden ser informativos. Por ejemplo:
- Los controles sólo secundarios pueden indicarle si existe una unión inespecífica del anticuerpo secundario.
- Confirme la especificidad de un anticuerpo primario diseñando experimentos Knockout/siRNA o comparando líneas celulares de expresión conocida y de no expresión.
- Los experimentos de diana única se utilizan en la configuración de imágenes de desmezcla espectral. Este tipo de experimento puede ayudar a determinar si la falta de tinción se debe al impedimento estérico que se produce cuando 2 antígenos están muy cerca el uno del otro.
- Trate las muestras con fosfatasa para confirmar que los anticuerpos fosfoespecíficos sólo reconocen la diana fosforilada en IF.
- Si sospecha que hay problemas con la fijación o la permeabilización, la comprobación con un anticuerpo que haya funcionado en su laboratorio en el pasado puede ser útil para la resolución de problemas.
Los científicos de Cell Signaling Technology (CST) realizan rutinariamente este tipo de controles como parte de nuestro proceso de validación (véase un ejemplo). Puede valer la pena establecer controles similares en su sistema modelo experimental, especialmente si tiene dificultades para obtener los resultados que desea.
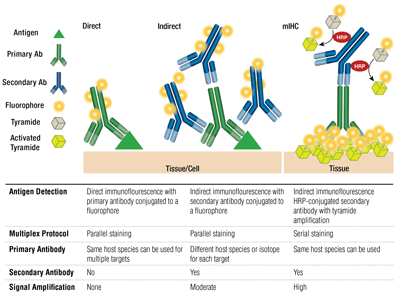
Anticuerpos primarios frente a secundarios y tinción directa frente a indirecta
Los anticuerpos primarios proporcionan un reconocimiento específico del antígeno diana. Los anticuerpos secundarios se unen a los anticuerpos primarios en función de la especie en la que han sido criados. Los anticuerpos primarios que han sido criados en conejo o en ratón son susceptibles de ser detectados con secundarios anti-conejo o anti-ratón, respectivamente.
El emparejamiento de un anticuerpo primario y un anticuerpo secundario (específico para la especie huésped del primario) que está conjugado con un fluoróforo se conoce como tinción indirecta. El uso de anticuerpos primarios conjugados con fluoróforos, sin anticuerpos secundarios, se conoce como tinción directa. Los métodos de tinción directa ahorran tiempo y permiten el multiplexado utilizando anticuerpos criados en la misma especie huésped. La tinción indirecta ofrece tradicionalmente una mayor sensibilidad gracias a la amplificación de la señal que se produce cuando múltiples anticuerpos secundarios se unen a un único anticuerpo primario.
Existen otras variaciones de estas técnicas, como el uso de anticuerpos primarios biotinilados con fluorocromos conjugados con avidina/estreptavidina. Los fragmentos de anticuerpos secundarios F(ab’)2 conjugados con fluoróforos (sin el dominio Fc) pueden ayudar a reducir el fondo. En la mIHC, se emplean anticuerpos secundarios conjugados con peroxidasa de rábano picante (HRP) para catalizar la deposición de los conjugados tiramida-fluoróforo.
Selección de anticuerpos fluoróforos
Selección de anticuerpos fluoróforos
¿Cuántas dianas/anticuerpos se pueden multiplexar?
El multiplexado emplea la detección de más de 1 objetivo a la vez mediante múltiples anticuerpos y la detección de diferentes longitudes de onda (colores) para cada objetivo. Para la tinción indirecta, la capacidad de multiplexación se basa en el emparejamiento de anticuerpos secundarios conjugados con fluoróforos, específicos para cada especie, con cada anticuerpo primario. Los anticuerpos de ratón de distintos isotipos también pueden multiplexarse utilizando secundarios específicos para cada isotipo, lo que permite la detección de hasta 5 anticuerpos de ratón a la vez. Para la tinción directa, cada anticuerpo primario debe acoplarse a un fluoróforo diferente. Esto permite combinar múltiples anticuerpos de la misma especie/isótipo y también permite la tinción «ratón sobre ratón», ya que la unión inespecífica de los secundarios anti-ratón al tejido de ratón no es un problema.
Cuando se diseñan experimentos de IF múltiple, deben tenerse en cuenta las características espectrales del microscopio de fluorescencia, incluyendo las fuentes de excitación disponibles y los conjuntos de filtrado, para evitar el sangrado espectral. Los modernos microscopios de fluorescencia epifluorescentes y confocales suelen tener la capacidad de distinguir 3 o más canales.
Combinar la tinción de anticuerpos con tintes o etiquetas
Los tintes celulares que se aplican tras la fijación o las etiquetas de células vivas fijables pueden incorporarse a un flujo de trabajo de IF. El etiquetado de orgánulos se utiliza a menudo para verificar la localización subcelular de un objetivo. Las etiquetas expresadas, como la GFP, se utilizan a menudo para rastrear células transfectadas o en experimentos de mosaico; si la señal de fluorescencia de la GFP es baja, puede emplearse un anticuerpo anti-GFP en la IF. El uso de colorantes o proteínas fluorescentes ocupará los canales de fluorescencia, dejando menos disponibles para los anticuerpos.
Elección de fluoróforos para su experimento
Esto dependerá de las características espectrales de la fuente de excitación y del filtrado de excitación/emisión de que disponga. Evalúe el perfil de excitación y emisión del fluoróforo antes de ejecutar su experimento para evitar el sangrado de fluorescencia. CST ofrece una variedad de anticuerpos primarios y secundarios conjugados con fluoróforos, incluidos los colorantes de la línea Alexa Fluor®.
Preparación de la muestra
Tejido
Las secciones de tejido pueden prepararse mediante congelación rápida en medio de temperatura óptima de corte (OCT) o mediante fijación e incrustación en parafina. Las muestras congeladas pueden seccionarse utilizando un criostato y dejar que se sequen al aire en el portaobjetos de 10 a 15 minutos antes de la fijación antes del siguiente paso. En el caso de las muestras de tejido FFPE, los requisitos para los pasos de recogida, fijación e incrustación en parafina pueden variar en función del tipo de tejido individual.
Tejido congelado frente a tejido FFPE
En general, el tejido FFPE ofrece una mejor morfología que el tejido congelado incrustado en OCT. Esto puede facilitar la cuantificación de las células positivas o la identificación de los límites entre las manchas. El tejido FFPE también es muy estable; una vez embebido, los bloques de tejido pueden almacenarse durante años. Este tipo de tejido también es más fácil de enviar entre laboratorios, y es el método de procesamiento preferido para las muestras de patología humana.
Por otro lado, el tejido FFPE se somete a varios pasos de procesamiento adicionales que reducen la cantidad total de antígeno debido a la degradación de las proteínas, requieren pasos de desenmascaramiento para detectar el antígeno restante y exacerban la autofluorescencia inducida por el aldehído. A menos que se trabaje con una proteína muy abundante, el antígeno restante puede ser difícil de detectar por IF indirecta y puede requerir amplificación para producir una tinción adecuada. También es posible que la recuperación de antígenos desenmascare antígenos que normalmente no se detectarían y que un anticuerpo que de otro modo da el patrón de tinción esperado dé una tinción no específica. Es igualmente posible trabajar con una diana en la que se requiera un método específico de recuperación de antígeno para detectar el epítopo diana. Por lo tanto, es importante tener en cuenta cómo se valida un anticuerpo y qué pasos se requieren para utilizarlo.
En el caso del tejido congelado embebido en OCT, se prioriza la reducción del procesamiento sobre la morfología. Este es el método más rápido para obtener resultados de inmunotinción, ya que los portaobjetos están listos para su uso en el momento en que se corta el tejido y hay menos pasos de procesamiento antes de la incrustación. Hay menos degradación de la proteína y hay más antígeno disponible para unirse al anticuerpo sin requerir ningún paso adicional de recuperación. Como este método no requiere amplificación, es más sensible a la calidad del tejido. El tipo de fijación (alcohol o aldehído), la duración (algunos objetivos, como los factores de transcripción, requieren un tiempo de fijación más corto) y la edad del tejido (especialmente después de la sección) son importantes y varían según el objetivo. Por último, trabajar con tejido congelado ofrece más flexibilidad en la selección de objetivos, ya que el procesamiento puede realizarse después de la sección, lo que permite una mayor personalización en el diseño del ensayo.
Células cultivadas
Las células deben sembrarse en un material de soporte compatible con la microscopía de fluorescencia. Los soportes típicos incluyen placas de cultivo celular con fondo de vidrio, cubreobjetos de vidrio (mantenidos en placas de cultivo de plástico) preparados con polilisina y/o componentes de matriz extracelular para soportar el cultivo de células adherentes, y cámaras multipocillos disponibles en el mercado montadas en portaobjetos de vidrio que son compatibles con los microscopios.
Tenga en cuenta que las condiciones de cultivo celular pueden afectar a la salud de las células, la morfología y la expresión/localización de su proteína diana y, en última instancia, dictar la calidad de sus datos de FI. Asegúrese de que sus células están sanas comprobando regularmente los medios de cultivo para ver si hay cambios de pH e inspeccionando si hay signos de estrés celular (como células multinucleadas) a bajo aumento en un microscopio. Compruebe también que la confluencia de las células es la adecuada para el tipo de célula y el objetivo.
Fijación de la muestra
El fijador ideal preserva una instantánea «similar a la vida» a la vez que detiene rápidamente el proceso degradativo de la autolisis mediante el entrecruzamiento y la inhibición de las enzimas endógenas, y presenta el antígeno para su reconocimiento por el anticuerpo. Desgraciadamente, no existe un único método de fijación que funcione de forma ideal en todas las muestras y para todos los antígenos. Incluso diferentes antígenos de la misma proteína diana pueden presentar diferencias entre los protocolos. Por ello, el mejor protocolo puede variar no sólo según el tipo de muestra, sino también según el epítopo (y el anticuerpo).
Tejidos
Para los tejidos recién congelados, las secciones que se han congelado y crioseccionado deben tratarse ahora con fijador. Alternativamente, las muestras de tejido pueden conservarse fijando primero con perfusión transcárdica o inmersión, postfijación y pasos de crioconservación, seguidos de congelación y seccionamiento.
En el procesamiento de tejidos FFPE, el tejido se conserva mediante fijación por inmersión con formalina (u otro fijador a base de aldehídos) o con perfusión como se ha indicado anteriormente, seguido de incrustación en parafina y seccionamiento. Antes de la incubación con anticuerpos, las secciones deben someterse a pasos de desparafinación, rehidratación y recuperación de antígenos para permitir que los anticuerpos accedan a la muestra y se unan a las moléculas objetivo.
Células
Enjuagar las células con un medio caliente sin proteínas o con PBS inmediatamente antes de la fijación puede evitar la precipitación de proteínas extracelulares y restos. La fijación rápida se consigue cambiando rápidamente el medio por la solución fijadora.
Fijación con aldehído frente a fijación con alcohol
Los fijadores a base de aldehído, como el formaldehído, la formalina (una mezcla de formaldehído disuelto con un porcentaje menor de metanol) y el glutaraldehído, son los más utilizados cuando es primordial preservar la estructura. Para la mayoría de los anticuerpos, el CST recomienda la fijación con formaldehído al 4% (sin metanol). Los aldehídos reaccionan con las aminas primarias de las proteínas celulares y las entrecruzan, estabilizando la muestra. Además, las enzimas celulares, incluidas las fosfatasas y las proteasas, se desactivan por la reticulación. Los aldehídos atraviesan la membrana plasmática y fijan las proteínas solubles mejor que los alcoholes, pero algunas dianas pueden perder su antigenicidad con el entrecruzamiento de aldehídos.
Los fijadores alcohólicos deshidratantes/desnaturalizantes, como el metanol, desplazan el agua alrededor de las macromoléculas celulares, lo que provoca su desnaturalización y precipitación in situ. La desnaturalización de la proteína diana puede exponer epítopos enterrados, lo que hace que este enfoque sea más ventajoso que la fijación con aldehídos para algunos anticuerpos. Sin embargo, los fijadores deshidratantes son menos adecuados para objetivos solubles y anticuerpos con estados de modificación específicos, como los fosfoanticuerpos. Consulte la ficha técnica del producto para conocer el método de fijación óptimo.
Elegir un agente permeabilizante
Si se utiliza un fijador de reticulación, la membrana plasmática seguirá intacta, haciendo que las dianas intracelulares sean inaccesibles a los anticuerpos. Por lo tanto, la permeabilización debe realizarse después de la fijación por reticulación, a menos que sus anticuerpos reconozcan epítopos extracelulares. El método de permeabilización óptimo varía en función del anticuerpo; consulte siempre la página del producto para conocer el protocolo recomendado.
El uso de la permeabilización con Triton® X-100 después de la fijación es habitual. Triton y otros detergentes, como NP-40, TWEEN®, Saponin, Digitonin y DOTMAC, interactúan con las membranas celulares para crear «poros» de tamaño variable y permitir el acceso de los anticuerpos.
Alternativamente, se puede realizar la permabilización con alcohol con etanol o metanol después del paso de fijación. Este método combina la fijación rápida de los fijadores de reticulación con la desnaturalización intermedia de las proteínas y la deslipidación de la membrana. Esto puede mejorar la señal para determinadas dianas, en particular las asociadas a orgánulos o al citoesqueleto.
¿Qué condiciones de fijación/permeabilización utilizo al realizar un multiplexado?
Si está realizando un multiplexado con anticuerpos que requieren diferentes protocolos de CST, es posible que deba priorizar qué anticuerpo utilizar en sus condiciones óptimas. En esta nota de aplicación (PDF) se muestra un ejemplo de optimización del orden realizado en mIHC. Realizar una prueba a pequeña escala comparando diferentes protocolos puede ser informativo antes de ampliar sus experimentos.
Elegir un reactivo de bloqueo
La recomendación más común es 5% de suero normal de cabra (o suero de la misma especie que el anticuerpo secundario) en PBS + 0,3% de Triton® X-100. Compruebe la hoja de datos para conocer el agente de bloqueo recomendado.
Si los receptores Fc están presentes en la muestra, la señal del anticuerpo procederá de una mezcla de reconocimiento específico de la diana (a través del sitio de unión al antígeno/región variable del anticuerpo) así como de la absorción no específica de la unión de la cadena pesada del anticuerpo a los receptores Fc. La IgG total presente en el suero animal bloquea los receptores Fc para evitar la unión de los anticuerpos primarios y secundarios y reducir el ruido de fondo. La elección de fragmentos de F(ab’)2 conjugados con fluoróforos también evitará la unión del receptor Fc para el anticuerpo secundario (pero no para el anticuerpo primario)
En otras aplicaciones basadas en anticuerpos, como el western blotting, los pasos de bloqueo reducen la señal de fondo causada por la unión inespecífica y de menor afinidad de los anticuerpos primarios y secundarios a sitios distintos de su objetivo previsto. Sin embargo, hemos comprobado que los anticuerpos monoclonales de conejo recombinantes que han sido rigurosamente probados en IF funcionan bien en muchas muestras con o sin bloqueo. En última instancia, la elección de anticuerpos de calidad validados en inmunofluorescencia contribuye en gran medida a evitar el ruido de fondo.
Concentración de anticuerpos y relación señal/ruido en IF
La relación señal/ruido (S/N) está relacionada con la especificidad y la sensibilidad de un anticuerpo en una aplicación concreta. La S/N puede calcularse comparando la «señal» de las intensidades de fluorescencia en las células que expresan la diana de interés con el «ruido de fondo» de las células que carecen de expresión. Si el anticuerpo se aplica a una concentración demasiado baja, la señal de fluorescencia será demasiado débil para distinguirla del ruido de fondo. Por otro lado, una concentración excesivamente alta contribuirá a la tinción de fondo, disminuyendo la S/N. Consulte siempre la hoja de datos del producto para conocer la dilución recomendada, que se basa en las valoraciones realizadas durante la validación del anticuerpo.
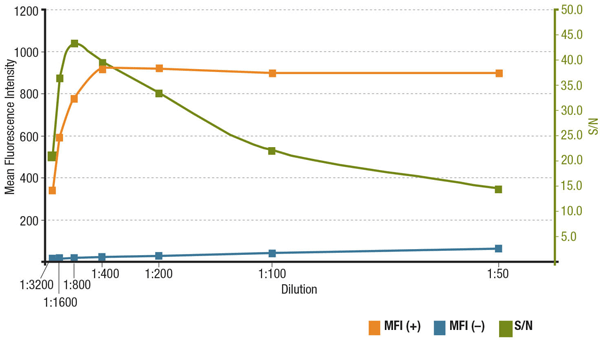
Análisis de la relación señal/ruido para la dilución MUC1 (D9O8K) XP® Rabbit mAb #14161. Cuantificación de la intensidad media de fluorescencia en células ZR-75-1 que expresan (MFI(+), naranja) y células HCT 116 que no expresan (MFI(-), azul), y S/N calculado (verde).
Análisis de S/N para MUC1 (D9O8K) XP® Rabbit mAb #14161 dilución. Cuantificación de la intensidad media de fluorescencia en células ZR-75-1 expresivas (MFI(+), naranja) y células HCT 116 no expresivas (MFI(-), azul), y S/N calculado (verde).
Tiempo de incubación del anticuerpo
En general, las incubaciones nocturnas a 4°C dan lugar a una señal fuerte. Cambiar el tiempo de incubación y la temperatura puede cambiar la señal y la S/N. Diferentes anticuerpos pueden responder a las condiciones de incubación modificadas de manera diferente; para más información, consulte esta entrada del blog.
¿Necesito acceso a un microscopio confocal para realizar la IF?
La IF puede realizarse en cualquier microscopio de fluorescencia con la fuente de excitación y el filtrado adecuados, incluidos los microscopios confocales epifluorescentes, de barrido y de disco giratorio. La inmunofluorescencia también es generalmente compatible con técnicas de fluorescencia especializadas, incluyendo la fluorescencia de reflexión interna total (TIRF), la microscopía de lámina de luz y algunas técnicas de superresolución.
Compatibilidad con el cribado automatizado de alto rendimiento/análisis de alto contenido
Cualquier anticuerpo aprobado para IF-IC puede utilizarse en el cribado de alto rendimiento (HCS) y el análisis de alto contenido (HCA). Estos experimentos se basan en técnicas de IF estándar, incorporando la automatización.
¿Tiene problemas con su experimento de IF? Haga clic aquí para obtener una guía de solución de problemas.
Cell Signaling Technology, CST y XP son marcas comerciales de Cell Signaling Technology, Inc. Todas las demás marcas comerciales son propiedad de sus respectivos propietarios.