La începuturile chimiei organice, alchenele au fost descrise ca fiind „nesaturate” deoarece, spre deosebire de alcanii „saturați”, s-a constatat că acestea reacționează ușor cu substanțe precum halogeni, halogenuri de hidrogen, agenți oxidanți etc. Prin urmare, „afinitatea chimică” a alchenelor a fost considerată nesatisfăcută sau „nesaturată”. (A se vedea, de asemenea, secțiunea 1-1I.)
Un motiv pentru care alchenele și alchenii reacționează mai ușor decât alcanii este acela că legăturile carbon-carbon dintr-o legătură multiplă sunt individual mai slabe decât legăturile normale carbon-carbon simple. Luați în considerare energiile de legătură implicate. Conform tabelului 4-3, puterile legăturilor simple, duble și triple carbon-carbon sunt \(83\), \(146\) și, respectiv, \(200 \: \text{kcal}\). Pornind de la aceste valori putem calcula că scindarea unei jumătăți dintr-o legătură dublă carbon-carbon ar trebui să necesite \(63 \: \text{kcal}\) și scindarea unei treimi dintr-o legătură triplă carbon-carbon ar trebui să necesite \(54 \: \text{kcal}\):

Ca urmare, se așteaptă ca reacțiile de adiție la legături multiple să fie de aproximativ \(20\)-\(30 \: \text{kcal}\) mai exotermice decât reacțiile corespunzătoare de scindare a legăturilor simple carbon-carbon, așa cum se estimează aici pentru reacția cu bromul:
Diferența substanțială dintre căldurile de reacție ale etanului, etenei și etinei cu bromul se reflectă într-un considerent practic foarte important în manipularea etenei (acetilenei), și anume stabilitatea sa termodinamică în raport cu carbonul solid și hidrogenul gazos. Spre deosebire de etenă, atât etena, cât și etena se poate demonstra, pe baza energiilor de legătură, că sunt instabile în ceea ce privește formarea carbonului solid și a hidrogenului gazos:
Deși acest lucru nu pare să ofere probleme deosebite în cazul etenei, se poate produce o descompunere explozivă a etenei în carbon și hidrogen dacă gazul este comprimat la \(10\)-\(20 \: \text{kg cm}^{-2}\). Chiar și etina lichidă (bp \sim 83^\text{o}\)) trebuie manipulată cu grijă. Etilena nu se utilizează comercial sub presiune decât dacă este amestecată cu un gaz inert și manipulată în echipamente robuste. Etilina arde cu oxigen pur pentru a da o flacără foarte fierbinte care este folosită pe scară largă pentru sudură. În acest scop, gazul este dizolvat la aproximativ \(15 \: \text{kg cm}^{-2}\) în 2-propanonă (acetonă, 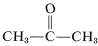 , bp \(56,5^\text{o}\)) și este conținut în butelii ambalate cu pământ de diatomee.
, bp \(56,5^\text{o}\)) și este conținut în butelii ambalate cu pământ de diatomee.
De ce este etina mult mai puțin stabilă decât etena sau etanul? În primul rând, legăturile \(\ce{C-C}\) nu sunt la fel de puternice ca legăturile \(\ce{C-H}\). Prin urmare, este de așteptat să se înregistreze o creștere a stabilității atunci când se realizează legături \(\ce{C-H}\ în detrimentul legăturilor \(\ce{C-C}\); etena și etanul au fiecare mai multe legături \(\ce{C-H}\ decât are etena. În al doilea rând, etina are șase electroni între cele două atomi de carbon, iar acești electroni se confruntă cu o repulsie interelectronică reciprocă considerabilă. Acest lucru explică faptul că rezistența medie a legăturii \(\ce{C-C}\ pentru legătura triplă a unei alchine este de \(200/3 = 67 \: \text{kcal}\), în comparație cu \(146/2 = 73 \: \text{kcal}\) pentru legătura dublă a unui alcan și \(83 \: \text{kcal}\ pentru o legătură simplă normală a unui alcan.
- John D. Robert și Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, ediția a doua. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Acest conținut este protejat prin drepturi de autor în următoarele condiții: „Vi se acordă permisiunea pentru reproducerea, distribuirea, afișarea și interpretarea individuală, educațională, de cercetare și necomercială a acestei lucrări în orice format.”