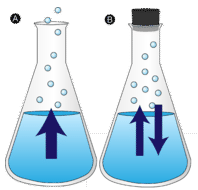
Evaporare
O baltă de apă lăsată nemișcată dispare în cele din urmă. Moleculele de lichid scapă în faza gazoasă, devenind vapori de apă. Vaporizarea este procesul prin care un lichid este transformat în gaz. Evaporarea este transformarea unui lichid în vapori sub temperatura de fierbere a lichidului. În schimb, dacă apa este păstrată într-un recipient închis, moleculele de vapori de apă nu au șansa de a scăpa în mediul înconjurător și, astfel, nivelul apei nu se modifică. Pe măsură ce unele molecule de apă devin vapori, un număr egal de molecule de vapori de apă se condensează înapoi în stare lichidă. Condensarea este schimbarea stării de la gaz la lichid.
Pentru ca o moleculă de lichid să scape în stare gazoasă, molecula trebuie să aibă suficientă energie cinetică pentru a învinge forțele de atracție intermoleculare din lichid. Reamintim că o anumită probă de lichid va avea molecule cu o gamă largă de energii cinetice. Moleculele de lichid care au acest anumit prag de energie cinetică scapă de la suprafață și devin vapori. Ca urmare, moleculele de lichid care rămân au acum o energie cinetică mai mică. Pe măsură ce are loc evaporarea, temperatura lichidului rămas scade. Ați observat efectele răcirii prin evaporare. Într-o zi călduroasă, moleculele de apă din transpirația dumneavoastră absorb căldura corpului și se evaporă de pe suprafața pielii. Procesul de evaporare lasă transpirația rămasă mai rece, care, la rândul său, absoarbe mai multă căldură din corpul dumneavoastră.
Un anumit lichid se va evapora mai repede atunci când este încălzit. Acest lucru se datorează faptului că procesul de încălzire face ca o fracțiune mai mare din moleculele lichidului să aibă energia cinetică necesară pentru a scăpa de pe suprafața lichidului. Figura de mai jos prezintă distribuția energiei cinetice a moleculelor de lichid la două temperaturi. Numărul de molecule care au energia cinetică necesară pentru a se evapora este indicat în zona umbrită de sub curba din dreapta. Lichidul la temperatură mai ridicată \(\left( T_2 \right)\) are mai multe molecule care sunt capabile să evadeze în faza de vapori decât lichidul la temperatură mai scăzută \(\left( T_1 \right)\).

La 29.029 de picioare \(\left( 8848 \: \text{m} \right)\)), Muntele Everest din lanțul Himalaya, la granița dintre China și Nepal, este cel mai înalt punct de pe pământ. Altitudinea sa prezintă multe probleme practice pentru alpiniști. Conținutul de oxigen din aer este mult mai mic decât la nivelul mării, ceea ce face necesară aducerea cu sine a buteliilor de oxigen (deși câțiva alpiniști au ajuns pe vârf fără oxigen). O altă problemă este cea a fierberii apei pentru gătitul alimentelor. Deși apa fierbe la \(100^\text{o} \text{C}\ la nivelul mării, punctul de fierbere pe vârful Muntelui Everest este de numai aproximativ \(70^\text{o} \text{C}\). Această diferență face foarte dificilă obținerea unei cești decente de ceai (ceea ce i-a frustrat cu siguranță pe unii dintre alpiniștii britanici).
.