Gaze reale și gaze ideale
Un gaz ideal este un gaz care respectă legile gazelor în toate condițiile de temperatură și presiune. Pentru a face acest lucru, gazul ar trebui să respecte în totalitate teoria cinetico-moleculară. Particulele gazului ar trebui să ocupe un volum zero și ar trebui să nu prezinte niciun fel de forțe de atracție una față de cealaltă. Deoarece niciuna dintre aceste condiții nu poate fi adevărată, nu există un gaz ideal. Un gaz real este un gaz care nu se comportă în conformitate cu ipotezele teoriei cinetico-moleculare. Din fericire, în condițiile de temperatură și presiune care se întâlnesc în mod normal într-un laborator, gazele reale tind să se comporte foarte mult ca și gazele ideale.
În ce condiții, atunci, gazele se comportă cel mai puțin ideal? Atunci când un gaz este supus unei presiuni ridicate, moleculele sale sunt forțate să se apropie unele de altele, deoarece spațiul gol dintre particule este diminuat. O scădere a spațiului gol înseamnă că ipoteza că volumul particulelor în sine este neglijabil este mai puțin valabilă. Atunci când un gaz este răcit, scăderea energiei cinetice a particulelor le face pe acestea să încetinească. Dacă particulele se deplasează la viteze mai mici, forțele de atracție dintre ele sunt mai importante. Un alt mod de a vedea lucrurile este că răcirea continuă a gazului îl va transforma în cele din urmă într-un lichid, iar un lichid cu siguranță nu mai este un gaz ideal (vezi azotul lichid în figura de mai jos). Pe scurt, un gaz real se abate cel mai mult de la un gaz ideal la temperaturi scăzute și presiuni ridicate. Gazele sunt cele mai ideale la temperaturi ridicate și presiuni scăzute.

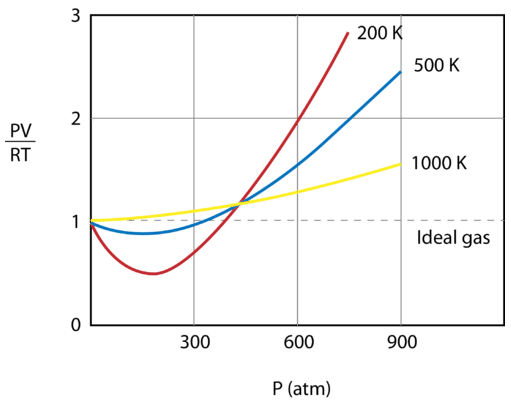
Figura de mai jos prezintă un grafic al \(\frac{PV}{RT}\) în funcție de presiune pentru \(1 \: \text{mol}\) dintr-un gaz la trei temperaturi diferite – \(200 \: \text{K}\), \(500 \: \text{K}\), și 1000 \: \text{K}\). Un gaz ideal ar avea o valoare de 1 pentru acest raport la toate temperaturile și presiunile, iar graficul ar fi pur și simplu o linie orizontală. După cum se poate observa, apar abateri de la un gaz ideal. Pe măsură ce presiunea începe să crească, forțele de atracție fac ca volumul gazului să fie mai mic decât cel așteptat, iar valoarea lui \(\frac{PV}{RT}\) scade sub 1. Creșterea continuă a presiunii face ca volumul particulelor să devină semnificativ, iar valoarea lui \(\frac{PV}{RT}\) crește la o valoare mai mare de 1. Observați că amploarea abaterilor de la idealitate este cea mai mare pentru gazul de la \(200 \: \text{K}\) și cea mai mică pentru gazul de la \(1000 \: \text{K}\).
Idealitatea unui gaz depinde, de asemenea, de intensitatea și tipul de forțe de atracție intermoleculare care există între particule. Gazele ale căror forțe de atracție sunt slabe sunt mai ideale decât cele cu forțe de atracție puternice. La aceeași temperatură și presiune, neonul este mai ideal decât vaporii de apă, deoarece atomii de neon sunt atrași doar de forțe de dispersie slabe, în timp ce moleculele vaporilor de apă sunt atrase de legături de hidrogen relativ mai puternice. Heliul este un gaz mai ideal decât neonul deoarece numărul său mai mic de electroni face ca forțele de dispersie ale heliului să fie chiar mai slabe decât cele ale neonului.
.