Rezistența legăturii: Legături covalente
Moleculele stabile există pentru că legăturile covalente țin atomii împreună. Măsurăm rezistența unei legături covalente prin energia necesară pentru a o rupe, adică energia necesară pentru a separa atomii legați. Separarea oricărei perechi de atomi legați necesită energie; cu cât o legătură este mai puternică, cu atât mai mare este energia necesară pentru a o rupe. Energia necesară pentru a rupe o anumită legătură covalentă într-un mol de molecule gazoase se numește energie de legătură sau energie de disociere a legăturii. Energia de legătură pentru o moleculă diatomică, \(D_{X-Y}\), este definită ca fiind variația standard de entalpie pentru reacția endotermică:
\
De exemplu, energia de legătură a legăturii covalente pure H-H, \(\(\Delta_{H-H}\), este de 436 kJ pe mol de legături H-H rupte:
\
Ruperea unei legături necesită întotdeauna adăugarea de energie la moleculă. În mod corespunzător, realizarea unei legături eliberează întotdeauna energie.
Moleculele cu trei sau mai mulți atomi au două sau mai multe legături. Suma tuturor energiilor de legătură dintr-o astfel de moleculă este egală cu variația standard de entalpie pentru reacția endotermică care rupe toate legăturile din moleculă. De exemplu, suma celor patru energii ale legăturilor C-H din CH4, 1660 kJ, este egală cu variația standard de entalpie a reacției:
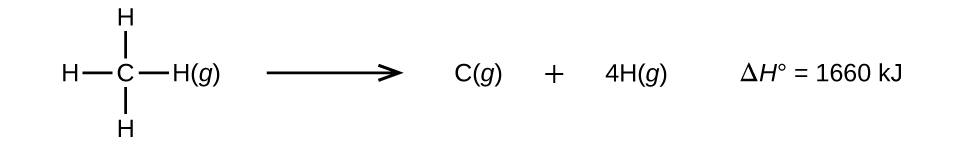
Energia medie a legăturii C-H, \(D_{C-H}\), este de 1660/4 = 415 kJ/mol, deoarece există patru moli de legături C-H rupte pe mol de reacție. Deși cele patru legături C-H sunt echivalente în molecula originală, fiecare dintre ele nu necesită aceeași energie pentru a se rupe; odată ce prima legătură este ruptă (care necesită 439 kJ/mol), celelalte legături sunt mai ușor de rupt. Valoarea de 415 kJ/mol reprezintă valoarea medie, nu valoarea exactă necesară pentru ruperea oricărei legături.
Tăria unei legături între doi atomi crește pe măsură ce crește numărul de perechi de electroni din legătură. În general, pe măsură ce rezistența legăturii crește, lungimea legăturii scade. Astfel, constatăm că legăturile triple sunt mai puternice și mai scurte decât legăturile duble între aceiași doi atomi; la fel, legăturile duble sunt mai puternice și mai scurte decât legăturile simple între aceiași doi atomi. Energiile medii de legătură pentru unele legături obișnuite apar în tabelul \(\PageIndex{2}\\), iar o comparație a lungimilor și rezistențelor legăturilor pentru unele legături obișnuite apare în tabelul \(\PageIndex{2}\). Atunci când un atom se leagă de diferiți atomi dintr-un grup, puterea legăturii scade de obicei pe măsură ce ne deplasăm în josul grupului. De exemplu, C-F este 439 kJ/mol, C-Cl este 330 kJ/mol, iar C-Br este 275 kJ/mol.
| Legătură | Energie de legătură | Legătură | Energie de legătură | Legătură | Legătură | Energie de legătură | Energie de legătură | ||
|---|---|---|---|---|---|---|---|---|---|
| H-H | 436 | C-S | 260 | F-Cl | 255 | ||||
| H-C | 415 | C-Cl | 330 | F-Br | 235 | ||||
| H-N | 390 | C-Br | 275 | Si-Si | 230 | ||||
| H-O | 464 | C-I | 240 | Si-P | 215 | ||||
| H-F | 569 | N-N | 160 | Si-S | 225 | ||||
| H-Si | 395 | \(\mathrm{N=N}\) | 418 | Si-Cl | 359 | ||||
| H-P | 320 | \(\mathrm{N≡N}\}) | 946 | Si-Br | 290 | ||||
| H-S | 340 | N-O | 200 | Si-I | 215 | ||||
| H-Cl | 432 | N-F | 270 | P-P | 215 | ||||
| H-Br | 370 | N-P | 210 | P-S | 230 | ||||
| H-I | 295 | N-Cl | 200 | P-Cl | 330 | 330 | |||
| C-C | 345 | N-Br | 245 | P-Br | 270 | ||||
| \(\mathrm{C=C}\) | 611 | O-O | 140 | P-I | 215 | ||||
| \(\mathrm{C≡C}\}) | 837 | \(\mathrm{O=O}\}) | 498 | S-S | 215 | ||||
| C-N | 290 | O-F | 160 | S-Cl | 250 | ||||
| \(\mathrm{C=N}\}) | 615 | O-Si | 370 | S-Br | 215 | ||||
| \(\mathrm{C≡N}\) | 891 | O-P | 350 | Cl-Cl | 243 | ||||
| C-O | 350 | O-Cl | 205 | Cl-Br | 220 | ||||
| \(\mathrm{C=O}\) | 741 | O-I | 200 | Cl-I | 210 | ||||
| \(\mathrm{C≡O}\) | 1080 | F-F | 160 | Br-Br | 190 | ||||
| C-F | 439 | F-Si | 540 | Br-I | 180 | ||||
| C-Si | 360 | F-P | 489 | I-I | 150 | ||||
| C-P | 265 | F-S | 285 |
| Legătură | Lungime de legătură (Å) | Energie de legătură (kJ/mol) |
|---|---|---|
| C-C | 1.54 | 345 |
| \(\mathrm{C=C}\) | 1.34 | 611 |
| \(\mathrm{C≡C}\) | 1.20 | 837 |
| C-N | 1.43 | 290 |
| \(\mathrm{C=N}\) | 1.38 | 615 |
| \(\mathrm{C≡N}\) | 1.16 | 891 |
| C-O | 1.43 | 350 |
| \(\mathrm{C=O}\) | 1.23 | 741 |
| \(\mathrm{C≡O}\) | 1.13 | 1080 |
Potem folosi energiile de legătură pentru a calcula variațiile aproximative de entalpie pentru reacțiile în care nu sunt disponibile entalpiile de formare. Calculele de acest tip ne vor spune, de asemenea, dacă o reacție este exotermă sau endotermă.
- O reacție exotermă (ΔH negativ, căldură produsă) rezultă atunci când legăturile din produși sunt mai puternice decât legăturile din reactanți.
- O reacție endotermă (ΔH pozitiv, căldură absorbită) rezultă atunci când legăturile din produși sunt mai slabe decât cele din reactanți.
Variația de entalpie, ΔH, pentru o reacție chimică este aproximativ egală cu suma energiei necesare pentru a rupe toate legăturile din reactanți (energie „în”, semn pozitiv) plus energia eliberată atunci când toate legăturile sunt formate în produși (energie „afară”, semn negativ). Acest lucru poate fi exprimat matematic în felul următor:
\
În această expresie, simbolul \(\Sigma\) înseamnă „suma de”, iar D reprezintă energia de legătură în kilojouli pe mol, care este întotdeauna un număr pozitiv. Energia de legătură este obținută dintr-un tabel și va depinde de faptul dacă legătura respectivă este o legătură simplă, dublă sau triplă. Astfel, atunci când calculăm entalpiile în acest mod, este important să luăm în considerare legăturile din toți reactanții și produsele. Deoarece valorile D sunt de obicei medii pentru un tip de legătură în mai multe molecule diferite, acest calcul oferă o estimare aproximativă, nu o valoare exactă, pentru entalpia de reacție.
Considerați următoarea reacție:
sau
\
Pentru a forma doi moli de HCl, trebuie rupți un mol de legături H-H și un mol de legături Cl-Cl. Energia necesară pentru ruperea acestor legături este suma energiei de legătură a legăturii H-H (436 kJ/mol) și a legăturii Cl-Cl (243 kJ/mol). În timpul reacției, se formează doi moli de legături H-Cl (energia legăturii = 432 kJ/mol), eliberând 2 × 432 kJ; sau 864 kJ. Deoarece legăturile din produși sunt mai puternice decât cele din reactanți, reacția eliberează mai multă energie decât consumă:
\-2D_{H-Cl}}\\
&=\mathrm{-2(432)=-185\:kJ}
\end {align*}\]
Acest exces de energie este eliberat sub formă de căldură, deci reacția este exotermă. Tabelul T2 oferă o valoare pentru entalpia molară standard de formare a HCl(g), \(ΔH^\circ_\ce f\), de -92,307 kJ/mol. De două ori această valoare este de -184,6 kJ, ceea ce concordă bine cu răspunsul obținut anterior pentru formarea a doi moli de HCl.
Exemplu \(\PageIndex{1}\): Utilizarea energiilor de legătură pentru a aproxima schimbările de entalpie
Metanolul, CH3OH, poate fi un combustibil alternativ excelent. Reacția la temperatură ridicată a aburului și a carbonului produce un amestec de gaze monoxid de carbon, CO, și hidrogen, H2, din care se poate produce metanol. Folosind energiile de legătură din tabelul \(\PageIndex{2}\), calculați variația aproximativă de entalpie, ΔH, pentru reacția de aici:
\
Soluție
În primul rând, trebuie să scriem structurile Lewis ale reactanților și produselor:
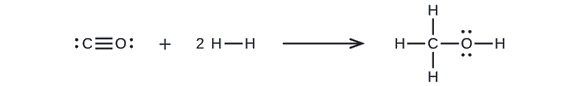
Din aceasta, vedem că ΔH pentru această reacție implică energia necesară pentru a rupe o legătură triplă C-O și două legături simple H-H, precum și energia produsă de formarea a trei legături simple C-H, a unei legături simple C-O și a unei legături simple O-H. Putem exprima acest lucru după cum urmează (prin ecuația \ref{EQ3}):
\-}
\end {align*}\]
Utilizând valorile energiei de legătură din tabelul \(\PageIndex{2}\), obținem:
&=\ce{-107\:kJ}
\end {align*}\]
Potem compara această valoare cu valoarea calculată pe baza datelor \(ΔH^\circ_\ce f\) din Anexa G:
&=-\\
&=\mathrm{-90.5\:kJ}
\end {align*}\]
Rețineți că există o diferență destul de semnificativă între valorile calculate cu ajutorul celor două metode diferite. Acest lucru se întâmplă deoarece valorile D sunt media diferitelor rezistențe ale legăturilor; prin urmare, ele oferă adesea doar o concordanță aproximativă cu alte date.
Exercițiu \(\PageIndex{1}\)
Alcoolul etilic, CH3CH2OH, a fost una dintre primele substanțe chimice organice sintetizate în mod deliberat de către om. Are multe utilizări în industrie și este alcoolul conținut în băuturile alcoolice. Poate fi obținut prin fermentarea zahărului sau sintetizat prin hidratarea etilenei în următoarea reacție:

Utilizând energiile de legătură din tabelul \(\PageIndex{2}\), calculați o schimbare aproximativă de entalpie, ΔH, pentru această reacție.
Summary
Video \(\PageIndex{2}\): O trecere în revistă a legăturii atomice.
Legăturile covalente se formează atunci când electronii sunt împărțiți între atomi și sunt atrași de nucleele ambilor atomi. În legăturile covalente pure, electronii sunt împărțiți în mod egal. În legăturile covalente polare, electronii sunt împărțiți în mod inegal, deoarece un atom exercită o forță de atracție mai puternică asupra electronilor decât celălalt.
Tăria unei legături covalente se măsoară prin energia de disociere a legăturii, adică prin cantitatea de energie necesară pentru a rupe legătura respectivă într-un mol de molecule. Legăturile multiple sunt mai puternice decât legăturile simple între aceiași atomi. Entalpia unei reacții poate fi estimată pe baza aportului de energie necesar pentru ruperea legăturilor și a energiei eliberate atunci când se formează noi legături.
Ecuații cheie
- Energia de legătură pentru o moleculă diatomică: \(\ce{XY}(g)⟶\ce{X}(g)+\ce{Y}(g)\hspace{20px}\ce{D_{X–Y}}=ΔH°\)
- Enthalpy change: ΔH = ƩLegături rupte – ƩLegături formate
Note de subsol
- Această întrebare este preluată de la Chemistry Advanced Placement Examination și este utilizată cu permisiunea Educational Testing Service.
Glosar
energia de legătură (de asemenea, energia de disociere a legăturii) energia necesară pentru a rupe o legătură covalentă într-o substanță gazoasă
Contribuitori
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) și Richard Langley (Stephen F. Austin State University) cu autori colaboratori. Conținutul manualului produs de OpenStax College este licențiat sub o licență Creative Commons Attribution License 4.0. Descărcați gratuit de la http://cnx.org/contents/85abf193-2bd…[email protected]).
- Adelaide Clark, Oregon Institute of Technology
- Fuse School, resursă educațională deschisă gratuită, sub o licență Creative Commons: Attribution-NonCommercial CC BY-NC (Vezi actul de licență: https://creativecommons.org/licenses/by-nc/4.0/)
- Curs de chimie: Crash Course este o divizie a Complexly and videos are free to stream for educational purposes.
Feedback
Have feedback to give about this text? Faceți clic aici.
Ați găsit o greșeală de scriere și doriți un credit suplimentar? Faceți clic aici.