Ce este cobaltul
Cobaltul (pronunție: KO-bolt) este un element dur, lucios și argintiu-albastru care aparține grupului de metale de tranziție și este reprezentat prin simbolul chimic Co . Este activ din punct de vedere chimic și poate forma mulți compuși . Este un metal feromagnetic care poate fi magnetizat și este aliat cu nichel și aluminiu pentru a produce magneți puternici .

Simbolul cobaltului
Izotopii
Aceasta are un izotop stabil, natural, 59Co și 28 de radioizotopi dintre care cei mai stabili sunt 60Co, 57Co, 56Co și 58Co cu timpi de înjumătățire de 5,2714 ani, 271,8 zile, 77,27 zile și, respectiv, 70,86 zile . Perioadele de înjumătățire ale celorlalți radioizotopi ai săi sunt mai mici de 18 ore .
Unde se găsește cobaltul
Cobaltul se găsește în mod natural în combinație cu alte elemente în minereuri minerale cum ar fi cobaltitul (o sulfură care conține cobalt, arsenic, fier și nichel), eritrita (arsenat de cobalt hidratat) și skutterudita (arsenat de cobalt) . Se obține, în general, ca produs secundar al mineritului de cupru și nichel .
Nodulii de mangan găsiți pe fundul oceanelor sunt rezerve uriașe de metale de tranziție, conținând tone de cobalt . Primele 3 țări deținătoare de rezerve de cobalt sunt Republica Democrată Congo (RDC), Australia și Cuba, în timp ce primii 3 producători sunt RDC, China și Zambia .

Cobalt
Istorie
Originea numelui său: Numele derivă de la „kobald”, care în germană înseamnă „spiriduș” și de la „cobalos”, un cuvânt grecesc care înseamnă „mină” .
Cine l-a descoperit: Elementul a fost descoperit de chimistul și mineralogul suedez Georg Brandt .
Când și cum a fost descoperit
În mormântul lui Tutankhamon, vechiul faraon egiptean care a domnit în perioada 1361-1352 î.Hr. avea un obiect din sticlă de un albastru intens care era făcut din cobalt . În China, albastrul de cobalt era folosit pentru fabricarea smalțurilor de ceramică .
Pe lângă originile sale antice, descoperirea sa în timpurile recente datează din anii 1730, când Georg Brandt a fost interesat de un minereu albastru din unele dintre minele locale . În cele din urmă, el a reușit să demonstreze că minereul albastru conținea un nou metal . El i-a descris proprietățile și a publicat rezultatele în 1739 .
Descoperirea sa a fost controversată, deoarece alți chimiști i-au contestat descoperirile timp de mulți ani . Cu toate acestea, colegul său chimist suedez Torbern Bergman a efectuat studii suplimentare și a confirmat descoperirea lui Georg Brandt în 1780 .
Identificarea cobaltului |
|||
| Numărul atomic | 27 | ||
| Numărul CAS | 7440-48-4 | ||
| Poziția în tabelul periodic | Grupa | Perioada | Bloc |
| 9 | 4 | d | |
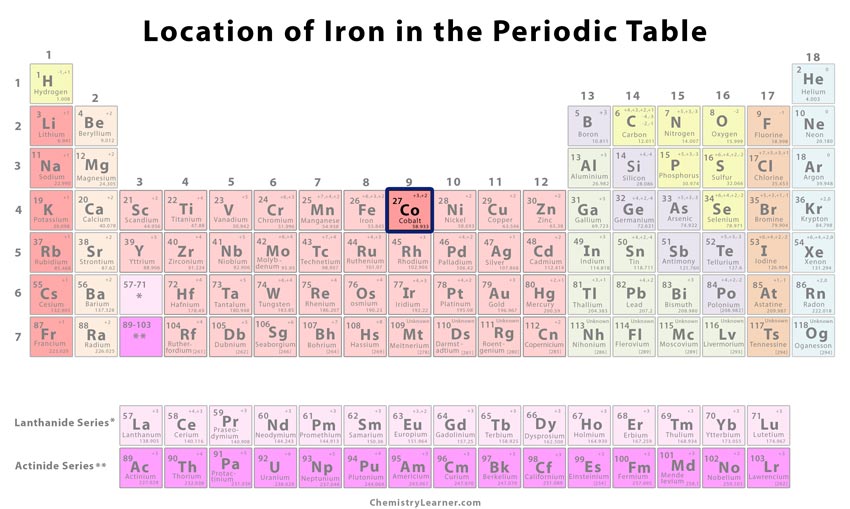
Unde este situat cobaltul în tabelul periodic
Proprietăți și caracteristici ale cobaltului
Proprietăți generale |
||||||||||||||||
| Masa atomică relativă | 58.933 | |||||||||||||||
| Masa atomică | 58,933 amu | |||||||||||||||
| Masa molară | 58,9331950 ± 0,0000050 g/mol | |||||||||||||||
| Masa moleculară | 58.933 g/mol | |||||||||||||||
Proprietăți fizice |
||||||||||||||||
| Culoare | Albastru-argintiu, alb-albăstrui | |||||||||||||||
| Punct de topire/punct de congelare | 1495 °C, 2723 °F | |||||||||||||||
| Punctul de fierbere | 2927 °C, 5301 °F | |||||||||||||||
| Densitate | 8.86 g cm-3 | |||||||||||||||
| Stare a materiei la temperatura camerei (solid/lichid/gaz) | Solid | |||||||||||||||
| Duritate | ||||||||||||||||
| – Brinell | 700 MPa | |||||||||||||||
| – Mohs | 5 | |||||||||||||||
| – Vickers | 1043 MPa | |||||||||||||||
| Conductibilitate electrică | 1.7 X 107 S/m | |||||||||||||||
| Carcină ionică | 3+ | |||||||||||||||
| Conductibilitate termică (căldură) | 100 W/(m K) | |||||||||||||||
| Căldura specifică | 421 J kg-1 K-.1 | |||||||||||||||
| Modulul de încărcare | Nu se știe | |||||||||||||||
| Modulul de forfecare | Nu se știe | |||||||||||||||
| Modulul lui Young | Nu se știe | |||||||||||||||
| Presiunea de vapori | ||||||||||||||||
| – Temperatura (K) | 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 | 2200 | 2400 | |||||
| – Presiune (Pa) | – | – | – | 2.09 X 10-10 | 1.00 X 10-6 | 4.19 X 10-4 | 0.0379 | 1.15 | 16 | – | – | |||||
Proprietăți chimice |
||||||||||||||||
| State de oxidare | 3, 2, 0, -1 | |||||||||||||||
| Izotopi | Izotop | Masă | Abundanță (%) | Mod de înjumătățire | Mode de dezintegrare | |||||||||||
| 59Co | 58.933 | 100 | – | – | ||||||||||||
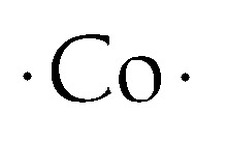
Structura punctiformă Lewis a cobaltului
Date atomice ale cobaltului (elementul 27)
| Electroni de valență | 9 | ||||||||
| Numerele cuantice | |||||||||
| – n | 3 | ||||||||
| – ℓ | 2 | ||||||||
| – mℓ | .1 | ||||||||
| – ms | -.1/2 | ||||||||
| Configurația electronilor (configurația gazelor nobile) | 3d74s2 | ||||||||
| Structura atomică | |||||||||
| – Numărul de electroni | 27 | ||||||||
| – Numărul de neutroni | 32 | ||||||||
| – Numărul de protoni | 27 | ||||||||
| Radioul atomului | |||||||||
| – Raza atomică | 2.00 Å | ||||||||
| – Raza covalentă | 1,18 Å | ||||||||
| Electronegativitatea (scara Pauling) | 1,88 | ||||||||
| Afinitatea electronică | 63.873 kJ mol-1 | ||||||||
| Energia de ionizare (kJ mol-1) | 1-lea | 2-lea | 3-lea | 4-lea | 5-lea | 6-lea | 7-lea | 8-lea | |
| 760.402 | 1648.356 | 3232.3 | 4949.7 | 7670.6 | 9842 | 12437 | 15225.4 | ||
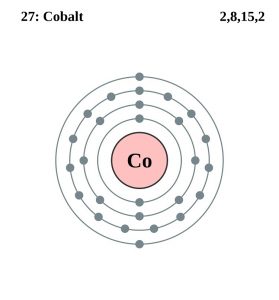
Configurația electronilor de cobalt (Modelul Bohr)
La ce se folosește cobaltul
- Cobaltul este aliat pentru a fi folosit la generatoarele de turbine cu gaz și la turbinele cu reacție datorită rezistenței sale la temperaturi înalte și la coroziune .
- Cobaltul este ocazional utilizat în galvanizare datorită durității și aspectului său atractiv .
- Este utilizat în mod obișnuit ca material catodic în bateriile cu ioni de litiu .
- Sărurile de cobalt sunt folosite pentru a conferi culori albastre intense în sticlă, porțelan, ceramică, emailuri și vopsele .
- Radioactivitatea 60Co este folosită pentru tratarea cancerului și în iradierea alimentelor pentru controlul agenților patogeni și prelungirea duratei de conservare .
- Superaliajele Stellite, compuse din crom, cobalt și tungsten, sunt folosite pentru fabricarea de scule de tăiere rezistente la temperaturi ridicate și la uzură mare .
Toxicitatea cobaltului și efectele asupra sănătății
Otrăvirea cu cobalt poate avea loc atunci când îl ingerați accidental, îl respirați sau când intră în contact cu pielea în cantități mari . În cantități mari, cobaltul poate fi cancerigen la om și la unele animale .
Se găsește în cantități infime la om și este o componentă esențială a vitaminei B12 . Doze mici de cobalt sunt, de asemenea, administrate unor animale pentru a preveni deficiențele minerale la acestea .

Mineralul cobalt (cobaltită)
Fapte interesante
- Cobaltul este reprezentat grafic de un „kobold” sau spiriduș (considerat supărător de către minerii germani din Evul Mediu) cu niște porțelan chinezesc în fundal, referindu-se la utilizarea sa ca smalț de ceramică în China antică .
- Cobaltul își poate păstra proprietățile magnetice până la o temperatură (punctul Curie) de 1.121 °C (2049.8 °F), cea mai ridicată dintre toate elementele feromagnetice .
- În 2010, oamenii de știință germani au folosit un atom de cobalt pentru a capta primele imagini ale schimbării spinului .
Prețul cobaltului
Costul cobaltului pur este de aproximativ 0,21 dolari pe gram, iar în vrac, costă aproximativ 0,00 dolari.044 pe gram .
- http://www.rsc.org/periodic-table/element/27/cobalt
- https://education.jlab.org/itselemental/ele027.html
- https://www.livescience.com/29275-cobalt.html
- https://www.chemicool.com/elements/cobalt.html
- https://education.jlab.org/itselemental/iso027.html
- https://www.webqc.org/molecular-weight-of-Co%28cobalt%29.html
- https://pubchem.ncbi.nlm.nih.gov/compound/cobalt#section=Top
- http://periodictable.com/Elements/027/data.html
- http://www.gpb.org/files/pdfs/gpbclassroom/chemistry/ionicChargesChart.pdf
- http://dwb4.unl.edu/Chem/CHEM869B/CHEM869BLinks/learn.chem.vt.edu/tutorials/bonding/valence.html
- http://chemistry-reference.com/q_elements.asp?Symbol=Co&language=en
- https://medlineplus.gov/ency/article/002495.htm