Introducere
Pacienții internați în unitățile de terapie intensivă (ICU) necesită adesea administrarea intravenoasă a mai multor medicamente. Medicamentele vasoactive, analgezicele și sedativele se numără printre cele mai utilizate grupuri terapeutice și sunt de obicei administrate în perfuzie continuă.
Potrivit revizuirii sistematice efectuate de Moyen et al. există o medie de 1,7 erori/zi asociate cu procesul de administrare a medicamentelor în cadrul secției de terapie intensivă.1 Pe de altă parte, datele raportate de Merino et al. într-un studiu realizat în rândul secțiilor de terapie intensivă ale spitalelor spaniole sunt ceva mai bune (1,13 erori de medicație la fiecare 100 de pacienți/zi).2 Chiar și așa, erorile de medicație sunt frecvente în secțiile de terapie intensivă și necesită atenție din partea furnizorilor de servicii medicale pentru a le minimiza.
Erorile de administrare a medicamentelor în secțiile de terapie intensivă se datorează mai multor factori: utilizarea medicamentelor cu risc ridicat (medicamente vasoactive, inotrope, sedative etc.) adesea administrate în doze mici din cauza puterii lor medicamentoase ridicate, necesitând o diluție și o evaluare prealabilă administrării lor. Un alt factor este reprezentat de prescrierea de doze în unități de măsură diferite sau de numărul mare de medicamente utilizate la fiecare pacient. Deși reprezintă un progres important în ceea ce privește siguranța, utilizarea pompelor de perfuzie inteligente a fost asociată cu un număr important sau erori de medicație din cauza problemelor de programare.3
Combinația acestor factori de risc crește șansele de a face greșeli la cei mai vulnerabili pacienți datorită gravității lor. Pacienții în stare critică au adesea accese venoase limitate. Acest lucru înseamnă că diferite medicamente sunt administrate folosind aceeași cale de administrare, ceea ce crește riscurile implicate atunci când se amestecă medicamente incompatibile. Amestecul de medicamente incompatibile este o eroare de medicație care poate avea consecințe grave pentru pacient, cum ar fi eșecuri terapeutice, microembolism sau toxicitate.4
Pentru perfuzia în Y a 2 medicamente este necesar ca ambele medicamente să fie compatibile din punct de vedere fizic.5 Această coadministrare are loc atunci când se amestecă medicamente într-un raport 1:1 și în absența unor semne vizibile de incompatibilitate, cum ar fi precipitarea sau schimbarea culorii. Pe de altă parte, pentru o coadministrare sigură a 2 medicamente în același diluant, amestecul trebuie să fie stabil din punct de vedere chimic. Aceasta înseamnă că este necesară o confirmare prealabilă a faptului că nu a avut loc nicio modificare semnificativă a concentrației unuia dintre medicamentele prezente în amestec.6
Standardizarea concentrației soluțiilor de perfuzie este una dintre cele mai utile măsuri de prevenire a erorilor de medicație în cadrul secției de terapie intensivă, în special în cazul medicamentelor cu risc ridicat, datorită potențialului lor de a provoca leziuni grave și pentru că acestea au cea mai mare incidență a erorilor de medicație.
O altă măsură foarte recomandată pentru administrarea în siguranță a medicamentelor este aceea de a avea la dispoziție informații fiabile privind compatibilitatea medicamentelor atunci când se administrează medicamente comune la pacienții aflați în stare critică. Cu toate acestea, informațiile privind compatibilitatea medicamentelor sunt puține și, de multe ori, dificil de interpretat din cauza diferitelor concentrații utilizate, a lipsei de informații privind tehnicile de evaluare folosite sau a calității tehnice suspecte a surselor. Lipsa de informații cu privire la amestecul sigur de 2 medicamente creează probleme în activitatea zilnică a echipelor de asistență medicală de la terapie intensivă. Adăugată la riscul de complicații asociate administrării a 2 molecule incompatibile, această lipsă de informații poate face ca asistenta să fie nevoită să caute noi accese venoase pentru a administra medicamentele separat, ceea cecrește riscul de complicații infecțioase sau tromboembolice.
Obiectivul acestei revizuiri este de a aduna informațiile publicate cu privire la compatibilitatea fizică și chimică a celor mai frecvent utilizate medicamente la nivelul unei unități de terapie intensivă atunci când sunt perfuzate prin aceeași linie prin intermediul unui site în Y. De asemenea, de a evalua calitatea informațiilor publicate și de a genera un grafic de compatibilitate cu informații fiabile și actualizate pentru a îmbunătăți siguranța în administrarea medicamentelor la pacienții aflați în stare critică.
MetodologieStrategia de căutare
A fost efectuată o căutare sistematică în bazele de date Medline, Stabilis, Handbook on Injectable Drugs și Micromedex pentru identificarea de lucrări originale, articole de recenzie și meta-analize privind compatibilitatea fizică și chimică a medicamentelor. Din cauza abordării lor clinice și a lipsei unei metodologii de determinare a stabilității fizice și chimice, studiile de caz au fost eliminate. Ca punct de referință au fost utilizate recenziile publicate de Kanji et al. și López-Cabezas et al.5,7 . Căutarea s-a axat pe combinațiile de medicamente despre care acești autori nu aveau informații sau nu au căutat informații. Anii de publicare a studiilor au fost din anii 1990 până în decembrie 2017, iar limbile incluse au fost engleza, spaniola și franceza. Strategia de căutare a constat în utilizarea mai multor termeni care descriu informațiile de interes pentru a le combina cu operatorul boolean „OR”, urmată de rafinarea căutării cu ajutorul operatorului „AND”. Termenii utilizați au fost: compatibilitate fizică, stabilitatea medicamentului, y-site, y-injecție, medicament intravenos, plus denumirile și sinonimele medicamentelor de interes.
Medicamentele utilizate în cadrul revizuirii sunt utilizate în mod obișnuit în cadrul secției de terapie intensivă sunt adesea administrate prin perfuzie continuă. Concentrațiile utilizate ca referință sunt cele standardizate în centrul nostru7 pentru aceste medicamente și sunt în concordanță cu cele utilizate în mod obișnuit în majoritatea unităților de terapie intensivă (tabelul 1). Toate informațiile privind compatibilitatea găsită pentru o anumită moleculă cu privire la un interval de concentrație diferit sunt prezentate în tabelul 2. Procesul de căutare a referințelor pentru fiecare medicament a fost efectuat concomitent de către 2 cercetători independenți.
Medicamentele de studiu și concentrațiile utilizate ca referință pentru căutarea bibliografică.
| Drog | Concentrație standard | Drog | Drog | Concentrație standard |
|---|---|---|---|---|
| Adrenalină | 40mcg/mL | Isoproterenol | 4mcg/mL | |
| Amiodarona | 3.6mg/mL | Cetamina | 50mg/mL | |
| Argatroban | 1mg/mL | Labetalol | 2mg/mL | |
| Bicarbonat | 1mmol/L | Magneziu sulfat | 15mg/mL | |
| Clorură de calciu | 10mg/mL | Meropenem | 30mg/mL | |
| Gluconat de calciu | 10mg/mL | Methadone | 0.2mg/mL | |
| Ceftazidime | 24mg/mL | Midazolam | 4mg/mL | |
| Cisatracuriu | 2mg/mL | Milrinona | 0.2mg/mL | |
| Clonidină | 7.5mcg/mL | N-acetilcisteină | 50mg/mL | |
| Clorură de morfină | 1mg/mL | Naloxonă | 8mcg/mL | |
| Dexmedetomidină | 4mcg/mL | Nitroglicerină | 0.2mg/mL | |
| Diltiazem | 1mg/mL | Nitroprusiat | 0,2mg/mL | |
| Dobutamină | 8mg/mL | Noradrenalină | 0.32mg/mL | |
| Dopamină | 8mg/mL | Pantoprazol | 0,32mg/mL | |
| Esomeprazol | 0.32mg/mL | Piperacilină-tazobactam | 64mg/mL | |
| Fenilefrina | 0.2mg/mL | Clorură de potasiu | 120mEq/L | |
| Fentanil | 30mcg/mL | Propofol | 10mg/mL | |
| Flumazenil | 40mcg/mL | Remifentanil | 20mcg/mL | |
| Furosemid | 2mg/mL | Somatostatin | 24mcg/mL | |
| Heparină sodică | 50IU/mL | Vecuronium | 0.2mg/mL | |
| Insulină | 1IU/mL | Verapamil | 0,1mg/mL |
Combinații de medicamente compatibile din punct de vedere fizic și chimic cu concentrații sub marca de referință.
| Medicamentul nr. 1 | Concentrația maximă compatibilă | Medicamentul nr. 2 | Concentrația maximă compatibilă | |
|---|---|---|---|---|
| Adrenalină | 32mcg/mL | Pantoprazol | 0.8mg/mL | |
| 2mcg/mL | Verapamil | 0,08mg/mL | ||
| Amiodaronă | 4mg/mL | Fenilefrina | 0.04mg/mL | |
| 6mg/mL | Furosemid | 1mg/mL | ||
| 15mg/mL | Nitroprusside | 0.3mg/mL | ||
| Clorură de calciu | 4mg/mL | Dobutamină | 4mg/mL | |
| Gluconat de calciu | 4mg/mL | 4mg/mL | Dobutamină | 4mg/mL |
| Ceftazidimă | 120mg/mL | Dobutamină | 1mg/mL | |
| 120mg/mL | Dopamină | 0.4mg/mL | ||
| 125mg/mL | Ketamina | 10mg/mL | ||
| Dobutamina | 1mg/mL | Heparina | 50IU/mL | |
| 4mg/mL | Sulfat de magneziu | 40mg/mL | ||
| 4mg/mL | Clorură de potasiu | 60mEq/L | ||
| Dopamină | 3.2mg/mL | Midazolam | 2mg/mL | |
| Fentanil | 12.5mcg/mL | Remifentanil | 0,25mg/mL | |
| Heparină | 20IU/mL | Verapamil | 0.08mg/mL | |
| Isoproterenol | 4mcg/mL | Sulfat de magneziu | 1mg/mL | |
| 200mcg/mL | Clorură de potasiu | 40mEq/L | ||
| 4mcg/mL | Vecuronium | 0.1mg/mL | ||
| 10mcg/mL | Verapamil | 0.08mg/mL | ||
| Meropenem | 22mg/mL | Clorură de potasiu | 40mEq/L | |
| Naloxonă | 0,8mcg/mL | Verapamil | 0.08mg/mL | |
| Nitroglicerină | 0,1mg/mL | Verapamil | 0,08mg/mL | |
| Nitroprusiat | 0,2mg/mL | Vecuroniu | 0.1mg/mL | |
| 0,1mg/mL | Verapamil | 0,08mg/mL | ||
| Noradrenalină | 0,008mg/mL | Verapamil | 0.08mg/mL | |
| Piperacilina-tazobactam | 40mg/mL | Dexmedetomidină | 4mcg/mL | |
| 40mg/mL | Remifentanil | 250mcg/mL | ||
| Potasiu clorură de potasiu | 100mEq/L | Remifentanil | 250mcg/mL |
Este în concordanță cu casetele gri specificate ca I/C, așa cum se arată în Fig. 2.
Selecția studiilor
După căutarea de referințe, 2 recenzenți independenți au evaluat calitatea studiilor folosind un proces de evaluare colegială. Această analiză a fost realizată după criterii de calitate bazate pe opinia experților și urmărind ghidurile de practică clinică8-11:
-
Reproductibilitatea studiului: descrierea ingredientului activ și a diluantului, condițiile și metodologia studiului.
-
Numărul de teste efectuate (cel puțin în triplu exemplar).
-
Timpurile scurse în timpul prelevării probelor în cadrul analizei de stabilitate: se recomandă o perioadă de prelevare a probelor de 5 ori, inclusiv un timp de prelevare a probelor de 0,
-
Studii efectuate pentru evaluarea stabilității amestecului: (a) transparența: pentru particule vizibile, observarea cu un panou negru mat, numărarea automată a particulelor sau turbidimetrie; pentru particule subvizibile, utilizarea microscopiei optice, spectrofotometriei sau turbidimetriei; (b) schimbarea culorii: inspecție vizuală sau spectrofotometrie; (c) formarea de gaze: inspecție vizuală; (d) pH; și (e) stabilitatea chimică: măsurarea variației concentrației celor 2 medicamente.
Crearea graficului de rezultate
A fost creat un grafic cu toate combinațiile posibile ale medicamentelor de interes. Căsuțele au fost denumite cu un „C” dacă amestecul era compatibil, cu un „I” dacă era incompatibil și cu „I/C” dacă stabilitatea depindea de condiții speciale. Combinațiile de medicamente fără date de compatibilitate au fost lăsate necăsătorite.
RezultatePerformanța căutării de referințe
Au fost identificate în total 48 de lucrări. Fig. 1 prezintă procesul de selecție. Din cele 29 de lucrări incluse în analiză, 4 au fost scrise în spaniolă, 3 în franceză și 22 în engleză. În ceea ce privește datele de publicare, 8 lucrări au fost publicate între 1990 și 1999, 10 între 2000 și 2009, iar restul de 11 lucrări au fost publicate între 2010 și 2017.
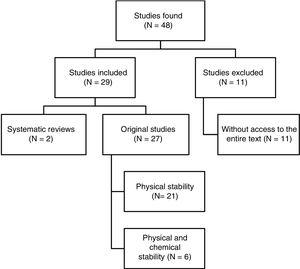
Rezumat structurat al rezultatelor căutării de referință.
Calitatea studiilor găsite
Niciuna dintre lucrările studiate nu a îndeplinit toate criteriile de calitate stabilite în această analiză. Cu toate acestea, 93% dintre lucrări au descris condițiile și metodologia studiului cu suficiente detalii pentru a garanta reproductibilitatea acestuia.
Testele au fost efectuate în triplu exemplar doar în 26% din cazuri. Dimpotrivă, 81% dintre studii au respectat recomandarea de a preleva probe în momentul 0, deși doar 10 au obținut o probă în 5 momente diferite.
În ceea ce privește testele efectuate pentru a evalua stabilitatea probelor, toate studiile au evaluat transparența, în timp ce 93% dintre studii au raportat o modificare a culorii prin inspecție vizuală. Alte metode au fost utilizate în 16 studii (59%) pentru a vedea particulele subvizibile. 67% dintre studii au evaluat formarea de gaze și doar 12 au măsurat modificările pH-ului în timp. Doar 6 studii au evaluat stabilitatea chimică a amestecurilor, cromatografia lichidă de înaltă rezoluție fiind metoda utilizată în 5 studii pentru a măsura concentrația ingredientelor active din amestec.
Rezultatele privind această secțiune sunt rezumate în tabelul 3.
Rezumat al criteriilor de calitate ale lucrărilor publicate.
| Indicator de calitate | Numărul de studii (%) | ||
|---|---|---|---|
| Evaluarea formării precipitatelor | 27 (100) | 12,13,16-40 | |
| Evaluarea modificării culorii | 25 (93) | 12,13,16-27,30-40 | |
| Măsurarea modificării pH-ului | 12 (44) | 12,13,16,18,19,22,26,27,29,38,39 | |
| Evaluarea formării de gaze | 18 (67) | 12,13,17,19-21,24-26,31,33-40 | |
| Analiză efectuată în triplu exemplar | 7 (26) | 18,21,22,29,34,35,38 | |
| Descrierea metodologiei utilizate (include numărul și frecvența observațiilor și condițiile de studiu) | 24 (89) | 12,13,17-24,26-33,35-40 | |
| Descrierea diluenților tuturor medicamentelor de studiu | 21 (78) | 13,17-29,33,35-40 | |
| Descrierea materialului recipientelor de studiu | 22 (81) | 12,13,17-31,33,36-39 | |
| Stabilitate chimică | 6 (22) | 16,18,19,19,22,29,38 |
Rezultatele compatibilității fizico-chimice
Au fost selectate 44 de medicamente utilizate în perfuzie continuă în cadrul secției de terapie intensivă, inclusiv o soluție pentru nutriție parenterală cu și fără lipide și 3 antibiotice beta-lactamice. Compatibilitatea acestora este prezentată în Fig. 2. Datele obținute prin analizele efectuate de Kanji et al. și López-Cabezas et al. au furnizat informații de compatibilitate pentru 393 din 945 de combinații posibile.5,7 După finalizarea analizei sistematice, au fost adăugate noi date de stabilitate pentru 82 de combinații de medicamente. Noile rezultate au evidențiat 29 de combinații compatibile, 27 de combinații incompatibile și 26 de combinații compatibile în condiții specifice. Prin urmare, tabelul final prezintă datele de compatibilitate pentru 475 din 945 de combinații posibile de 2 medicamente (50,3%). Dintre acestea, 366 sunt compatibile (77,1%), 80 sunt incompatibile (16,8%) și 29 sunt compatibile în condiții specifice (6,1%), așa cum se arată în tabelul 2.

Rezumat al compatibilităților fizice și chimice. C, compatibil; I, incompatibil; I/C, compatibil în condiții speciale. Casetele punctate arată că amestecul este compatibil doar cu serul glicozilat. Căsuțele cu linii diagonale arată compatibilitatea doar cu ser fiziologic.
Discuție
Asigurarea că utilizarea medicamentelor este sigură este unul dintre principalele angajamente asumate de furnizorii de servicii medicale față de pacienții lor. În cadrul secției de terapie intensivă și având în vedere cantitatea uriașă de medicamente administrate pe cale intravenoasă și numărul limitat de căi de administrare ale pacienților, această siguranță este uneori compromisă din cauza riscurilor pe care le implică administrarea concomitentă de medicamente incompatibile la pacienți deosebit de vulnerabili.
Baze de date online, cum ar fi Stabilis 4.0, sunt foarte utile pentru a căuta informații privind compatibilitatea medicamentelor. Cu toate acestea, personalul care administrează medicamentele consideră că fișele sunt mult mai utile, deoarece pot consulta rapid informațiile de care au nevoie la un moment dat. Acest lucru este deosebit de interesant mai ales în situații de urgență, când orice întârziere cauzată de personalul medical poate avea consecințe la nivelul pacientului.
Acest studiu s-a axat pe analiza compatibilității fizice și chimice a medicamentelor intravenoase cel mai frecvent utilizate prin perfuzie la locul Y în cadrul secției de terapie intensivă și pe sintetizarea informațiilor obținute într-o fișă cu dublă intrare. Studiile de compatibilitate fizică sunt cele mai frecvente dintre toate, deoarece sunt ușor de efectuat. Studiile de stabilitate chimică, însă, nu sunt, deoarece necesită tehnici analitice mai sofisticate pentru a determina concentrația inițială și finală a medicamentelor.
În ciuda acestui fapt, numărul de combinații medicamentoase studiate este încă insuficient. După cum arată Fig. 2, nu am putut găsi informații privind compatibilitatea fizică și chimică a tuturor combinațiilor propuse; de exemplu, în cazul flumazenilului și al piperacilinei-tazobactamului am putut determina stabilitatea doar cu 4 medicamente și în ambele cazuri cele 39 de combinații rămase au rămas fără informații.
Chiar dacă am lua în considerare toate combinațiile posibile propuse și am adăuga noile date găsite, am avea în continuare zero informații privind compatibilitatea fizică și chimică a 470 de combinații. Acest lucru înseamnă că avem date disponibile doar pentru 50,3% din toate combinațiile posibile sugerate.
Cele mai problematice combinații în ceea ce privește incompatibilitatea sunt medicamentele a căror stabilitate este strâns legată de intervalul de pH; acesta este cazul bicarbonatului de sodiu, al furosemidului sau al pantoprazolului. Furosemidul, de exemplu, are nevoie de un pH bazic pentru a garanta stabilitatea moleculei în soluție, motiv pentru care amestecul cu medicamente acide (pH
4) determină turbiditate și precipitare.12
>Prezența adjuvanților în formularea farmaceutică, concentrația și expunerea la temperaturi extreme sau luminozitate sunt alți factori asociați cu incompatibilitatea medicamentelor.13 Există momente în care o anumită combinație de medicamente poate fi stabilă într-un anumit diluant și incompatibilă în altul; de exemplu, dopamina este compatibilă cu amiodarona doar atunci când ambele sunt dizolvate în ser glicozilat la 5%, deoarece aceasta din urmă este instabilă în soluții saline la 0,9%. Astfel, dacă acest amestec presupus compatibil se realizează în ser fiziologic, se poate produce o pierdere de concentrație a amiodaronei cu riscul corespunzător de lipsă de răspuns terapeutic.
Pe de altă parte, în multe cazuri, calitatea studiilor publicate până în prezent poate fi mai bună. Ar fi bine să existe o mai mare uniformitate în ceea ce privește standardele de calitate ale acestui tip de studii. De exemplu, chiar dacă pH-ul este un factor critic în stabilitatea medicamentelor în soluție, acesta a fost verificat doar în 12 din cele 27 de lucrări. În mod similar, turbidimetria sau microscopia – tehnici mai precise decât observația vizuală pentru detectarea particulelor și a modificărilor de culoare – sunt subutilizate. În ultimii câțiva ani, mai mulți experți au publicat ghiduri pentru proiectarea studiilor de stabilitate a medicamentelor.8-11 Putem doar spera că acest lucru va îmbunătăți calitatea generală a acestui tip de studii în viitor.
Autorii anteriori au publicat recenzii ale acestor caracteristici. De exemplu, Flamein et al.14 au studiat această problemă în secțiile de terapie intensivă neonatală; Knudsen et al.15 au făcut lumină în ceea ce privește compatibilitatea analgezicelor și a sedativelor. Revizuirea noastră se bazează pe lucrările anterioare realizate de Kanji et al.5 în Canada și López-Cabezas.7 în Spania. Ea a fost completată cu noile informații disponibile despre medicamente în cadrul nostru și cu date despre cele mai utilizate concentrații de medicamente.
În total, am găsit informații despre 82 de noi combinații de medicamente din 27 de referințe diferite, inclusiv combinații de 3 antibiotice beta-lactamice (ceftazidime, meropenem și piperacilină-tazobactam) utilizate pe scară largă la nivelul secției de terapie intensivă. În ultimii ani au fost confirmate avantajele farmacocinetice ale unei căi de administrare prin perfuzie prelungită a acestor 3 antibiotice.16-19
Perfuzii la concentrații de medicament care le depășesc pe cele obișnuite sunt adesea utilizate la pacientul în stare critică. În acest sens, nu am putut găsi date cu privire la toate combinațiile de medicamente în ceea ce privește concentrațiile ridicate utilizate în mediul de terapie intensivă (tabelul 1); cu toate acestea, în unele cazuri, am obținut informații cu privire la concentrații mai mici decât cele raportate în această revizuire. Aceste cazuri sunt prezentate pe graficul de compatibilitate (Fig. 2) ca fiind compatibilitate condiționată (I/C), adică faptul că combinația a fost studiată la o concentrație diferită de cea standard.
Datele de stabilitate raportate în această recenzie nu pot fi generalizate la alte combinații de medicamente sau la concentrații diferite de cele descrise. De asemenea, informațiile furnizate se referă la 2 combinații medicamentoase, iar incompatibilitățile pot fi prezente cu>2 combinații medicamentoase în același timp, ceea ce este foarte puțin recomandabil. Cu toate acestea, medicamentele și concentrațiile selectate sunt cele mai utilizate în secțiile de terapie intensivă pentru adulți din majoritatea spitalelor.
Până când vom avea studii de compatibilitate noi și mai bune care să facă lumină în această problemă, această recenzie poate fi o actualizare ușor de citit a dovezilor disponibile cu privire la compatibilitatea medicamentelor cel mai frecvent utilizate în cadrul secțiilor de terapie intensivă. Scopul său este de a contribui la administrarea în siguranță a medicamentelor la pacienții care se pot confrunta cu consecințe de o gravitate mai mare din cauza fragilității lor.
Contribuția autorilor
Genís Castells Lao: proiectarea și ideea studiului, extragerea datelor, analiza și interpretarea datelor; redactarea lucrării sau revizuirea critică a materialului intelectual; și aprobarea finală a acestei versiuni.
Montse Rodríguez Reyes: designul și ideea studiului, extragerea datelor, analiza și interpretarea datelor; proiectul de hârtie sau revizuirea critică a materialului intelectual; și aprobarea finală a acestei versiuni.
Judit Roura Turet: extragerea datelor, analiza și interpretarea datelor; proiectul de hârtie sau revizuirea critică a materialului intelectual; și aprobarea finală a acestei versiuni.
Marta Prat Dot: extragerea datelor, analiza și interpretarea datelor; proiectul de hârtie sau revizuirea critică a materialului intelectual; și aprobarea finală a acestei versiuni.
Dolors Soy Muner: proiectarea și ideea studiului; proiectul de hârtie sau revizuirea critică a materialului intelectual; și aprobarea finală a acestei versiuni.
Carmen López Cabezas: designul și ideea studiului, extragerea datelor, analiza și interpretarea datelor; proiectul de hârtie sau revizuirea critică a materialului intelectual; și aprobarea finală a acestei versiuni.
Conflicte de interese
Autorii nu au declarat niciun fel de conflicte de interese.
.