Care electron dintr-un atom poate fi identificat în mod unic printr-un set de patru numere cuantice.

Deși descoperirea lor a necesitat o matematică avansată, toate acestea sunt numere convenționale:trei dintre ele pot lua doar valori întregi simple; al patrulea este o fracție simplă.
Primile trei numere cuantice rezultă din funcția de undă, Ψ, obținută prin rezolvarea ecuației lui Schrödinger.
Cele de-al patrulea număr cuantic, spinul electronic, rezultă din descoperirea faptului că electronii au două orientări posibile.
Numerele și definițiile lor sunt următoarele:
Numerele cuantice
| Număr cuantic | Nume | Valori posibile | Informații |
|---|---|---|---|
| n | număr cuantic principal | 1, 2, 3,…., n | Define învelișul energetic ocupat de electron. Învelișurile cele mai apropiate de nucleu au cea mai mică valoare a lui n și cea mai mică energie potențială.n este primul număr scris în configurațiile electronice, cum ar fi cea a magneziului: 1s2 2s2 2p6 3s2 |
| l | număr cuantic de moment unghiular orbital (numit și număr cuantic azimutal) |
0, 1, 2,…., (n-1) | Define subînvelișul energetic – în sistemele cu mai mulți electroni, subînvelișurile au energii diferite. l definește litera subînvelișului în configurațiile electronice. De exemplu: 1s2 2s2 2s2 2p6 3s2 l = 0 dă o subcoajă s. l = 1 dă o subcoajă p. l = 2 dă o subcoajă d, etc. |
| ml | număr cuantic magnetic | l, (l+1), …, 0,…,… , (l+1), l | Define orientarea orbitalului subshell. Subshell-ul p, cu l = 1, are trei valori ml: -1, 0, 1.Acestea indică faptul că există trei orbitali p.adică orbitalii px, py și pz. Subshell-ul d, cu l = 2, are cinci valori ml: -2, -1, -1, 0, 1, 2.Acestea indică faptul că există cinci orbitali d. |
| ms | numărul cuantic de spin al electronului | -½ sau +½ | Electronii au două orientări de spin posibile. |
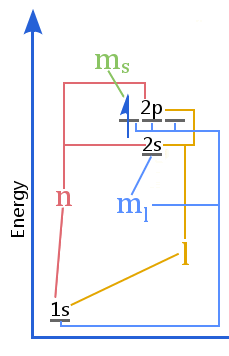
Diagrama de nivel energetic arată relația dintre numerele cuantice în raport cu învelișurile, subînvelișurile, orbitele și spinul electronului într-un atom.
Niciun electron dintr-un atom nu are în comun toate cele patru numere cuantice.Fiecare electron poate fi identificat în mod unic prin numărul său cuantic – a se vedea principiul de excludere Pauli.
Formele orbitalilor nu sunt date de numerele cuantice, ci sunt densități de probabilitate – hărți tridimensionale ale spațiului din jurul nucleului în care se va găsi un electron în 99 la sută din timp.Formele orbitalelor sunt obținute din pătratul funcției de undă, Ψ2.Locația și momentul precis al oricărui electron nu pot fi cunoscute niciodată – a se vedea principiul incertitudinii lui Heisenberg.

.