Introducere
Infecția cu virusul hepatitei B (VHB) este cea mai frecventă cauză a cirozei hepatice și a carcinomului hepatocelular în cea mai mare parte a Asiei.1,2 Patogeneza hepatitei cronice este mediată de interacțiunea dintre reacția imunitară a gazdei și hepatocitele care prezintă antigene VHB.3,4 Studii anterioare au demonstrat că expresia antigenelor VHB de către hepatocite este legată în mod important de stadiul și activitatea bolii hepatice cronice. În faza de toleranță imună, antigenele de bază ale hepatitei B (HBcAg) se găsesc mai ales în nucleu și se corelează cu replicarea VHB, în timp ce, în faza de clearance imunitar care urmează, are loc o deplasare intrahepatică a HBcAg din nucleu în citoplasmă și este asociată cu activitățile histologice ale hepatitei cronice.5,6 În cazurile de exprimare intrahepatică a antigenului de suprafață al hepatitei B (HBsAg), au fost raportate trei modele – tipul omogen, hepatocitul de sticlă mată (GGH) de tip I și GGH de tip II. Modele omogene în prezentări grupate, discrete sau slabe au fost observate la pacienții cu viremie ridicată sau hepatită activă. GGH-urile de tip I sunt de obicei împrăștiate izolat în lobulii hepatici cu expresie omogenă densă de tip incluziune, în timp ce GGH-urile de tip II exprimă antigene de suprafață la periferia hepatocitelor, care se grupează în grupuri și sunt în general prezente în timpul fazei de replicare scăzută și devin prevalente de la hepatita activă până la ciroza hepatică și carcinomul hepatocelular.7-10 Prin urmare, atât expresia intrahepatică a HBcAg, cât și cea a HBsAg sunt strâns legate de evoluția naturală a infecției și de replicarea VHB.
Printre fazele hepatitei cronice B, faza de limpezire imunitară sau denumită hepatită cronică B HBeAg-pozitivă a apărut adesea la populația mai tânără, a prezentat activități histologice mai puțin severe și a adăpostit mai puține rate de mutație precore A1896 și mutații T1762/A1764 ale promotorului nucleului bazal (BCP) decât hepatita cronică B HBeAg-negativă.11-14 Evoluția hepatitei cronice B este dinamică, care a rezultat din interacțiunea dintre replicația virală și sistemul imunitar al gazdei. În consecință, diversitatea caracteristicilor clinice sau a activităților histologice este frecvent observată la pacienții HBeAg pozitiv. De exemplu, între 34 și 55% dintre pacienți prezintă fibroză punte sau ciroză în histologia hepatică, în timp ce restul pacienților prezintă fibroză ușoară.15,16 S-a demonstrat că acumularea HBsAg în hepatocite se asociază cu mutații virale specifice și este legată de activitățile bolii.8,9 Este interesant de investigat caracteristicile expresiei intrahepatice a HBsAg la pacienții cu severitate diferită a histologiei hepatice.
Mutanții virali evoluează de obicei sub presiunea supravegherii imune a gazdei. Printre mutanții HBV care apar în mod natural, mutațiile BCP T1762/A1764 au devenit prevalente pe măsură ce boala a progresat și s-a constatat frecvent că sunt asociate cu boala hepatică avansată și carcinomul hepatocelular.17,18 Tiparele de expresie intrahepatică a HBsAg s-au modificat, de asemenea, în cursul evoluției naturale a hepatitei cronice B. Asocierea dintre mutațiile BCP T1762/A1764 și expresia intrahepatică a HBsAg este încă necunoscută și a rămas de studiat.
Prin urmare, scopul acestui studiu a fost de a evalua caracteristicile expresiei intrahepatice a HBsAg și de a analiza asocierea cu histologia hepatică, markerii de replicare virală și mutanții VHB în hepatita cronică B pozitivă la HBeAg.
Materiale și metodePacienți
Un total de 181 de pacienți cu antigenul e al hepatitei B (HBeAg) pozitiv la hepatita B (HBeAg), naivi la tratament, care au îndeplinit criteriile de includere, au fost înrolați retrospectiv în acest studiu. Criteriile de includere au fost vârsta de peste 18 ani și mai puțin de 70 de ani, AgHBs seric pozitiv pentru mai mult de 6 luni și nivel seric al ADN VHB ≥ 100.000 de copii/mL, nivel seric anormal al alanin aminotransferazei, nicio altă etiologie explicabilă a hepatitei cronice, inclusiv alcool, hepatită autoimună sau markeri de infecție cu virusul hepatitei C, virusul hepatitei D sau virusul imunodeficienței umane, și lipsa unui istoric de tratament anti-HBV și a unui istoric de tratament anti-HBV și a unui specimen de biopsie hepatică disponibil pentru evaluare histologică. Serul și biopsia hepatică ale tuturor pacienților au fost prelevate înainte de tratamentele antivirale, iar probele au fost păstrate la -70 oC până la testare. Acest studiu a fost aprobat de Comitetul de evaluare instituțională al Spitalului Universitar Național Cheng Kung (nr: ER-99-398). A fost obținut consimțământul în cunoștință de cauză, în conformitate cu Declarația de la Helsinki.
Sesizări virologice VHB
Genotiparea VHB a fost efectuată prin reacția în lanț a polimerazei multiplex, așa cum este descris în altă parte. 19 Nivelul ADN VHB seric a fost măsurat cu ajutorul testului COBAS Amplicor HBV Monitor (testul COBAS-AM, Roche Diagnostics, Branchburg, NJ). Nivelul seric de AgHBs a fost cuantificat cu testul Abbott Architect HB-sAg QT (Abbott Diagnostics, Rungis, Franța) cu un interval dinamic de 0,05-250,0 UI/mL. Probele cu niveluri de HBsAg > 250 UI/mL au fost retestate la diluții de 1:20 și 1:1000.
Reacția în lanț a polimerazei și secvențierea regiunilor precore și BCP
ADN al virusului HBV a fost extras din 50 μL de ser cu ajutorul kitului Blood and Tissue Genomic Mini Kit (VIOGENE, Taipei, Taiwan). Prima rundă de PCR a fost efectuată în următoarele condiții: 96 oC timp de 2 minute, 94 oC timp de 1 minut, 54 oC timp de 1 minut și 72 oC timp de 2 minute cu amorsele 5′-ACCTCTCTGCACGTAGCATGG (înainte) și 3′-GGATTAAAGACACAGAGGTAGCAGTAGAAG (invers). A doua rundă de PCR a fost efectuată în aceleași condiții cu amorsele 5′-ATGTCAACGACCGACCTTGA (înainte) și 3′-TTCCCACCTCTTATGAGTCCAAG (invers). Produsele PCR purificate au fost apoi secvențiate direct cu ajutorul unui secvențiator automat de ADN ABI 310 și a kitului ABI PRISM Big Dye Terminator Cycle Sequencing Ready Reaction Kit (Applied Biosystems) cu primerul forward care a fost utilizat în timpul celei de-a doua runde de PCR.
Histologia ficatului
Histologia ficatului a fost evaluată de un singur patolog care nu cunoștea antecedentele pacienților. Necroinflamația și fibroza au fost evaluate pe baza gradului de necroinflamație Knodell (variind de la 0 la 18)20 și, respectiv, a stadiului de fibroză Ishak (variind de la 0 la 6),21.
Corecția imunohistochimică a fost efectuată așa cum este descris în altă parte.22 Pe scurt, secțiunile deparafinate cu grosimea de 5 μm au fost incubate cu anti-HBsAg monoclonal de șoarece (Clona 3E7, Dako Corp., Carpinteria,SUA) și anti-HBcAg (Novocastra Laboratories, Newcastle, Marea Britanie) peste noapte la 4°C. Diluția optimă de anti-HBsAg sau anti-HBcAg a fost determinată utilizând țesut hepatic de la un purtător de VHB ca martor pozitiv. Kitul StrAviGen Super Sensitive MultiLink (BioGenex) a fost utilizat pentru a detecta complexul imun rezultat. Activitatea peroxidazei a fost vizualizată cu ajutorul unui kit de substrat de aminoetilcarbazol (Zymed Laboratory, Inc, San Francisco, CA). În final, secțiunile au fost contracolorate cu hematoxilină. Ca martor negativ, anticorpul primar a fost înlocuit cu imunoglobulină de șoarece neimună în timpul incubării. S-au înregistrat modelele de exprimare a HBcAg de către nucleu, citoplasmă sau ambele. Modelele de expresie a HBsAg au fost clasificate ca fiind omogene, GGH de tip I, GGH de tip II.22 Hepatocitele colorate omogen au fost identificate ca hepatocite cu colorare citoplasmatică omogenă moderată până la puternică; GGH de tip I au fost identificate ca hepatocite cu colorare globulară densă sau „de tip incluziune”, iar GGH de tip II au fost identificate ca hepatocite cu colorare a antigenului de suprafață la marginile sau periferia celulelor.6,22 GGH-urile de tip I se împrăștie singure sau se grupează în lobulii hepatici, în timp ce GGH-urile de tip II se grupează în mod constant în noduli. Nivelurile de expresie ale HBcAg și HBsAg au fost notate semicantitativ în funcție de proporția de celule imunomarcate, pe o scală de la 0 la 4+, corespunzând pozitivității în 0, 1-10, 11-25, 25-50% și peste 50% din hepatocitele examinate.
Analize statistice
Datele au fost exprimate ca medie ± deviație standard. Variabilele continue au fost comparate cu ajutorul testului Mann-Whitney U sau Kruskal-Wallis ANOVA pentru analiza univariată. Variabilele categoriale au fost analizate utilizând testul χ2 sau testul exact Fisher. Factorii independenți care au fost asociați cu nivelurile de expresie intrahepatică a AgHBs au fost realizați utilizând analiza de regresie logistică multivariată. Manipularea datelor și analizele statistice au fost efectuate cu ajutorul software-ului SPSS pentru Windows, versiunea 17.0 (SPSS Inc., Chicago, IL).
RezultateCaracteristica pacienților înrolați
Tabelul 1 enumeră caracteristicile demografice ale celor 181 de pacienți înrolați. Majoritatea pacienților au fost de sex masculin (69,1%) și 63,0% dintre ei prezentau genotipul C al VHB. Mutația precore A1896 a fost detectată la 20 de pacienți (11,0%) și mutațiile BCP T1762/A1764 au fost detectate la 38 de pacienți (21,0%). Dintre cei 181 de pacienți, la 105 pacienți (58,0%) a fost detectată o colorație HB-sAg pozitivă. Pacienții cu colorație HBsAg au prezentat un nivel semnificativ mai ridicat de AgHBs seric (P
Caracteristici clinice, virologice și histologice ale celor 181 de pacienți.
| Caracteristici | Valoare | ||||
|---|---|---|---|---|---|
| Expresia HBsAg | Valoare P | ||||
| Toți pacienții (n = 181) | Negativ (n = 76) | Positiv (n = 105) | |||
| Vârsta (ani) ± SD | 36.4 ± 10.5 | 34.2 ± 9.2 | 38.0 ± 11.2 | 0.009 | |
| Gender (masculin/feminin) | 125/56 | 50/26 | 75/30 | 0.418 | |
| Nivel mediu AST (U/L) ± SD | 59,7 ± 51,2 | 58,7 ± 42,5 | 60,5 ± 56.8 | 0,634 | |
| Nivel mediu ALT (U/L) ± SD | 116,3 ± 124,2 | 120,2 ± 100,8 | 113,5 ± 139.1 | 0,282 | |
| Genotipul HBV (B/C) | 114/67 | 66/10 | 48/57 | ||
| Precore: G1896/A1896 | 20/161 | 13/63 | 7/98 | 0.027 | |
| BCP:* mutant/sălbatic | 38/143 | 12/64 | 26/79 | 0,144 | |
| HBV ADN (log copii/mL) | 8,4 ± 1.1 | 4,0 ± 0,7 | 4,3 ± 0,7 | ||
| Nivelul HBsAg ((log UI/mL) | 4,2 ± 0.7 | 8,1 ± 1,0 | 8,6 ± 1,1 | 0,003 | |
| Gradul mediu de necroinflamare Knodell ± SD | 5.0 ± 3,0 | 5,3 ± 2,8 | 4,7 ± 3,0 | 0,128 | |
| Stadiul mediu de fibroză Ishak ± SD | 1,8 ± 1,6 | 1,7 ± 1,2 | 1,9 ± 1,7 | 0.703 | |
Mutant, T1762 și A1764; sălbatic, A1762 și T1764. Testul χ2 a fost utilizat pentru variabilele de sex, genotip VHB, mutații ale promotorului nucleului precore și nucleului bazal, în timp ce testul Mann-Whitney U a fost utilizat pentru alte variabile. AST: aspartat aminotransferază. ALT: alanină aminotransferază. BCP: promotor bazal core. VHB: virusul hepatitei B.
Programe de distribuție a expresiei AgHBs
În ceea ce privește cei 105 pacienți care au prezentat expresia AgHBs, un model omogen (figura 1A) a fost detectat la 34 (32.4%), tipul I GGH (figura 1B) a fost detectat la 50 (47,6%) pacienți, tipul II GGH (figura 1C) a fost detectat la șapte (6,7%) pacienți, iar un model mixt a fost detectat la 14 (13,3%) pacienți. După cum se indică în tabelul 2, o prevalență mai mare a mutațiilor BCP T1762/A1764 a fost observată în cazul tipului II GGH (P = 0,001) în comparație cu alte modele. A existat o relație reciprocă între expresia HBsAg și markerii serici de replicare virală. În figura 1D se arată că pacienții cu expresie GGH de tip II au avut niveluri mai scăzute ale ADN VHB și titruri HBsAg, dar niveluri mai ridicate ale expresiei HBsAg intrahepatice (figura 1D). În plus, histologia ficatului afișată de tipul II GGH a prezentat activități de necroinflamare și fibroză hepatică semnificativ mai severe, precum și un nivel mai ridicat de expresie intrahepatică a HBsAg (figura 1E).
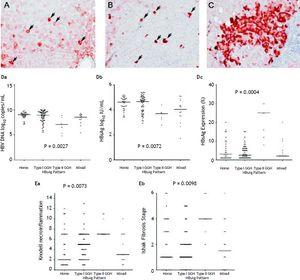
Planuri de retenție a AgHBs. A. Câteva hepatocite colorate moderat spre puternic cu citoplasmă omogenă de HBsAg (săgeți) într-un fond de hepatocite slab colorate. Nucleul fiecărui hepatocit colorat omogen a fost localizat în centrul celulei. B. În parenchimul hepatic erau împrăștiate hepatococite de tip I (GGH) cu colorație globulară densă sau de tip „incluziune” HBsAg (săgeți). C. Un grup de GGH de tip II a prezentat colorație HBsAg la marginea sau periferia celulei. Corelații între modelele de expresie a HBsAg și nivelul seric al ADN VHB (Da), nivelul seric al HBsAg (Db) și nivelul de expresie intrahepatic al HBsAg (Dc). Asocierea modelelor de expresie HBsAg și gradul de necroinflamare Knodell (Ea) și stadiul de fibroză Ishake (Eb). Comparațiile între grupuri au fost analizate prin Kruskal-Wallis ANOVA.
Caracteristici demografice în funcție de modelele de distribuție f expresia HBsAg.
| HBsAg Pattern (n = 105) | ||||||
|---|---|---|---|---|---|---|
| Mixt (n = 14) | Homogen | Tip I GGH | Tip II GGH | Valoare P | ||
| (n = 34) | (n = 50) | (n = 7) | ||||
| Vârsta (ani) ± SD | 36.3 ± 9.2 | 36.3 ± 10.0 | 39.2 ± 12.7 | 40.0 ± 7.9 | 0.104 | |
| Gender (masculin/feminin) | 11/3 | 26/11 | 35/15 | 6/1 | 0.720 | |
| Nivel mediu AST (U/L) ± SD | 64,9 ± 56,5 | 61,1 ± 38,6 | 49,9 ± 28,3 | 122.4 ± 168,7 | 0,474 | |
| Nivel mediu ALT (U/L) ± SD | 116,7 ± 112,4 | 114,6 ± 91,1 | 91,5 ± 63,8 | 259,1 ± 447.6 | 0,651 | |
| Genotipul HBV (B/C) | 10/4 | 15/19 | 22/28 | 1/6 | 0,085 | |
| Precore: G1896/A1896 | 0/14 | 3/31 | 4/46 | 0/7 | 0.594 | |
| BCP:* mutant/wild | 4/10 | 4/30 | 12/38 | 6/1 | 0.001 | |
| HBV ADN (log copii/mL) | 3,9 ± 1,0 | 4.5 ± 0,5 | 4,4 ± 0,7 | 3,6 ± 0,5 | 0,001 | |
| Nivelul HBsAg ((log UI/mL) | 8,2 ± 1.1 | 8,9 ± 0,7 | 8,7 ± 1,1 | 6,9 ± 1,5 | ||
| Gradul de necroinflamare knodell ± SD | 4.2 ± 2.9 | 4.2 ± 3.3 | 4.7 ± 2.7 | 8.6 ± 2.0 | 0.003 | |
| Stadiul de fibroză Ishak ± SD | 1,9 ± 1,9 | 1,9 ± 1,9 | 1,5 ± 1,3 | 4,1 ± 1,5 | 0.007 |
Mutant, T1762 și A1764; sălbatic, A1762 și T1764. Testul χ2 a fost utilizat pentru variabilele de sex, genotip VHB, mutații ale promotorului nucleului precore și nucleului bazal, în timp ce testul Mann-Whitney U a fost utilizat pentru alte variabile. AST: aspartat aminotransferază. ALT: alanină aminotransferază. BCP: promotor bazal core. VHB: virusul hepatitei B.
Nivelul de expresie al HBsAg
Figura 2A până la 2D prezintă ilustrarea măsurării semicantitative a expresiei HBsAg. Nu a existat niciun pacient care să aibă scara 4+ a expresiei HBsAg în acest studiu. S-a observat o relație reciprocă între replicarea virală și histologia hepatică. Pacienții cu scări 2+/3+ ale expresiei HBsAg au avut niveluri mai scăzute ale titrului HBsAg și ale nivelului ADN VHB, dar un grad de necroinflamare și un stadiu de fibroză semnificativ mai severe decât pacienții cu scări 1+ ale expresiei HBsAg și colorație HBsAg negativă (figura 2E). Acei pacienți care au prezentat un scor Knodell de grad de necroinflamare ≥ 5 sau un stadiu de fibroză Ishake ≥ 1 au avut procente semnificativ mai mari de expresie HBsAg (figura 3).
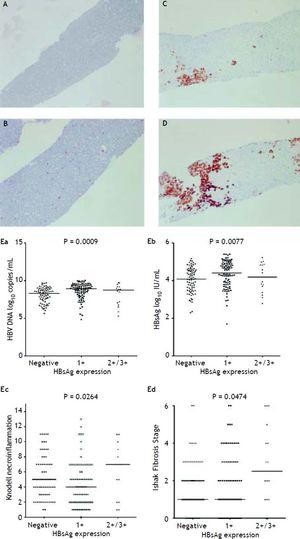
Expresia HBsAg măsurată semicantitativ în funcție de proporția de celule imunomarcate, pe o scară de la 0 la 3+, corespunzând pozitivității în (A) 0% (0), (B) 1-10% (C) 11-25% (2+) și (D) 25-50% (3+) din hepatocitele examinate. Corelații între nivelul de expresie a AgHBs și nivelurile serice de ADN VHB (Ea) și AgHBs (Eb), precum și gradul de necroinflamare Knodell (Ec) și stadiul de fibroză Ishak (Ed). Comparațiile între grupuri au fost analizate prin Kruskal-Wallis ANOVA.

Corelația expresiei HBsAg intrahepatic cu gradul de necroinflamare Knodell (A) și stadiul de fibroză Ishak (B). Comparațiile între grupuri au fost analizate prin testul U Mann-Whitney.
Caracteristici clinice ale expresiei HBsAg
În primul rând, am examinat asocierea dintre factorii virali și expresia HBcAg/HBsAg. Expresia HBsAg, nu și expresia HBcAg, a prezentat un nivel semnificativ mai scăzut în prezența mutației precore (P = 0,001). Pacienții cu genotip C au prezentat un stadiu de fibroză hepatică mai mare (P = 0,004). La pacienții cu mutații BCP T1762/A1764, s-a observat un grad de necroinflamare și un stadiu de fibroză semnificativ mai mare, precum și o expresie mai scăzută a HBcAg, fie în citoplasmă, fie în nucleu. Toate aceste observații au indicat o leziune hepatică activă. În plus, pacienții cu mutații BCP T1762/A1764 au prezentat o expresie intrahepatică mai mare a HBsAg (9,3 ± 8,0% față de 4,3 ± 5,0%, P = 0,008) (tabelul 3) (tabelul 3). În plus, am examinat factorii care se pot asocia cu nivelurile de expresie HB-sAg. În tabelul 4, au existat 16 pacienți care au prezentat scări 2+/3+ ale expresiei HBsAg și 1+ în cea a 89 de pacienți. O analiză univariată a arătat că scările 2+/3+ ale expresiei HBsAg au fost asociate cu mutațiile BCP T1762/A1764, precum și cu necroinflamarea și fibroza hepatică mai severe. O analiză de regresie multivariată a arătat că mutațiile BCP T1762/A1764 a fost factorul independent care a fost asociat cu scări 2+/3+ ale expresiei HBsAg intrahepatice.
Caracteristici clinice, virologice și histologice ale pacienților cu sau fără mutații virale.
| Mutație precore | Valoare P | Mutații BCP | Valoare P | ||||
|---|---|---|---|---|---|---|---|
| Nu (n = 98) | Da (n = 7) | Nu (n = 79) | Da (n = 26) | ||||
| Vârsta (ani) ± SD | 37.8 ±11.0 | 40.0 ± 13.7 | 0.541 | 36.0 ± 10.6 | 43.8 ±11.1 | 0.005 | |
| Gender (masculin/feminin) | 70/28 | 5/2 | 1.000 | 54/25 | 21/5 | 0.318 | |
| Nivel mediu AST (U/L) ± SD | 60,0 ± 58,3 | 71,3 ± 30,5 | 0,072 | 51,5 ± 32,1 | 87,3 ± 95.6 | 0,007 | |
| Nivel mediu ALT (U/L) ±SD | 112,2 ± 143,6 | 131,6 ± 39,1 | 0,031 | 98,2 ± 77,9 | 160,0 ± 242.0 | 0.080 | |
| Genotip HBV (B/C) | 45/53 | 3/4 | 1.000 | 44/35 | 4/22 | ||
| Precore: G1896/A1896 | 6/73 | 1/25 | 0.678 | ||||
| BCP:* mutant/wild | 25/73 | 1/6 | 0.678 | ||||
| HBV ADN (log copii/mL) | 3,9 ± 1,0 | 4,5 ± 0.5 | 0,959 | 4,5 ± 0,6 | 3,7 ± 0,6 | ||
| Nivelul HBsAg ((log UI/mL) | 8.2 ± 1,1 | 8,9 ± 0,7 | 0,892 | 8,8 ± 0,9 | 7,7 ± 1,4 | ||
| Gradul de necroinflamare a nodulului ± SD | 4,6 ± 3,0 | 6.1 ± 3,1 | 0,142 | 3,9 ± 2,7 | 7,2 ± 2,7 | ||
| Stadiul de fibroză Ishak ± SD | 1,8 ± 1,8 | 2,1 ± 0,9 | 0.286 | 1,3 ± 1,4 | 3,4 ± 1,6 | ||
| Expresie citoplasmatică HBcAg (%) | 53,6 ± 25,8 | 44,3 ± 30,5 | 0,402 | 56,3 ± 25.4 | 42.7 ± 25.8 | 0.018 | |
| Expresia nucleară HBcAg (%) | 13.5 ± 17.3 | 17.6 ± 31.6 | 0.800 | 17.6 ± 20.0 | 2.3 ±4.1 | ||
| Expresia HBsAg (%) | 5,8 ± 6,5 | 2,4 ± 1,5 | 0,274 | 4,3 ± 5,0 | 9,3 ± 8,0 | 0,0 | 0.003 |
Mutant, T1762 și A1764; sălbatic, A1762 și T1764. Testul χ2 a fost utilizat pentru variabilele de sex, genotip VHB, mutații ale promotorului nucleului precore și nucleului bazal, în timp ce testul Mann-Whitney U a fost utilizat pentru alte variabile. AST: aspartat aminotransferază. ALT: alanină aminotransferază. BCP: promotor bazal core. VHB: virusul hepatitei B.
Asociația dintre caracteristicile demografice și gradele de expresie a AgHBs.
| Univariate | Multivariate | |||||
|---|---|---|---|---|---|---|
| Expresia HBSAg, scară | 1+ (n = 89) | 2+/3+ (n = 16) | Valoare P | Odds ratio (95% CI) | Valoare P | |
| Vârsta | 38.2 ±11.2 | 36.6 ±11.1 | 0.608 | 0,963 (0,903-1,026) | 0,242 | |
| Gender (masculin/feminin) | 63/26 | 12/4 | 1.000 | |||
| Nivelul deAST (U/L) | 55,0 ± 37,7 | 90,4 ± 113,2 | 0,234 | 1,026 (0,991∼1.063) | 0,142 | |
| Nivelul de ALT (U/L) | 103,3 ± 84,4 | 170,1 ± 297,2 | 0,386 | 0,991 (0,978∼1.005) | 0.216 | |
| Genotip HBV (B/C) | 42/47 | 6/10 | 0.589 | 0.994 (0.234∼4.231) | 0.994 | |
| Precore A1896 mutation (+/-) | 7/82 | 0/16 | 0.592 | 0.000 (0.000∼) | 0.999 | |
| BCP:*mutant/Wild | 17/72 | 9/7 | 0.003 | 6.356 (1.204∼33.356) | 0.029 | |
| HBsAg level (log10IU/mL) | 4.3 ± 0.7 | 4.2 ± 0.8 | 0.180 | 2.096 (0.598∼7.349) | 0.247 | |
| Serum HBV DNA (log10 copies/mL) | 8.6 ± 1.1 | 8.1 ± 1.4 | 0.135 | 0.731 (0.386∼1.383) | 0.335 | |
| Knodell necroinflammation grading | 4.4 ± 2.9 | 6.3 ± 3.3 | 0.027 | |||
| Ishak fibrosis stage | 1.7 ± 1.6 | 2.9 ± 2.1 | 0.041 | |||
| HBcAg cytoplasmic expression (%) | 53.1 ± 25,8 | 52,3 ± 28,5 | 0,915 | |||
| Expresia nucleară a HBcAg (%) | 14,4 ± 18,3 | 10.1 ± 19,3 | 0,389 | |||
Mutant, T1762 și A1764; sălbatic, A1762 și T1764. Analiză univariată: testul χ2 a fost utilizat pentru variabilele de sex, genotip VHB, mutații ale promotorului nucleului precore și nucleului bazal, în timp ce testul Mann-Whitney U a fost utilizat pentru alte variabile. Analiza multivaiată: Analiza de regresie logistică exprimată ca Odds ratio cu un interval de încredere de 95% și valori P. AST: aspartat aminotransferază. ALT: alanină aminotransferază. BCP: core promoter bazal. VHB: virusul hepatitei B.
Discuții
Expresia intrahepatică a HBsAg este asociată cu diferite stadii replicative și evoluția bolii în cursul evoluției naturale a hepatitei cronice B.7,10,23 GGH de tip I se prezintă predominant în stadiul de hepatită activă, în timp ce GGH de tip II se prezintă în principal în stadiul de hepatită inactivă sau ciroză.8 În acest studiu am demonstrat că GGH de tip II se asociază cu o histologie hepatică mai severă, însoțită de niveluri semnificativ mai scăzute ale ADN VHB seric și ale titrului AgHBs și de niveluri relativ mai ridicate ale expresiei intrahepatice a AgHBs. Această relație reciprocă între histologia hepatică și replicarea VHB a indicat faptul că apariția GGH de tip II ar putea fi un marker al bolii hepatice avansate în timpul evoluției bolii în cazul hepatitei cronice B pozitive la HBeAg. S-a raportat că modelele de exprimare a HB-sAg sunt legate de mutații virale distincte care au impact asupra reglării replicării VHB și a defectului de secreție a antigenului de suprafață din hepatocite.9,24 GGH de tip II a găzduit în mod constant mutații de deleție Pre-S2 care au diminuat sinteza proteinelor medii de suprafață și apoi au dus la acumularea proteinelor mari de suprafață în hepatocite și la un defect de secreție a HBsAg.25 În acest studiu am efectuat corelația dintre HBsAg seric și ADN VHB între pacienții cu sau fără GGH de tip II. O corelație moderată între cei doi indicatori de replicare a VHB a fost prezentată la pacienții fără GGH de tip II (r = 0,686, P 26,27 Deleția Pre-S ar putea duce la stresul ER și la activarea transducției semnalului legat de stres. Deteriorarea oxidativă a ADN-ului hepatocitelor și apoi stimularea mecanismelor de reparare a ADN-ului ar putea duce la instabilitate genomică care agravează leziunile hepatice și predispune la carcinogeneză.28
În plus față de modelele de expresie a AgHBs, am constatat că nivelurile mai ridicate de expresie au fost însoțite de o mai mare severitate a activităților histologice hepatice și de o rată mai mare de mutații BCP T1762/A1764. Mutațiile BCP T1762/A1764 sunt puternic asociate cu activități histologice hepatice severe și cu cancerul hepatic.29,30 Din cunoștințele noastre, există o legătură puternică între genotipul C și prezența mutațiilor BCP T1762/ A1764.30 În acest studiu, genotipul C nu părea să joace niciun rol în ceea ce privește nivelul de expresie al HBsAg. În schimb, mutațiile BCP T1762/A1764 au arătat o legătură puternică cu expresia HBsAg. În ceea ce privește mutațiile virale, mutațiile BCP T1762/A1764 pot oferi baze pentru alte mutații ale VHB, inclusiv deleția pre-S și mutațiile complexe frecvent întâlnite în prezența mutațiilor BCP T1762/ A1764. Mutanții complecși ai VHB au prezentat defecte parțiale sau complete în ceea ce privește expresia și secreția proteinelor e, core și de suprafață.31 Secreția redusă a antigenului de suprafață al hepatitei B s-a corelat cu localizarea aberantă a proteinelor de suprafață în ER și a dus la o expresie ridicată a AgHBs. În plus, mutația BCP T1762/A1764 este considerată a fi o consecință a fitness-ului viral din cauza presiunii de selecție a supravegherii imune a gazdei. În mod similar, mutațiile pre-S2, adăpostite în GGH de tip II, coincid cu epitopi ai celulelor T și B restricționate de antigenul leucocitelor umane.32 De obicei, nu există necroză celulară sau infiltrare a limfocitelor T în jurul GGH de tip II, ceea ce sugerează că VHB cu apariția mutației de deleție pre-S2 este, de asemenea, un posibil nou mutant de scăpare.33 Cu toate acestea, acumularea antigenului de suprafață în hepatocite ar putea avea loc fără a purta niciuna dintre mutațiile virale cunoscute în genomurile pre-S sau S sau în promotorii de suprafață.31,34 Prin urmare, expresia HBsAg ar putea fi o secvență în asociere cu sau fără mutații virale.
Acest studiu a avut mai multe limitări potențiale. Observațiile din acest studiu s-au bazat pe un design retrospectiv transversal, dar nu s-a efectuat o urmărire longitudinală. Nivelul de expresie al AgHBs în hepatocite și severitatea histologică pot varia între diferitele părți ale ficatului la un singur pacient; biopsia hepatică în sine nu poate reprezenta cu exactitate nici un țesut hepatic, cu excepția miezului de biopsie.
În rezumat, pacienții care au prezentat un model GGH de tip II sau niveluri mai ridicate de expresie intrahepatică a AgHBs au prezentat relația reciprocă între activități histologice hepatice mai severe și o capacitate de replicare a VHB mai scăzută. Asocierea puternică dintre expresia intrahepatică a HBsAg și mutațiile BCP T1762/A1764 a indicat faptul că expresia HBsAg ar putea fi posibil să fie privită ca manifestare histologică în timpul evoluției genomice a VHB sub presiunea imunitară a gazdei.
Abbreviații
- –
BCP: promotor bazal core.
- –
GGH: hepatocit de sticlă șlefuită.
- –
HBcAg: antigen de bază al hepatitei B.
- –
HBeAg: antigen e al hepatitei B.
- –
HBsAg: antigen de suprafață al hepatitei B.
- –
HBV: virusul hepatitei B.
Conflicte de interese
T.-.T. C. a primit finanțare pentru cercetare de la Gilead Sciences, Bristol-Myers Squibb Company, Glaxo-SmithKline, Merck Sharp & Dohme (I.A.) Corporation și Pfizer Inc. Nu există niciun conflict de interese pentru ceilalți autori.