Introducere
Bacteriile gram-pozitive din genurile Bacillus și Clostridium se pot diferenția pentru a forma un endospor (spor), o celulă liniștită din punct de vedere metabolic produsă ca răspuns la condiții care nu permit creșterea celulară (McKenney et al., 2012). Odată eliberat în mediul înconjurător, sporul supraviețuiește în stare latentă pentru perioade extrem de lungi, rezistând la o gamă vastă de stres, cum ar fi temperaturile ridicate, deshidratarea, absența nutrienților și prezența substanțelor chimice toxice (McKenney et al., 2012). Cu toate acestea, sporul quiescent este capabil să monitorizeze în permanență mediul și să răspundă la prezența apei și a nutrienților prin germinarea și generarea unei celule vegetative care este capabilă să crească și să sporuleze (McKenney et al., 2012). Rezistența la condiții nefiziologice se datorează, în parte, structurilor de suprafață ale sporilor. La Bacillus subtilis, sistemul model pentru formatorii de spori, suprafața sporilor este organizată într-un strat multistratificat și într-o crustă, un strat recent descoperit care înconjoară stratul de acoperire a sporilor (McKenney et al., 2012). Sporii de B. subtilis sunt încărcați negativ (Huang et al., 2010; Pesce et al., 2014) și au o hidrofobicitate relativă care se datorează, în parte, glicozilării unor proteine de la suprafața sporilor (Cangiano et al., 2014; Rusciano et al., 2014). La mai multe specii de Bacillus și Clostridium, inclusiv B. cereus, B. anthracis, B. megaterium și C. difficile, structura sporului cea mai exterioară este exosporiul, un strat distinct din punct de vedere morfologic compus din proteine și glicoproteine care înconjoară învelișul (Díaz-González et al., 2015; Manetsberger et al, 2015b; Stewart, 2015).
Sporul bacterian a fost propus ca o platformă de afișare a proteinelor heterologe, cu aplicații potențiale care variază de la dezvoltarea de vaccinuri pentru mucoase până la biocatalizatori reutilizabili, instrumente de diagnosticare și dispozitive de bioremediere (Knecht et al., 2011; Isticato și Ricca, 2014; Ricca et al., 2014). Rezistența remarcabilă și bine documentată a sporului (McKenney et al., 2012), capacitatea de manipulare genetică a mai multor specii formatoare de spori (Harwood și Cutting, 1990) și istoricul de siguranță al mai multor specii (Cutting, 2011; Baccigalupi et al., 2015) susțin utilizarea sporului ca sistem de prezentare și de administrare. Au fost dezvoltate două strategii pentru a afișa proteine heterologe pe suprafața sporului. O strategie de recombinare, bazată pe construirea de fuziuni genetice între ADN-ul care codifică o proteină selectată pentru suprafața sporului și ADN-ul care codifică proteina care urmează să fie afișată, a fost utilizată de-a lungul anilor pentru a afișa o varietate de proteine heterologe (Isticato și Ricca, 2014). O abordare non-recombinantă, bazată pe adsorbția spontană între sporii purificați și proteinele purificate, a fost, de asemenea, utilizată pentru a afișa diverse enzime și antigene (Ricca și colab., 2014). Detaliile moleculare care controlează adsorbția sporilor nu au fost pe deplin elucidate. Se știe că adsorbția este mai eficientă atunci când pH-ul tamponului de legare este acid (pH 4) (Huang et al., 2010; Sirec et al., 2012) și că o combinație de interacțiuni electrostatice și hidrofobe sunt probabil implicate în interacțiune (Huang et al., 2010; Sirec et al., 2012). Se știe, de asemenea, că sporii mutanți cu suprafețele sporilor grav alterate interacționează mai eficient decât sporii izogeni de tip sălbatic cu proteine model (Sirec et al., 2012; Donadio et al, 2016).
Acum, am folosit o proteină fluorescentă, forma monomerică a proteinei fluorescente roșii (mRFP) a coralului Discosoma sp. (Campbell et al., 2002), pentru a evalua dacă sporii de B. megaterium sunt capabili să interacționeze cu și să adsorbe o proteină heterologă model. B. megaterium cuprinde o serie de tulpini distincte din punct de vedere morfologic care au în comun dimensiunile neobișnuit de mari atât ale celulelor (lungime de până la 4 μm și un diametru de 1,5 μm), cât și ale sporilor (lungime de până la 3 μm și diametru de 1 μm) (Di Luccia et al., 2016). Sporii unor tulpini de B. megaterium sunt înconjurați de un exosporium și, deoarece până în prezent doar sporii speciilor care nu au exosporium au fost considerați ca platforme de adsorbție, nu sunt disponibile date privind impactul exosporiumului în interacțiunea cu proteinele heterologe.
Steaua QM B1551 este cea mai bine caracterizată tulpină de B. megaterium. Această tulpină poartă aproximativ 11 % din genomul său pe șapte plasmide indigene (Rosso și Vary, 2005; Vary et al., 2007; Eppinger et al., 2011), dintre care două – pBM500 și pBM600 – au fost identificate ca fiind purtătoare de gene care sunt esențiale pentru formarea exosporiului distinctiv „în formă de nucă” al acestei tulpini (Manetsberger et al., 2015a). Compoziția proteică a exosporiumului QM B1551 este încă slab caracterizată, fiind identificate prin analize genomice doar câteva gene care codifică ortologi ai proteinelor recunoscute ale exosporiumului din sporii altor specii. Printre acestea se numără genele care codifică proteinele BclA nap, care formează un strat localizat în sporii de B. megaterium QM B1551, precum și un ortolog al proteinei BxpB care formează stratul bazal al exosporiului în sporii familiei B. cereus. Aceasta din urmă pare să îndeplinească un rol diferit în sporii de B. megaterium QM B1551, deoarece o tulpină mutantă nulă a păstrat un exosporiu aparent normal (Manetsberger et al., 2015a).
În această lucrare, prezentăm date care demonstrează că sporii de B. megaterium QM B1551 pot adsorbi eficient mRFP și furnizăm dovezi că moleculele de proteină sunt capabile să traverseze bariera de permeabilitate prezentată de exosporium pentru a se localiza în spațiul dintre straturi.
Materiale și metode
Sușetele bacteriene, sporul și producerea RFP
Sușetele de B. megaterium utilizate în acest studiu sunt QM B1551 și derivatul său fără plasmidă PV361 (Rosso și Vary, 2005). Tulpina B. subtilis utilizată în acest studiu a fost PY79 (Youngman et al., 1984). Sporularea tuturor tulpinilor de Bacillus a fost indusă prin metoda epuizării (Cutting și Vander Horn, 1990). După 30 de ore de creștere în mediul Difco Sporulation (DS) la 37°C cu agitare viguroasă, sporii au fost colectați și purificați așa cum au fost descriși de Nicholson și Setlow (1990) prin incubare peste noapte în H2O la 4°C pentru a liza celulele sporangiale reziduale. Numărul de spori purificați obținuți a fost măsurat prin numărare directă cu o cameră Bürker sub un microscop optic (Olympus BH-2 cu obiectiv de 40×).
Pentru producerea de mRFP, s-au folosit celule de Escherichia coli tulpina RH161 (Donadio et al., 2016), purtând vectorul de expresie pRSET-A care poartă o fuziune in-frame a capătului 5′ al regiunii codificatoare rfp cu șase codoni de histidină sub controlul transcripțional al unui promotor T7, au fost cultivate timp de 18 h la 37°C în 100 ml de mediu de autoinducție pentru a exprima proteina heterologă (Isticato et al., 2010). Proteina RFP cu marcaj His6 a fost purificată în condiții native cu ajutorul unei coloane His-Trap, conform recomandărilor producătorului (GE Healthcare Life Science). Proteina purificată a fost desalinizată folosind o coloană PD10 (GE Healthcare Life Science) pentru a elimina concentrațiile ridicate de NaCl și imidazol.
Reacția de adsorbție
Dacă nu se specifică altfel, 5 μg de mRFP recombinantă purificată au fost adăugate la o suspensie de spori (5 × 108) în 50 mM citrat de sodiu pH 4,0 la 25°C într-un volum final de 200 μl. După 1 h de incubație, amestecul de legare a fost centrifugat (10 min la 13.000 g) pentru a fracționa sporii legați de mRFP în pelete de mRFP liberă în supranatant.
Western and Dot-Blot Analysis
Peletele de spori din reacțiile de adsorbție au fost resuspendate în 40 μl de tampon de extracție a învelișului de spori (Nicholson and Setlow, 1990; Giglio et al, 2011), incubate la 68°C timp de 1 h pentru a solubiliza proteinele din învelișul sporilor și încărcate pe un gel SDS-PAGE 12%. Proteinele au fost apoi electrotransferate pe filtre de nitroceluloză (Amersham Pharmacia Biotech) și utilizate pentru analiza Western blot, așa cum s-a raportat anterior (Isticato et al., 2008), utilizând anticorpi monoclonali anti-His care recunosc mRFP (Sigma). O determinare cantitativă a cantității de mRFP a fost obținută prin experimente de tip dot blot comparând diluțiile în serie de mRFP purificată și de supranatant al testului de legare. Filtrele au fost apoi vizualizate prin metoda ECL-prime (Amersham Pharmacia Biotech) și au fost supuse unei analize densitometrice cu ajutorul programului Quantity One 1-D Analysis Software (Bio-Rad). Analizele dot blot și densitometrice relative au fost efectuate de trei ori pentru a verifica semnificația rezultatelor.
Microscopie de fluorescență și imunofluorescență
Sporii post-adsorbție au fost resuspendați în 50 μl de 1x PBS pH 4,0 și 5 μl din suspensie au fost plasați pe lame de microscop și acoperiți cu o lamelă de acoperire tratată în prealabil timp de 30 s cu poli-L-lizină (Sigma). Imunofluorescența a fost realizată așa cum a fost descrisă de Isticato et al. (2013), cu următoarele modificări: 2,0 × 106 spori adsorbiți de RFP din tulpinile QM B1551 și PV361 B. megaterium au fost pretratați cu 1% albumină serică bovină (BSA) – 1x PBS pH 4,0 timp de 30 min înainte de o incubare de 2 h la 4°C cu anticorpi anti-poliHistidină (șoarece; Sigma) diluat 1:20 în 1x PBS pH 4,0-1% BSA. Ca un control al specificității acestei tehnici, sporii neadsorbiți au fost tratați direct cu anticorpi anti-His. După trei spălări, probele au fost incubate cu un anticorp secundar anti-șoarece diluat de 64 de ori, conjugat cu izotiocianat de fluoresceină, FITC (Santa Cruz Biotechnology, Inc.) și au fost spălate de patru ori cu 1x PBS pH 4,0. Probele spălate au fost resuspendate în 20 μl de 1x PBS pH 4,0 și s-au analizat 10 μl. Toate probele au fost observate cu un microscop cu fluorescență Olympus BX51 echipat cu un obiectiv de ulei 100× UPlan F1; s-au utilizat filtrele cubice U-MNG sau U-MWIBBP pentru a detecta emisia de fluorescență roșie a mRFP sau, respectiv, emisia verde a anticorpilor conjugați cu FITC. Timpii de expunere au fost între 200 și 3000 ms. Imaginile au fost capturate cu ajutorul unei camere digitale Olympus DP70 și prelucrate cu Image Analysis Software (Olympus) pentru ajustări minore ale luminozității, contrastului și echilibrului culorilor (McCloy et al., 2014). ImageJ (v1.48, NIH) a fost utilizat pentru a trasa un contur în jurul a 80 de spori pentru fiecare tulpină, iar valorile minime, maxime și medii ale fluorescenței per pixel au fost înregistrate pentru fiecare spor. Valorile intensității fluorescenței au fost afișate ulterior sub formă de box-plots cu intervale de încredere de 5-95% (McCloy et al., 2014).
Analiză statistică
Rezultatele analizei dot blot și ale microscopiei de fluorescență reprezintă mediile din trei experimente independente. Semnificația statistică a fost determinată prin testul Student t, iar nivelul de semnificație a fost stabilit la P < 0,05.
Rezultatele
mRFP de Discosoma sp. este adsorbită de B. megaterium Spores
Pentru a verifica dacă sporii de B. megaterium QM B1551 sunt capabili să adsorbe mRFP, 5 μg de proteină purificată (Materiale și metode) au fost incubați cu 5,0 × 108 spori purificați. Reacția de adsorbție a fost realizată în 50 mM citrat de sodiu la pH 4,0, așa cum a fost descrisă anterior (Sirec et al., 2012). După reacție, sporii au fost spălați extensiv cu 1x PBS pH 4,0, proteinele de la suprafața sporilor au fost extrase așa cum este descris în Materiale și metode și analizate prin Western blotting cu anticorpul anti-polyHistidină-Peroxidază (Sigma), care recunoaște extremitatea N terminală marcată cu histidină a mRFP. După cum se arată în figura 1A, mRFP a fost extrasă din spori, ceea ce indică faptul că a fost absorbită în timpul reacției și apoi eliberată prin tratamentul de extracție. Pentru a evalua eficiența adsorbției, am analizat cantitatea de mRFP rămasă nelegată, adică sporii post-adsorbție au fost colectați prin centrifugare, iar supernatantul a fost diluat în serie și analizat prin dot blotting (figura 1B). O analiză densitometrică a dot blot-ului (tabelul suplimentar 1) a arătat că, atunci când s-au utilizat 5 μg de mRFP în reacția de adsorbție, mai puțin de 1 % a rămas nelegat, ceea ce indică faptul că aproximativ 99 % din proteina heterologă a fost adsorbită pe sporii de B. megaterium.

FIGURA 1. Sporii de Bacillus megaterium QM B1551 adsorb mRFP. 5 × 108 spori au fost incubați cu 5 μg de mRFP purificată și apoi probele supuse centrifugării. (A) Proteinele de suprafață ale sporilor au fost extrase din fracția de peleți prin tratament SDS-DTT, fracționate pe SDS-PAGE și analizate prin Western blot. S-a utilizat mRFP purificată (20 μg) ca marker. (B) Supernatantul, care conține mRFP nelegat, a fost diluat în serie și analizat prin dot blot (QM B1551). Diluțiile în serie de mRFP purificată (mRFP) au fost utilizate ca standard. (C) Sporii adsorbiți cu mRFP au fost spălați de două ori (W1 și W2) cu tampon PBS la pH 3,0 sau pH 7,0, sau cu o soluție de 1M NaCl, 0,1% Triton X-100. Diluții în serie de mRFP purificată și mRFP nelegată (UN-mRFP) au fost utilizate ca standarde. Imuno-reacțiile din toate panourile au fost efectuate cu anticorpi anti-His care recunosc mRFP, conjugați cu peroxidază de hrean.
Pentru a analiza dacă moleculele mRFP adsorbite au fost strâns legate de suprafața sporilor, sporii din reacția de post-adsorbție au fost spălați de două ori cu tampon PBS la pH 3,0 sau pH 7,0, sau cu o soluție de 1M NaCl, 0,1% Triton X-100, așa cum a fost descris anterior (Donadio et al., 2016). După cum se arată în figura 1C și susținută de analiza densitometrică a dot blot (tabelul suplimentar 2), spălările la pH 3,0 nu au provocat nicio eliberare a mRFP adsorbită, în timp ce spălările la pH 7,0 sau cu 1M NaCl, 0,1% Triton X-100 au provocat o eliberare minimă, mai puțin de 1%, a moleculelor mRFP. Prin urmare, rezultatele prezentate în figura 1 sugerează că mRFP a fost adsorbită eficient și strâns legată de sporii de B. megaterium. Pentru a evalua dacă moleculele mRFP adsorbite de spori și-au păstrat proprietățile de fluorescență, am efectuat o analiză prin microscopie de fluorescență. După cum se arată în figura 2, sporii de reacție post-adsorbție au fost asociați cu un semnal puternic de fluorescență vizibil în jurul întregii suprafețe a sporului.
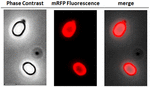
FIGURA 2. Analiza prin microscopie de fluorescență a sporilor de B. megaterium QM B1551-mRFP. Sporii QM B1551 incubați cu mRFP (5 μg) și spălați ulterior, au fost analizați prin microscopie de fluorescență. Același câmp microscopic a fost observat prin contrast de fază și microscopie fluorescentă. Bara de scară 1 μm. Se raportează panoul de fuziune. Timpul de expunere a fost de 200 ms.
Exosporiul are un rol esențial în adsorbția mRFP
Strain QM B1551 de B. megaterium conține șapte plasmide indigene (Rosso și Vary, 2005; Eppinger et al., 2011), iar genele codificate de plasmidă sunt esențiale pentru formarea exosporiului (Manetsberger et al., 2015a). PV361 este o tulpină cutată QM B1551 lipsită de toate cele șapte plasmide și, ca urmare, lipsită în totalitate de exosporium (Manetsberger et al., 2015a). Am folosit spori ai tulpinii PV361 pentru a analiza rolul exosporiumului în adsorbția mRFP. În paralel, am utilizat, de asemenea, spori de B. subtilis PY79 care, într-un studiu anterior, s-au dovedit a adsorbi mRFP (Donadio et al., 2016). Pentru a compara eficiența de adsorbție a sporilor din tulpinile B. subtilis PY79 și B. megaterium QM B1551 și PV361, am adsorbit 5 μg de mRFP purificată cu 5,0 × 108 spori din fiecare dintre cele trei tulpini. După reacțiile de adsorbție, sporii au fost colectați prin centrifugare, proteinele au fost extrase prin tratament SDS-DTT și analizate prin Western blotting cu anticorpi anti-His care recunosc mRFP. După cum se arată în figura 3A, se pare că mRFP a fost extrasă în cantități mai mari din sporii de QM B1551 decât din sporii celorlalte două tulpini. În încercarea de a cuantifica aceste diferențe aparente, mRFP nelegată din reacțiile de adsorbție a fost diluată în serie și analizată prin dot blotting (figura 3B). O analiză densitometrică a dot blot-ului din figura 3B (tabelul suplimentar 3) a indicat că sporii PY79 și PV361 au adsorbit aproximativ 90 % din mRFP totală, în timp ce sporii QM B1551 au adsorbit aproape toată (peste 99 %) mRFP purificată.
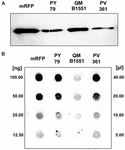
FIGURA 3. Adsorbția proteinei fluorescente roșii monomerice pe sporii de B. megaterium QM B1551 și PV361 și B. subtilis PY79. 5 × 108 spori din fiecare tulpină au fost incubați cu 5 μg de mRFP purificată și apoi probele au fost supuse centrifugării. Sporii din fracțiunile de peleți au fost utilizați pentru a extrage proteinele de suprafață care au fost ulterior analizate prin western blot (A), în timp ce supernatantele au fost diluate în serie și analizate prin dot blot (B). Diluțiile în serie de mRFP purificată au fost utilizate ca standarde. Imuno-reacțiile din ambele panouri au fost realizate cu anticorp anti-His conjugat cu peroxidază de hrean.
Eficiența de adsorbție a sporilor celor trei tulpini a fost, de asemenea, analizată prin microscopie de fluorescență (Figura 4A și Figura suplimentară S1). Imaginile de microscopie au fost analizate cu ajutorul software-ului ImageJ (v1.48, NIH) pentru a efectua analiza cantitativă a imaginilor de fluorescență, iar fluorescența sporilor a fost calculată așa cum este descris în Materiale și metode. Analiza sporilor 80 din fiecare tulpină a indicat o valoare medie a fluorescenței pe pixel de 52,43 (± 5,94), 20,81 (± 2,71) și 32,33 (± 2.97; unități arbitrare) pentru QM B1551, PV361 și, respectiv, PY79 (figura 4B), conferind o dovadă suplimentară că sporii QM B1551 au adsorbit mai multă mRFP decât sporii celorlalte două tulpini.
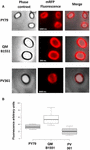
FIGURA 4. Eficiența de adsorbție a mRFP pe sporii de B. megaterium QM B1551 și PV361 și B. subtilis PY79. (A) Imagini de microscopie cu fluorescență ale sporilor PY79, QM B1551 și PV361 după adsorbția mRFP și spălare. Timpii de expunere sunt indicați. Sunt prezentate suprapuneri de contrast de fază și de fluorescență roșie (panoul de fuziune). Barele de scară 1 μm. (B) Diagrame de cutie care prezintă intensitatea fluorescenței a optzeci de spori diferiți din fiecare tulpină. Limitele fiecărei cutii reprezintă prima și a treia cuartilă (25 și 75 %), iar valorile din afara cutiilor reprezintă valorile maxime și minime. Linia care delimitează caseta indică valoarea mediană pentru fiecare tulpină. Valoarea P este mai mică de 0,0001.
Pe baza rezultatelor din figurile 3 și 4, concluzionăm că exosporiul, prezent în QM B1551 și lipsit în PV361, are un rol relevant în adsorbția mRFP.
În plus, rezultatele din figura 4 au indicat că sporii de B. subtilis PY79 sunt mai eficienți decât sporii de B. megaterium PV361 în adsorbția mRFP, în timp ce dot blotting-ul raportat în figura 3B a indicat eficiențe de adsorbție similare pentru cele două tulpini. Credem că această discrepanță se datorează unei reduceri puternice a fluorescenței atunci când mRFP este legată la PV361, dar nu și la sporii PY79 sau QM B1551 (a se vedea mai jos).
Evaluarea cantitativă a adsorbției mRFP pe sporii QM B1551
Experimentele de tip „dot blot” (figura 3B) au indicat că atunci când 5 μg de mRFP purificată au fost folosite în reacții de adsorbție cu 5,0 × 108 spori ai tulpinii QM B1551, aproape toată proteina heterologă a fost legată de spor. Pentru a defini cantitatea maximă de mRFP care poate fi adsorbită de sporii QM B1551, am repetat reacțiile cu concentrații din ce în ce mai mari de mRFP purificată, și anume, 5,0 × 108 spori QM B1551 au reacționat cu 5, 10, 20, 40, 80 și 160 μg de mRFP purificată. După reacții, sporii au fost colectați prin centrifugare, iar supernatantele care conțineau mRFP nelegată au fost diluate în serie și analizate prin dot blotting (figura 5A). Figura 5B prezintă rezultatele unei analize densitometrice a dot blot-ului (???), care indică faptul că, atunci când 5-80 μg de mRFP au reacționat cu 5 × 108 spori, procentul de proteină legată de spori a fost de peste 90 %. S-a observat o scădere a mRFP legate atunci când s-au utilizat 160 μg de proteină purificată în reacție. Cu toate acestea, chiar și atunci când s-au folosit 160 μg de mRFP purificată, peste 60% din proteină a fost absorbită, ceea ce indică faptul că 5,0 × 108 spori de QM B1551 pot adsorbi aproximativ 100 μg de mRFP.
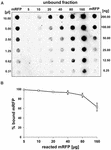
FIGURA 5. Evaluarea cantitativă a adsorbției mRFP pe sporii de B. megaterium QM B1551. 5 × 108 spori au fost incubați cu 5, 10, 20, 40, 80 și 160 μg de mRFP purificată. Amestecurile de reacție au fost supuse ulterior centrifugării, iar supernatanții au fost diluați în serie și analizați prin dot blot (A). Diluțiile în serie de mRFP purificată au fost utilizate ca standarde. Imuno-reacțiile din ambele panouri au fost realizate cu anticorp anti-His conjugat cu peroxidază de hrean. (B) Procentul de mRFP adsorbit pe spori după reacția cu cantități definite de mRFP endogenă. Barele de eroare arată erorile standard ale mediei din trei experimente, iar valoarea P nu este niciodată mai mare de 0,0025.
mRFP se localizează în spațiul dintre straturi în sporii de B. megaterium QM B1551
O abordare prin microscopie de imunofluorescență a fost utilizată pentru a evalua dacă moleculele mRFP adsorbite au fost expuse pe suprafața sporilor de B. megaterium QM B1551. Sporii QM B1551 adsorbiți cu diferite cantități de mRFP au reacționat cu un anticorp monoclonal anti-His care recunoaște mRFP recombinant, apoi cu un anticorp secundar fluorescent anti-șoarece (Santa Cruz Biotechnology, Inc.) și au fost observați la microscopul cu fluorescență (figura 6). Cu cea mai mică cantitate de mRFP utilizată în acest experiment (2 μg), semnalul de fluorescență mRFP (roșu) a fost observat în jurul sporului, în timp ce semnalul de imunofluorescență (verde) a fost slab și concentrat în principal la polii sporului, sugerând că doar în acele puncte mRFP a fost expus pe suprafața sporului. Odată cu creșterea cantității de mRFP utilizate în reacție, numărul de puncte verzi a crescut (5 și 10 μg), iar cu cea mai mare cantitate de mRFP utilizată în reacție (20 μg) s-a observat un inel verde aproape complet în jurul sporilor. Pe baza rezultatelor prezentate în figura 6, am emis ipoteza că moleculele de mRFP se infiltrează prin exosporium și se localizează în spațiul dintre straturile exterioare și exosporium, adică, atunci când se utilizează o cantitate mică de mRFP, aproape toate moleculele de proteină sunt în interiorul exosporiumului și sunt disponibile pentru anticorp doar în câteva locuri. Creșterea cantității de mRFP în reacțiile de adsorbție duce la „umplerea” spațiului dintre straturi, până când, în cele din urmă, mai multe molecule de mRFP sunt disponibile pentru anticorpul de pe suprafața sporului. Această ipoteză implică faptul că, dacă exosporiul lipsește, atunci toată mRFP ar trebui să fie disponibilă pentru anticorp. Pentru a testa acest lucru, am comparat prin microscopie cu imunofluorescență un număr egal de spori de QM B1551 (cu exosporium) și de PV361 (fără exosporium) incubați cu aceeași cantitate de mRFP (5 μg). În cazul în care exosporiul era prezent (QM B1551), mRFP a fost doar parțial disponibil pentru anticorp și s-au observat pete verzi (figura 7 și figura suplimentară S2). Atunci când exosporiul nu a fost prezent (PV361) mRFP adsorbită a fost disponibilă pentru anticorp în jurul sporului și s-a format un inel verde complet, susținând ipoteza că mRFP este internă la exosporiu în sporii QM B1551.
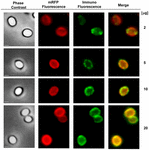
FIGURA 6. Analiza prin imunofluorescență a sporilor de B. megaterium QM B1551 adsorbiți cu mRFP. Cantități alicotate de 5 × 108 spori QM B1551 au fost incubate cu concentrații variabile de mRFP și au fost ulterior analizate prin contrast de fază, microscopie de fluorescență și imunofluorescență, așa cum este descris în Materiale și metode. Același câmp microscopic pentru fiecare reacție este raportat împreună cu panoul de fuziune. Timpul de expunere a fost de 200 ms pentru toate imaginile. Bara de scară, 1 μm.
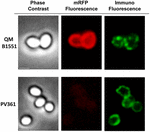
FIGURA 7. Imunofluorescența mRFP adsorbită pe sporii B. megaterium QM B1551 și PV361. 5 × 108 spori QM B1551 și PV361 au fost incubați cu 5 μg mRFP și apoi analizați prin microscopie de imunofluorescență, așa cum este descris în Materiale și metode. Pentru fiecare câmp sunt prezentate contrastul de fază și microscopia de imunofluorescență. Timpul de expunere a fost de 200 ms pentru toate imaginile. Bară de scară, 1 μm.
În timp ce sporii QM B1551 utilizați în experimentele din figura 7 au prezentat un inel fluorescent roșu complet ca în figura 2, sporii PV361 au prezentat un semnal fluorescent roșu foarte slab. În cazul sporilor PV361, un semnal roșu a fost observat doar folosind timpi lungi de expunere la microscopul cu fluorescență (figura 4). Deoarece mRFP este prezentă în jurul sporilor PV361 (figurile 3 și 7), concluzionăm că fluorescența mRFP este slăbită atunci când proteina este adsorbită pe sporii PV361. Experimente suplimentare vor fi necesare pentru a aborda pe deplin acest punct.
Discuție
Principalele constatări ale acestui raport sunt că sporii de B. megaterium sunt extrem de eficienți în adsorbția proteinei model heterologe mRFP, că exosporiul are un rol important în acest proces și că moleculele mRFP se infiltrează prin exosporiu localizându-se între învelișul exterior și exosporiu. Aceste rezultate extind lucrările anterioare efectuate pe sporii de B. subtilis și demonstrează că sporii unei specii diferite pot fi, de asemenea, utilizați pentru a livra proteine heterologe prin metoda adsorbției. Eficiența ridicată a adsorbției observată în cazul sporilor de B. megaterium se datorează, în parte, dimensiunii mari a sporului său în comparație cu cea a sporului de B. subtilis. Într-adevăr, suprafața sporului de B. megaterium este de aproximativ 2,5 ori mai mare decât cea a sporului de B. subtilis, cu o suprafață de 5,33 μm2 (h: 1,60 ± 0,16 l: 0,84 ± 0,07) față de 1,98 μm2 (h: 1,07 ± 0,09 l: 0,48 ± 0,03). Dimensiunile mari permit adsorbția a până la 100 μg de mRFP atunci când 160 μg de proteină reacționează cu sporii.
Observația că mRFP traversează exosporiul indică faptul că acesta este permeabil la mRFP, o proteină de 27 kDa. Permeabilitatea exosporiului nu este total surprinzătoare, deoarece germenii prezenți în mediu trebuie să traverseze straturile externe ale sporului pentru a ajunge la receptorii lor, deși germenii sunt de obicei molecule mici cu mase moleculare de obicei <200 Da. În plus, datele mRFP sunt, în linii mari, în concordanță cu rezultatele studiilor anterioare efectuate cu dextrani marcați și molecule înrudite (Koshikawa și colab., 1984; Nishihara și colab., 1989). În aceste studii, s-a sugerat că exosporiul B. megaterium QM B1551 reprezintă o barieră de permeabilitate pentru moleculele cu greutăți moleculare mai mari de 100 KDa, influențând în același timp trecerea moleculelor cu mase undeva între 2 și 40 kDa (Koshikawa et al, 1984; Nishihara et al., 1989).
O provocare interesantă pentru lucrările viitoare va fi stabilirea mecanismului sau a căii de infiltrare pe care mRFP și, prin inferență, alte proteine heterologe de interes, o parcurge pentru a pătrunde în spațiul dintre straturi. Examinarea prin microscopie electronică cu transmisie a sporilor secționați de B. megaterium QM B1551 indică faptul că exosporiul cuprinde două „cochilii” identice (Manetsberger et al., 2015a), și s-ar putea ca interfața dintre fiecare dintre aceste structuri (descrise ca „deschideri apicale” în primele lucrări) să permită pătrunderea unor molecule relativ mari. Discernirea bazei pentru pierderea aparentă a fluorescenței mRFP la adsorbția pe sporii PV361 și dacă moleculele mRFP sunt capabile să se infiltreze în straturile exterioare ale învelișului, așa cum s-a observat în cazul sporilor de B. subtilis (Donadio et al., 2016), va fi, de asemenea, de interes.
În studiul actual, presupunem că moleculele mRFP traversează în mod preferențial exosporiul și se acumulează în spațiul dintre straturile exterioare și exosporiu. În acest model, moleculele mRFP sunt adsorbite și afișate pe suprafața sporului numai după ce situsurile de adsorbție (sau capacitatea volumetrică?) din spațiul dintre straturi sunt suficient de ocupate. Acest lucru implică faptul că abordarea prin adsorbție a afișării la suprafață poate fi utilizată cu sporii de B. megaterium QM B1551, deși sistemul depinde de raportul dintre spor și proteină utilizat în reacțiile de adsorbție. Având în vedere că diverse tulpini de B. megaterium sunt utilizate de mult timp la nivel industrial pentru producerea de enzime, cum ar fi amilaze și dehidrogenaze, vitamine și molecule antimicrobiene (Vary et al., 2007), datele noastre sugerează o nouă aplicație biotehnologică pentru sporul de B. megaterium ca vehicul pentru legarea și livrarea de proteine heterologe.
Contribuții ale autorilor
ML și GD – au realizat majoritatea experimentelor; RA și AS – au contribuit la interpretarea datelor pentru lucrare; GiC, LB și GrC – au contribuit la redactarea lucrării și la revizuirea critică a acesteia; ER – a contribuit la discuții și sugestii în timpul lucrării și a contribuit la scrierea manuscrisului; RI – a condus lucrarea și a contribuit la scrierea manuscrisului. Toți autorii au citit și au aprobat manuscrisul final.
Finanțare
Acestă lucrare a fost susținută de un grant (STAR Linea1- 2014) de la Universitatea Federico II din Napoli și Compagnia di San Paolo, Italia, acordat lui RI.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Materiale suplimentare
Materialul suplimentar pentru acest articol poate fi găsit online la adresa: https://www.frontiersin.org/article/10.3389/fmicb.2016.01752/full#supplementary-material
FIGURA S1 | Imagini de câmp întreg ale analizei microscopiei de fluorescență raportate în Figura 4. Același câmp microscopic a fost observat prin contrast de fază și microscopie de fluorescență. Bară de scară 5 μm. Se raportează panoul de fuziune. Timpul de expunere este indicat.
FIGURA S2 | Imagini de câmp întreg ale analizei prin imunofluorescență raportate în Figura 7. Același câmp microscopic a fost observat prin contrast de fază și microscopie de fluorescență. Bară de scară 5 μm. Timpul de expunere a fost de 200 ms pentru toate imaginile.
TABELUL S1 | Analiza densitometrică a experimentelor dot blot cu supernatantele reacției de adsorbție cu sporii QM B1551 (Figura 1B).
TABLĂ S2 | Analiza densitometrică a experimentelor dot blot cu supranatantele diferitelor spălări după reacția de adsorbție (figura 1C).
TABLĂ S3 | Analiza densitometrică a experimentelor dot blot cu supranatantele reacției de adsorbție efectuate cu sporii tulpinilor PY79, QM B1551 și PV361 (figura 3B).
TABLĂ S4 | Analiza densitometrică a experimentelor de dot blot cu supranaturile reacției de adsorbție efectuate cu diferite cantități de mRFP.
Baccigalupi, L., Ricca, E., și Ghelardi, E. (2015). „Probiotice non-LAB: formatori de spori”, în Probiotice și prebiotice: Current Research and Future Trends, eds K. Venema și A. P. do Carmo (Norfolk, VA: Caister Academic Press), 93-103. doi: 10.21775/9781910190098.06
CrossRef Full Text | Google Scholar
Campbell, R. E., Tour, O., Palmer, A. E., Steinbach, P. A. A., Baird, G. S., Zacharias, D. A., et al. (2002). O proteină fluorescentă roșie monomerică. Proc. Natl. acad. Sci. U.S.A. 99, 7877-7882. doi: 10.1073/pnas.082243699
PubMed Abstract | CrossRef Full Text | Google Scholar
Cangiano, G., Sirec, T., Panarella, C., Isticato, R., Baccigalupi, L., De Felice, M., et al. (2014). Produsele genei sps afectează germinația, hidrofobicitatea și adsorbția de proteine a sporilor de Bacillus subtilis. Appl. Environ. Microbiol. 80, 7293-7302. doi: 10.1128/AEM.02893-14
PubMed Abstract | Full CrossRef Text | Google Scholar
Cutting, S. M. (2011). Bacillus probiotice. Food Microbiol. 28, 214-220. doi: 10.1016/j.fm.2010.03.007
PubMed Abstract | Full CrossRef Full Text | Google Scholar
Cutting, S., and Vander Horn, P. B. (1990). „Analiza genetică,” în Molecular Biological Methods for Bacillus, eds C. Harwood și S. Cutting (Chichester: John Wiley and Sons), 27-74.
Google Scholar
Díaz-González, F., Milano, M., Olguin-Araneda, V., Pizarro-Cerda, J., Castro-Córdova, P., Tzeng, S. C., et al. (2015). Compoziția proteică a stratului exterior asemănător cu exosporiul al sporilor de Clostridium difficile 630. J. Proteom. 123, 1-13. doi: 10.1016/j.jprot.2015.03.035
PubMed Abstract | Refef Full Text | Google Scholar
Di Luccia, B., D’Apuzzo, E., Varriale, F., Baccigalupi, L., Ricca, E., și Pollice, A. (2016). Bacillus megaterium SF185 induce căi de stres și afectează distribuția ciclului celular al celulelor epiteliale intestinale umane. Benef. Microb. 7, 609-620. doi: 10.3920/BM2016.0020
PubMed Abstract | Full Text | Google Scholar
Donadio, G., Lanzilli, M., Sirec, T., Ricca, E., și Isticato, R. (2016) Adsorbția și localizarea proteinelor pe sporii de tip sălbatic și mutant ai Bacillus subtilis. Microb. Cell Fact. 15:153. doi: 10.1186/s12934-016-0551-2
PubMed Abstract | Full CrossRef Text
Eppinger, M., Bunk, B., Johns, M. A., Edirisinghe, J. N., Kutumbaka, K. K. K., Koenig, S. S., et al. (2011). Secvențe genomice ale tulpinilor de Bacillus megaterium QM B1551 și DSM319, importante din punct de vedere biotehnologic. J. Bacteriol. 193, 4199-4213. doi: 10.1128/JB.00449-11
PubMed Abstract | Text integral | Google Scholar
Giglio, R., Fani, R., Isticato, R., Isticato, R., De Felice, M., Ricca, E., și Baccigalupi, L. (2011). Organizarea și evoluția genelor cotG și cotH din Bacillus subtilis. J. Bacteriol. 193, 6664-6673. doi: 10.1128/jb.06121-11
PubMed Abstract | CrossRef Full Text | Google Scholar
Harwood, C. R., and Cutting, S. M. (1990). Metode biologice moleculare pentru Bacillus. Chichester: John Wiley and Sons.
Google Scholar
Huang, J. M., Hong, H. A., Van Tong, H., Hoang, T. H., Brisson, A., și Cutting, S. M. (2010). Livrarea de antigene pe mucoasă folosind adsorbția pe sporii bacterieni. Vaccine 28, 1021-1030. doi: 10.1016/j.vaccine.2009.10.127
PubMed Abstract | Reflect Full Text | Google Scholar
Isticato, R., Pelosi, A., De Felice, M., și Ricca, E. (2010). CotE se leagă de CotC și CotU și mediază interacțiunea lor în timpul formării învelișului sporului în Bacillus subtilis. J. Bacteriol. 192, 949-954. doi: 10.1128/JB.01408-09
PubMed Abstract | Text integral | Google Scholar
Isticato, R., Pelosi, A., Zilhão, R., Baccigalupi, L., Henriques, A. O., De Felice, M., et al. (2008). Heterodimerizarea CotC-CotU în timpul asamblării învelișului sporului de Bacillus subtilis. J. Bacteriol. 190, 1267-1275. doi: 10.1128/JB.01425-07
PubMed Abstract | Text integral | Google Scholar
Isticato, R., și Ricca, E. (2014). Afișarea suprafeței sporilor. Microbiol. Spectr. 2, 351-366. doi: 10.1128/microbiolspec.TBS-0011-2012
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., Sirec, T., Treppiccione, L., Maurano, F., De Felice, M., Rossi, M., et al. (2013). Afișarea nerecombinantă a subunității B a toxinei termolabile de Escherichia coli pe sporii de tip sălbatic și mutant de Bacillus subtilis. Microb. Cell Fact. 12:98. doi: 10.1186/1475-2859-12-98
PubMed Abstract | Refef Full Text | Google Scholar
Knecht, L. D., Pasini, P., și Daunert, S. (2011). Bacterial spores as platforms for bioanalytical and biomedical applications (Sporii bacterieni ca platforme pentru aplicații bioanalitice și biomedicale). Anal. Bioanal. Chem. 400, 977-989. doi: 10.1007/s00216-011-4835-4
PubMed Abstract | Full CrossRef Full Text | Google Scholar
Koshikawa, T., Beaman, T. C., Pankratz, H. S., Nakashio, S., Corner, T. R. și Gerhardt, P. (1984). Rezistența, germinația și corelațiile de permeabilitate ale sporilor de Bacillus megaterium deposedați succesiv de straturile de tegument. J. Bacteriol. 159, 624-632.
PubMed Abstract | Google Scholar
Manetsberger, J., Hall, E. A. H., și Christie, G. (2015a). Genele codificate de plasmidă influențează asamblarea și morfologia exosporiumului în sporii Bacillus megaterium QM B1551. FEMS Microbiol. Lett. 362:fnv147. doi: 10.1093/femsle/fnv147
PubMed Abstract | Reflect Full Text | Google Scholar
Manetsberger, J., Manton, J. D., Erdelyi, M. J., Lin, H., Rees, D., Christie, G., et al. (2015b). Microscopia de localizare elipsoidală infirmă dimensiunea și ordinea straturilor de proteine în învelișurile sporilor de Bacillus. Biophys. J. 109, 2058-2066. doi: 10.1016/j.bpj.2015.09.023
PubMed Abstract | CrossRef Full Text | Google Scholar
McCloy, R., Rogers, S., Caldon, E., Lorca, T., Castro, A., și Burgess, A. (2014). Inhibarea parțială a Cdk1 în faza G2 anulează SAC și decuplează evenimentele mitotice. Cell Cycle 13, 1400-1412. doi: 10.4161/cc.28401
PubMed Abstract | Text integral | Google Scholar
McKenney, P. T., Driks, A., și Eichemberger, P. (2012). The Bacillus subtilis endospore: assembly and functions of the multilayered coat. Nat. Rev. Microbiol. 11, 33-44. doi: 10.1038/nrmicro2921
PubMed Abstract | Textul integral | Google Scholar
Nicholson, W. L., și Setlow, P. (1990). „Sporulation, germination and out-growth,” în Molecular biological methods for Bacillus, eds C. Harwood and S. Cutting (Chichester: John Wiley and Sons), 391-450.
Google Scholar
Nishihara, T., Takubo, Y., Kawamata, E., Koshikawa, T., Ogaki, J., și Kondo, M. (1989). Rolul învelișului exterior în rezistența sporului de Bacillus megaterium. J. Biochem. 106, 270-273.
PubMed Abstract | Google Scholar
Pesce, G., Rusciano, G., Sirec, T., Isticato, R., Sasso, A., și Ricca, E. (2014). Măsurători ale încărcăturii de suprafață și ale coeficientului hidrodinamic ale sporului Bacillus subtilis prin pensete optice. Colloids Surf. B Biointerfaces 116C, 568-575. doi: 10.1016/j.colsurfb.2014.01.039
PubMed Abstract | Cross Full Text | Google Scholar
Ricca, E., Baccigalupi, L., Cangiano, G., De Felice, M., și Isticato, R. (2014). Livrarea vaccinului mucosal prin sporii nerecombinanți de Bacillus subtilis. Microb. Cell Fact. 13, 115. doi: 10.1186/s12934-014-0115-2
PubMed Abstract | Full Cross Full Text | Google Scholar
Rosso, M. L., and Vary, P. S. (2005). Distribuția plasmidelor Bacillus megaterium QM B1551 printre alte tulpini de B. megaterium și specii de Bacillus. Plasmid 53, 205-217. doi: 10.1016/j.plasmid.2004.10.005
PubMed Abstract | Cross Full Text | Google Scholar
Rusciano, G. Zito, G., Isticato, R., Sirec, T., Ricca, E., Bailo, E., și Sasso, A. (2014). Imagistica chimică la scară nanometrică a sporilor Bacillus subtilis prin combinarea împrăștierii Raman îmbunătățite de vârf și a instrumentelor statistice avansate. ACS Nano 8, 12300-12309. doi: 10.1021/nn50459595k
PubMed Abstract | Refef Full Text | Google Scholar
Sirec, T., Strazzulli, A., Isticato, R., De Felice, M., Moracci, M., și Ricca, E. (2012). Adsorbția beta-galactosidazei de Alicyclobacillus acidocaldarius pe sporii de tip sălbatic și mutanți de Bacillus subtilis. Microb. Cell Fact. 11:100. doi: 10.1186/1475-2859-11-100
PubMed Abstract | Full CrossRef Text | Google Scholar
Stewart, G. C. (2015). Stratul Exosporium al sporilor bacterieni: o legătură cu mediul și cu gazda infectată. Microbiol. Mol. Biol. Rev. 79, 437-457. doi: 10.1128/MMBR.00050-15
PubMed Abstract | Full CrossRef Text | Google Scholar
Vary, P. S., Biedendieck, R., Fuerch, T., Meinhardt, F., Rohde, M., Deckwer, W. -D., et al. (2007). Bacillus megaterium – de la o simplă bacterie de sol la o gazdă pentru producția industrială de proteine. Appl. microbiol. Biotechnol. 76, 957-967 doi: 10.1007/s00253-007-1089-3
PubMed Abstract | Full Text | Google Scholar
Youngman, P., Perkins, J. B., and Losick, R. (1984). O metodă nouă pentru clonarea rapidă în Escherichia coli a ADN-ului cromozomal Bacillus subtilis adiacent inserției Tn917. Mol. Gen. Genet. 195, 424-433. doi: 10.1007/BF00341443
CrossRef Full Text | Google Scholar
.