Introducere
Meningioamele sunt cele mai frecvente neoplasme primare ale sistemului nervos central (SNC) și reprezintă peste 37% din toate tumorile cerebrale primare (1). Opțiunile de management pentru meningioame includ observația, chirurgia și radioterapia (2, 3). În timp ce o minoritate de meningioame sunt agresive, inclusiv gradele II și III ale Organizației Mondiale a Sănătății (OMS), peste 80% sunt de gradul I al OMS și sunt adesea numite „benigne” (4). Cu toate acestea, chiar și meningioamele de gradul I al OMS pot recidiva, studiile anterioare evidențiind o rată de recidivă de până la 47% în cazul urmăririi pe termen lung (4, 5). Recidiva meningiomului necesită frecvent un tratament cu intervenții chirurgicale suplimentare sau radioterapie de salvare, ceea ce duce la o potențială morbiditate (6, 7). Ca urmare, capacitatea de a prezice recurența este o componentă crucială a managementului meningiomului de gradul I OMS pentru a face recomandări cu privire la frecvența imagisticii de supraveghere sau la utilizarea radioterapiei adjuvante.
În plus față de gradul Simpson obținut la rezecție, au fost evaluate o serie de caracteristici tumorale ca posibili predictori ai recurenței, cu accent pe constatările histopatologice (8). Printre acestea se numără indicele MIB-1 (un marker al proliferării celulare), invazia cerebrală și prezența caracteristicilor histologice atipice, inclusiv celularitate crescută, foițe, focare de necroză spontană și atipii nucleare (9-13). Într-adevăr, clasificările OMS din 2016 utilizează exclusiv constatările patologice pentru a determina gradul tumoral, gradul II fiind definit prin invazie cerebrală și mitoză crescută peste 4/10 câmpuri de mare putere (HPF) (4). În plus, trei caracteristici atipice determină împreună un grad tumoral crescut (4). Privind în perspectivă, caracteristicile moleculare ale meningiomului au fost asociate recent cu riscul de recidivă și vor fi probabil utilizate în clasificarea meningiomului în viitor (14-16).
În timp ce clasificările OMS sintetizează literatura disponibilă pentru a crea delimitatori clari între gradele tumorale, literatura de specialitate în jurul gradului I OMS de recidivă a meningiomului rămâne mixtă. De exemplu, în timp ce invazia cerebrală singură poate duce la o creștere a gradului tumoral de la gradul I-II al OMS, o serie de studii ulterioare nu au găsit o relație între invazia cerebrală și recidivă, subliniind necesitatea unor cercetări suplimentare privind predictorii de recidivă (10, 17, 18). Utilitatea indicelui MIB-1 în prezicerea recurenței meningiomului este, de asemenea, controversată; un studiu la meningioamele de gradul I al OMS a sugerat un risc mai mare de recurență doar cu un indice MIB-1 de >3%, dar alte lucrări de specialitate care includ toate gradele OMS au demonstrat o incidență mai mare a recurenței la >5% sau >10% (9-11). Studii anterioare au propus, de asemenea, un cutoff MIB-1 de >3% doar la pacienții cu o rezecție Simpson II sau III, demonstrând și mai mult varietatea cutoff-urilor MIB-1 și utilizarea acestora (13). În comparație, un număr limitat de studii au investigat impactul caracteristicilor atipice în recidiva meningiomului de gradul I OMS; deși, acestea au sugerat un risc mai mare de recidivă în cazul tumorilor de gradul I OMS care prezintă caracteristici atipice la analiza patologică (9).
Prin urmare, scopul acestui studiu a fost de a investiga predictorii clinici, radiografici și patologici ai recidivei în meningioamele de gradul I OMS. Având în vedere lipsa de consens în ceea ce privește utilizarea MIB-1 în meningioamele de gradul I OMS, utilizăm, de asemenea, analiza de partiționare recursivă pentru a identifica un cutoff relevant din punct de vedere clinic pentru indicele MIB-1. Apoi, identificăm predictorii recurenței timpurii și post-mediane în tumorile de gradul I OMS.
Metode
Populația pacienților
Pacienții care au fost supuși unui tratament pentru un meningiom de gradul I OMS în perioada 2007-2017 au fost identificați retrospectiv folosind o bază de date instituțională. Acest studiu a fost aprobat în mod oficial de către University of California, San Francisco Institutional Review Board (IRB#13-12587). Au fost excluși pacienții fără valori ale indicelui MIB-1 disponibile în fișa medicală electronică. La începutul perioadei de studiu, MIB-1 a fost obținut la discreția neuropatologului curant, dar, pe măsură ce timpul a progresat, MIB-1 a fost obținut la toți pacienții cu meningiom de gradul I OMS.
Date clinice
Datele demografice, clinice și caracteristicile tratamentului pacienților, datele histopatologice și rezultatele clinice au fost revizuite și colectate retrospectiv. Datele clinice colectate au inclus vârsta pacientului, sexul, statusul de performanță Karnofsky (Karnofsky Performance Status (KPS) la tratament, prezentarea clinică și istoricul anterior de tratament al meningiomului. Datele histopatologice au inclus indicele MIB-1, foiță/pierdere de arhitectură, celularitate crescută, necroză, atipie nucleară și prezența invaziei osoase. Rezultatele colorației receptorului de progesteron (PR), a antigenului membranei epiteliale (EMA), a CD34, S100, a proteinei gliale fibrilare și acide (GFAP) au fost colectate atunci când au fost disponibile. Datele patologice au fost extrase din raportul patologic generat în momentul intervenției chirurgicale. Localizarea tumorii, dimensiunea și prezența edemului peritumoral preoperator au fost determinate cu ajutorul imagisticii RMN preoperatorii. Au fost colectate diametrele anterior-posterior (AP), superior-inferior (SI) și transversal (TV). Volumul tumoral preoperator a fost calculat cu ajutorul ecuației pentru volumul tumoral nesferic. Tipul de tratament a fost colectat în mod similar. Gradul Simpson a fost determinat prin intermediul raportului operator. Rezecția totală brută (GTR) și rezecția subtotală (STR) au fost determinate cu ajutorul scanărilor postoperatorii de imagistică prin rezonanță magnetică (IRM).
Rezultatele primare de interes au fost recidiva tumorală și timpul până la recidivă. Recurența a fost determinată pe radiografia postoperatorie ca fiind o recidivă locală sau o progresie a tumorii reziduale. Timpul până la recidivă a fost determinat de la data tratamentului pacientului. Durata de urmărire a fost calculată de la data tratamentului până la ultima vizită la clinica de neurochirurgie. Rezultatele secundare au inclus recidiva timpurie și post-mediană. Recidiva precoce a fost definită ca fiind în termen de 2 ani de la tratamentul inițial (19). Recurența post-mediană a fost definită ca apărând la >2 ani după tratamentul inițial.
Analiză statistică
Chi-pătrat și testul t al lui Student au fost utilizate pentru compararea variabilelor categorice și, respectiv, continue. A fost construit un model de regresie Cox cu probabilitate inversă multivariată pentru recurență, utilizând variabile cu p < 0,200 la analiza univariată. În mod similar, au fost construite modele logistice binare cu verosimilitate retrospectivă multivariată pentru a prezice recurența timpurie și post-mediană folosind variabile cu p < 0,200 la analiza univariată. Analiza de partiționare recursivă (RPA) a fost utilizată pentru a identifica în continuare factorii de risc cheie ai recurenței meningiomului global, timpuriu și post-mediu. Un p < 0,050 a fost utilizat ca prag de semnificație statistică. Toate analizele statistice au fost efectuate cu SPSS 26.
Rezultate
Demografia generală a pacienților și rezultatele clinice
Demografia generală a pacienților, caracteristicile histopatologice și rezultatele clinice pot fi văzute în Tabelul 1. În total, 239 de pacienți cu meningioame de gradul I OMS au fost incluși în studiu. Vârsta medie a fost de 60,0 ani, iar 69,5% dintre pacienți au fost de sex feminin. Cel mai frecvent simptom de prezentare a fost cefaleea (30,5%), urmată de un deficit neurologic focal (27,6%). Majoritatea pacienților au fost supuși doar unei intervenții chirurgicale (98,3%), cu 2 pacienți care au primit fiecare tratamente adjuvante de radioterapie (0,8%) sau gamma knife (0,8%). Edemul peritumoral a fost prezent la RMN-urile preoperatorii la 38,1% dintre pacienți. Volumul mediu calculat al tumorii a fost de 30,6 cm3 (interval = 0,23-215,73 cm3), iar cea mai mare dimensiune medie a tumorii a fost de 3,8 cm (interval = 0,6-11,3 cm). În general, 91 (38,1%) de tumori au fost localizate pe baza craniului, 57 (23,8%) au fost tumori de convexitate, 43 (18,0%) au avut o localizare falx/parasagitală, iar 55 (23,0%) au avut o altă localizare. Majoritatea pacienților au beneficiat de o rezecție totală grosieră (63,6%). Incidența rezecției Simpson I, II, III și IV a fost de 31,4, 29,7, 2,5 și, respectiv, 35,6%. Caracteristicile atipice au fost prezente la un anumit număr de pacienți; cele mai frecvente caracteristici atipice au fost invazia osoasă (18,0%) și foița/pierderea arhitecturii (8,4%). Durata medie de urmărire a fost de 41,1 luni (interval: 0-147 luni).
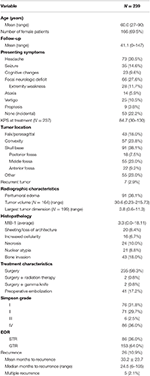
Tabel 1. Caracteristicile pacienților, trăsăturile histopatologice, radiografia și rezultatele.
Predictori de recidivă a meningiomului de gradul I OMS
Un total de 26 de pacienți au recidivat cu un timp median până la recidivă de 24,5 luni (Tabelul 1). O comparație între pacienții cu recidivă și cei fără recidivă poate fi găsită în tabelul 2. Nu a existat nicio diferență în ceea ce privește vârsta (60,2 vs. 58,8, p = 0,582) sau sexul feminin (61,5 vs. 70,4%, p = 0,353) între pacienții cu tumori care au recidivat și pacienții fără recidivă. Caracteristicile de tratament au fost similare între grupuri, majoritatea pacienților din fiecare grup primind doar intervenție chirurgicală (100,0 vs. 98,1%, p = 1,000). Cu toate acestea, pacienții cu tumori recurente au avut o incidență mai mare a STR (61,5 vs. 32,7%, p = 0,004) și o incidență mai mică a rezecției de gradul I Simpson (11,5 vs. 34,1%, p = 0,019). Incidența edemului peritumoral, dimensiunea și volumul tumorii au fost similare între grupuri. În urma analizei histopatologice, pacienții cu recidivă au avut o tendință de creștere a atipicității nucleare (19,2 vs. 7,5%, p = 0,061). Pacienții cu recidivă au avut, de asemenea, o durată medie de urmărire mai mare (68,9 vs. 37,7 luni, p = 0,001).
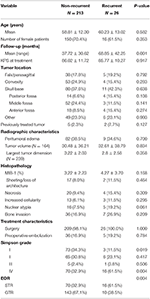
Tabel 2. Comparația pacienților cu meningioame recurente vs. meningioame nerecurente.
O analiză ulterioară de cox-regresie cu verosimilitate inversă a evidențiat o relație independentă între recurență și localizarea tumorii în fosa posterioară (HR = 5.25, CI 1,71-16,17, p = 0,004), indicele MIB-1 (HR = 1,18, CI 1,05-1,34, p = 0,008), atipia nucleară (HR = 5,24, CI 1,73-15,92, p = 0,003) și STR (HR = 5,66, CI 1,30-13,92, p < 0,001; Tabelul 3). Curbele Kaplan-Meier care evidențiază supraviețuirea fără recidivă pentru localizarea în fosa posterioară (p = 0,007), atipia nucleară (p = 0,137), gradul de rezecție (p = 0,001) și MIB-1 >4,5% (p = 0,001) sunt prezentate în figurile 1A-D.
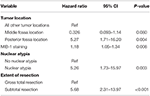
Tabel 3. Analiza de regresie Cox pentru recurență.

Figura 1. Curbele Kaplan Meier ale factorilor de risc pentru recurența meningiomului de gradul I OMS. (A) Atipia nucleară (linie albastră) vs. absența atipiilor nucleare (linie roșie) (X2 = 2,21, p = 0,137). (B) Localizarea tumorii în fosa posterioară (linie albastră) vs. alte localizări (linie roșie) (X2 = 10,36, p = 0,001). (C) Indice MIB-1 >4,5% (linie albastră) vs. ≤4,5% (linie roșie) (X2 = 6,17, p = 0,013). (D) STR (linie albastră) vs. GTR (linie roșie) (X2 = 10,46, p = 0,001).
Prictorii de recidivă precoce vs. post-mediană a meningiomului de grad I OMS de grad I
În Tabelul 4 este prezentată o comparație între pacienții nerecurenți și pacienții cu tumori care au recidivat precoce sau post-mediană. Pacienții cu o recidivă precoce au avut o incidență mai mare a rezecției subtotale (76,9 vs. 32,7%, p = 0,001). Aceștia au avut, de asemenea, o tendință spre o incidență mai mare de atipie nucleară (23,1 vs. 7,5%, p = 0,084) la histopatologie (Tabelul 4). Pacienții cu o recidivă post-mediană au avut tendința spre o incidență mai mare a localizării tumorii în fosa posterioară (23,1 vs. 6,6%, p = 0,063) și o incidență mai mare a invaziei osoase (38,5 vs. 16,9%, p = 0,064), precum și un indice MIB-1 mai mare (5,55 vs. 3,22%, p = 0,098). Nu a existat nicio diferență semnificativă între clasificarea Simpson sau ratele GTR la pacienții cu recurență post-mediană față de pacienții nerecurenți (Tabelul 4).
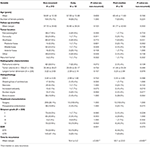
Tabel 4. Recurența precoce vs. recurența post-mediană.
Două modele logistice binare multivariate cu probabilitate inversă au fost utilizate pentru a identifica predictorii recurenței precoce vs. recurența post-mediană (Tabelul 5). Factorii predictivi independenți ai recidivei tumorale precoce au inclus atipia nucleară la histopatologie (OR = 6,45, IC 1,34-31,07, p = 0,020) și STR (OR = 8,92, IC 2,18-36,46, p = 0,002). Singurul predictor independent al recidivei post-mediane a fost indicele MIB-1 (OR = 1,24, CI 1,05-1,45, p = 0,010), deși localizarea în fosa posterioară s-a apropiat de semnificație (OR = 4,42, CI 0,954-20,49, p = 0,058; Tabelul 5).

Tabel 5. Model logistic binar pentru recurența tumorală post-mediană și precoce.
Analiza de partiționare recursivă a recurenței
RPA a fost efectuată pentru a identifica factorii de risc cheie ai recurenței meningiului (Figura 2). În concordanță cu analiza cox-regresivă, STR a fost prima partiție atunci când a prezis recurența globală: 18,6 % dintre pacienții cu o rezecție STR au recidivat, în comparație cu 6,5 % cu o GTR. Următorul nod de decizie în cadrul doar al pacienților cu GTR a implicat un cutoff MIB-1 de 4,5 %, deoarece 18,8 % dintre pacienții cu un MIB-1 >4,5 % au recidivat față de 3,3 % dintre pacienții cu un MIB-1 ≤4,5 % (figura 2A). În ceea ce privește recidiva post-mediană în mod specific, RPA a identificat primul nod de decizie ca fiind un cutoff MIB-1 de 5,83%: 22,2% dintre pacienții cu MIB-1 >5,83% au recidivat vs. 3,3% dintre pacienții cu un MIB-1 ≤5,83%. Nodul de decizie ulterior a utilizat o localizare a tumorii în fosa posterioară: 13,3% dintre pacienții cu o tumoare în fosa posterioară au recidivat vs. 2,5% din alte localizări tumorale (Figura 2B). RPA pentru recidiva timpurie a identificat gradul de rezecție ca nod de decizie primar: 11,6% dintre pacienții cu STR au recidivat vs. 2,0% dintre pacienții cu GTR. Următorul nod de decizie a utilizat falx sau localizarea parasagitală: 36,4% din tumorile falx sau parasagitale au recidivat vs. 8,1% din alte localizări tumorale (Figura 2C).
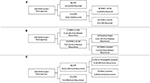
Figura 2. Analiza de partiționare recursivă care evidențiază factorii de risc cheie pentru (A) recurența globală, (B) recurența post-mediană și (C) recurența precoce.
Discuție
Rezultate cheie
Recurența meningiomului de gradul I OMS este asociată în mod independent cu indicele MIB-1, localizarea tumorii în fosa posterioară, prezența atipiei nucleare și STR. Mai precis, un indice MIB-1 de 4,5% a fost identificat ca fiind un prag relevant din punct de vedere clinic în stratificarea riscului la pacienții cu meningiom de gradul I OMS în urma RTG. Pacienții cu un indice MIB-1 >4,5% și cu GTR a meningiomului de gradul I OMS au prezentat un risc de recidivă similar cu cel al pacienților cu STR. O analiză suplimentară a evidențiat MIB-1 ca fiind un factor critic asociat cu recurența post-mediană, în timp ce gradul de rezecție a fost principalul factor determinant al recurenței timpurii.
Predictori de recurență a meningiomului de grad OMS I
Studii anterioare au evaluat în mod similar relația dintre caracteristicile histopatologice, caracteristicile clinice și recurența în toate gradele OMS ale meningiomului. Într-un studiu efectuat pe 901 pacienți (716 de gradul I OMS, 174 de gradul II și 11 de gradul III), Gousias et al. demonstrează un risc mai mare de recidivă în cazul meningioamelor cu un indice MIB-1 de >10%, grad OMS mai mare, dimensiune tumorală >6 cm, localizare petroclivă sau în sinusul cavernos și multiplicitate (11). Cu toate acestea, Gousias et al. nu au evaluat relația dintre prezența caracteristicilor atipice la histologie și recidiva tumorală. În cazul meningioamelor de gradul I OMS în mod specific, Marciscano et al. au utilizat o cohortă de 148 de pacienți cu meningiom de gradul I OMS cu analiză patologică completă pentru a identifica variabilele asociate cu recidiva, cu accent pe impactul caracteristicilor patologice atipice asupra riscului de recidivă (9). În mod interesant, aceștia identifică prezența caracteristicilor atipice ca fiind un factor de risc independent, în plus față de indicele MIB-1 >3% și rezecția Simpson. Studiul nostru evidențiază în mod similar GTR chirurgical și atipia nucleară, o caracteristică atipică, ca predictori independenți ai recidivei (tabelul 3), deși am evaluat fiecare caracteristică atipică în mod independent. De asemenea, luăm în considerare localizarea tumorii în modelul nostru de cox-regresie, identificând în continuare localizarea în fosa posterioară a tumorii ca factor de risc independent de recidivă. În timp ce Marciscano et al. nu au inclus localizarea tumorii în analiza lor a factorilor de predicție a progresiei, Gousias et al. demonstrează în mod similar localizarea petroclivă a tumorii ca factor de risc pentru recurență, deși atunci când iau în considerare toate gradele de meningiom OMS (9, 11). Riscul mai mare de recidivă asociat cu localizarea în fosa posterioară se poate datora prevalenței crescute a mutațiilor NF2 în fosa posterioară (14, 15, 20), deși nu suntem în măsură să explorăm pe deplin acest aspect, deoarece nu efectuăm în mod obișnuit teste genetice ale meningiomului în instituția noastră. Indiferent de aceasta, sunt necesare studii suplimentare cu cohorte mai mari de pacienți cu meningiom de gradul I OMS pentru a investiga această relație.
Indexul MIB-1 și recurența meningiomului de gradul I OMS
Similară studiilor anterioare (9, 11, 13, 21), am evaluat apoi și relația dintre indicele MIB-1 al unei tumori și riscul de recurență al acesteia. Am evaluat mai întâi indicele MIB-1 într-un model cox-regresiv pentru recurența globală, așa cum am discutat anterior. În concordanță cu studiile anterioare, am constatat că un indice MIB-1 mai mare a fost asociat în mod independent cu un risc general crescut de recidivă. Având în vedere discrepanțele în ceea ce privește valorile limită pentru MIB-1 între literatura de specialitate și variabilitatea între laboratoare, am evaluat inițial MIB-1 ca o variabilă continuă. Am căutat apoi să determinăm valoarea limită pentru indicele MIB-1 în populația noastră de pacienți prin utilizarea RPA pentru a modela recurența globală, care a identificat o valoare limită MIB-1 de 4,5 % la pacienții cu GTR (Figura 2A). În mod interesant, acești pacienți au avut un risc de recurență similar cu cel al pacienților cu un STR, demonstrând utilitatea MIB-1 la pacienții care au urmat GTR. Perry et al. identifică în mod similar un indice MIB-1 de 4,2% ca fiind asociat cu recidiva după GTR pe baza unei analize univariate, deși atunci când se iau în considerare toate gradele de meningiom (22).
Rata de recidivă de 18,8% la pacienții cu un GTR și MIB-1 >4,5%, evidențiază necesitatea unei supravegheri atente a acestor pacienți sau chiar luarea în considerare a radioterapiei adjuvante, în funcție de preferințele pacienților. S-a demonstrat că radioterapia adjuvantă în urma rezecției pentru meningiomul de gradul I OMS reduce recurența, în special după STR (23-25), deși observația după STR rămâne o practică standard (8). Într-un studiu efectuat pe 92 de meningioame de gradul I OMS, Soyuer et al. au demonstrat o supraviețuire fără progresie (PFS) de 91% la pacienții care au primit radioterapie adjuvantă după STR, care a fost semnificativ mai mare decât PFS de 38% la acei pacienți care nu au primit radioterapie adjuvantă (24). Având în vedere că pacienții din studiul nostru cu un STR au avut un risc de recidivă similar cu cei cu un GTR și MIB-1 >4,5%, radioterapia adjuvantă pentru ambele grupuri poate fi rezonabilă. Cu toate acestea, sunt necesare studii mai ample pentru a valida în continuare cutoff-ul nostru MIB-1 și implicațiile clinice asociate. Sunt necesare, de asemenea, studii prospective care să investigheze utilizarea radioterapiei adjuvante în cazul meningioamelor de gradul I OMS.
Predictori de recidivă precoce și post-mediană a meningiomului de gradul I OMS
Datorită tendinței spre o recidivă mai târzie la pacienții cu un MIB ridicat >4.5% (Figura 1C), am căutat apoi să investigăm diferențele între predictorii dintre pacienții care au recidivat precoce (definiți ca fiind în termen de 2 ani de la tratament) sau post-mediu (cei care au recidivat >2 ani după tratament). Puține studii din literatura de specialitate au investigat predictorii recurenței precoce în cazul meningioamelor. Un studiu realizat de Budohoski et al. identifică localizarea parafalcină, STR și edemul peritumoral pe imagistica radiografică drept predictori ai recidivei precoce într-o cohortă de 220 de meningioame atipice (26). Un studiu similar realizat de Maillo et al. în cazul meningioamelor de gradul I OMS, utilizează hibridizarea fluorescentă in situ (FISH) în interfază și caracteristicile patologice pentru a identifica factorii de risc pentru recidiva precoce (definită ca fiind la 2,5 ani după tratament) și a constatat că dimensiunea mai mare a tumorii, anomaliile cariotipului, vârsta pacientului și anomaliile cromozomului 10 sunt asociate cu un risc crescut de recidivă (19). Cu toate acestea, autorii nu au luat în considerare prezența atipiilor pe patologie sau indicele MIB-1. Utilizând o cohortă de pacienți cu meningiom de gradul I OMS cu date patologice și clinice mai granulare, am identificat gradul de rezecție și atipia nucleară pe patologie ca predictori independenți ai recidivei timpurii pe modelarea regresiei logistice binare (tabelul 5). RPA a evidențiat în mod similar importanța gradului de rezecție în stratificarea riscului de recidivă precoce la pacienți (Figura 2C). În mod interesant, aceasta a evidențiat, de asemenea, riscul crescut asociat cu localizarea falx/parasagitală a tumorii, ceea ce corespunde cu constatările lui Budohoski et al. (26). Singurul predictor semnificativ al recidivei tumorale post-mediane pe modelarea regresiei logistice binare a fost indicele MIB-1, deși localizarea în fosa posterioară a tumorii s-a apropiat de semnificație. Acest lucru a fost demonstrat în continuare pe RPA (Figura 2B). În mod surprinzător, gradul de rezecție nu a fost un predictor independent al recidivei post-mediane, deoarece majoritatea recidivelor post-mediane au fost supuse unei RGE. Recidivele post-mediane pot evidenția o categorie de meningiom de gradul I OMS care este mai agresivă din punct de vedere molecular și care recidivează în ciuda GTR, având în vedere indicele MIB-1 ridicat și localizarea în fosa posterioară . Recidivele timpurii sunt semnificativ mai afectate de gradul de rezecție și, ca urmare, reprezintă probabil creșterea continuă a tumorii reziduale, spre deosebire de recidiva tumorii anterioare complet rezecate, așa cum se observă în cazul recidivelor post-mediane. Astfel, rezultatele noastre reprezintă, în mod potențial, două subtipuri moleculare diferite de meningiom de gradul I OMS. Cu toate acestea, sunt necesare studii viitoare cu cohorte mai mari de pacienți și date tumorale moleculare pentru a investiga în continuare diferențele care stau la baza modificărilor moleculare între recidivele timpurii și cele post-mediane.
Limitări
Limitările studiului nostru includ natura sa retrospectivă și incidența scăzută a recidivei. Studiul nostru include, de asemenea, pacienți începând cu 2007 și, ca urmare, acoperă atât schemele de clasificare a SNC ale OMS din 2007, cât și cele din 2016. Cu toate acestea, singura schimbare semnificativă între cele două clasificări a fost adăugarea invaziei cerebrale ca un criteriu unic pentru statutul de grad II al OMS. Doar doi dintre pacienții incluși în cohorta noastră au avut invazie cerebrală observată la analiza patologică și niciunul dintre pacienți nu a recidivat. Prin urmare, nu credem că includerea pacienților clasificați folosind schema de clasificare din 2007 a avut un impact semnificativ asupra rezultatelor noastre. În plus, studiul nostru se bazează pe rapoartele patologice întocmite în urma rezecției inițiale, fără o reanaliză centrală a lamelelor patologice. Acest lucru poate duce la o variabilitate crescută a variabilelor patologice, cum ar fi atipia nucleară și alte constatări patologice similare care pot demonstra variabilitate interobservator (27, 28). Cu toate acestea, MIB-1 este o măsură relativ obiectivă, cu o variabilitate inter-observator mai mică între patologii care utilizează aceeași metodă în cadrul unui laborator de anatomie patologică (29). Modelele de practică în ceea ce privește testarea MIB-1 s-au schimbat, de asemenea, pe parcursul perioadei de timp a studiului, de la preferința individuală a patologilor, care a variat în funcție de patolog, la testarea la toți pacienții. Factorii luați în considerare de către patologi atunci când au decis cu privire la testarea MIB-1 au inclus caracteristicile atipice incluse în studiul nostru, minimizând astfel impactul potențial al acestora asupra constatărilor noastre. În plus, toate meningioamele incluse în studiul nostru sunt de gradul I al OMS. Prin urmare, considerăm că orice prejudecată introdusă în studiu pe baza acestor modificări ale modelelor de practică este minimă. În cele din urmă, deși includem caracteristici clinice și patologice detaliate, cohortei noastre de pacienți îi lipsesc informațiile privind modificările genetice și moleculare ale tumorii, care s-au dovedit a avea un impact semnificativ asupra rezultatelor tumorale (15, 30-32). Astfel, rămâne nevoie de studii multi-instituționale suplimentare de mari dimensiuni cu date moleculare/genetice, pe lângă variabilele patologice și clinice tradiționale, atunci când se prezice recurența globală a meningioamelor de gradul I OMS. Aceasta include luarea în considerare a prognosticatorilor moleculari/genetici, cum ar fi modelele de metilare la nivelul întregului genom (33, 34), mutațiile promotorului TERT (35) și date moleculare tumorale suplimentare având în vedere constatările noastre, sunt justificate, de asemenea, investigații viitoare privind predictorii genetici/moleculari, clinici și patologici unici ai recidivelor timpurii și ulterioare, având în vedere impactul potențial asupra luării deciziilor terapeutice de către medici.
Cu toate acestea, studiul nostru oferă o perspectivă detaliată asupra predictorilor clinici și histopatologici ai recidivei, în special în cazul meningioamelor de gradul I OMS. În plus, identificăm pacienții cu un MIB-1 >4,5% ca având un risc ridicat de recidivă în urma RTG. De asemenea, valorificăm datele noastre pentru a oferi o perspectivă asupra diferențelor dintre recurențele timpurii și post-mediane ale meningiomului de gradul I OMS, identificând potențial diferite subgrupuri moleculare de meningiom de gradul I OMS. Rezultatele noastre sugerează că pacienții cu un indice MIB-1 ridicat și atipii nucleare la analiza patologică, localizarea în fosa posterioară a tumorii lor și STR prezintă un risc mai mare de recidivă și ar trebui să fie luați în considerare pentru o urmărire mai atentă sau chiar pentru radioterapie adjuvantă. În plus, pacienții cu un indice MIB-1 mai mare de 4,5% prezintă un risc similar de recidivă ca și cei care au suferit STR a tumorilor lor și ar trebui, de asemenea, să fie potențial luați în considerare pentru radioterapie adjuvantă.
Concluzie
Rămâne o lipsă de literatură cu privire la predictorii specifici de recidivă în meningioamele de gradul I OMS. Constatările acestui studiu evidențiază localizarea tumorii în fosa posterioară, indicele MIB-1, atipia nucleară și gradul de rezecție ca fiind asociate în mod independent cu recurența meningioamelor de grad I. De asemenea, demonstrăm că pacienții cu un indice MIB-1 >4,5% și GTR au un risc de recurență similar cu cel al pacienților cu un STR. În cele din urmă, analiza diferențială a recidivelor timpurii și post-mediane a evidențiat asocierea indicelui MIB-1 și a localizării fosei posterioare în cazul recidivelor post-mediane, în timp ce recidivele timpurii au fost influențate mai semnificativ de gradul de rezecție. Sunt necesare studii suplimentare care să valideze constatările noastre și care să includă date moleculare/genetice pentru a identifica factori predictivi suplimentari de recidivă în meningioamele de gradul I OMS. Astfel de studii ar putea oferi un cadru mai precis pentru stratificarea riscului pacienților și ar putea ajuta la luarea deciziilor terapeutice, inclusiv potențialul de radioterapie adjuvantă.
Declarație privind disponibilitatea datelor
Datele brute care susțin concluziile acestui articol vor fi puse la dispoziție de către autori, fără rezerve nejustificate.
Declarație etică
Studiile care au implicat participanți umani au fost revizuite și aprobate de UCSF Institutional Review Board. Consimțământul în cunoștință de cauză în scris pentru participare nu a fost necesar pentru acest studiu, în conformitate cu legislația națională și cu cerințele instituționale.
Contribuții ale autorilor
AH: conceptualizare, metodologie, analiză formală, investigație, scriere – proiect original, scriere – revizuire și editare și vizualizare. JY: conceptualizare, metodologie, și scriere-revizuire și editare. IK și SS: investigație. J-SC: vizualizare și analiză formală. DR și MM: scriere, revizuire și editare. SM: redactare-revizuire și editare, conceptualizare și metodologie. MA: redactare-revizuire și editare și supervizare. Toți autorii au contribuit la articol și au aprobat versiunea trimisă.
Conflict de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Revizorul BB a declarat editorului care se ocupă de manipulare o coautorie anterioară cu autorii DR, MM și SM.
1. Ostrom QT, Cioffi G, Gittleman H, Patil N, Waite K, Kruchko C, et al. Raportul statistic CBTRUS: tumori primare ale creierului și alte tumori ale sistemului nervos central diagnosticate în Statele Unite în 2012-2016. Neuro Oncol. (2019) 21:v1-100. doi: 10.1093/neuonc/noz150
PubMed Abstract | Refef Full Text | Google Scholar
2. Karsy M, Guan J, Cohen A, Colman H, Jensen RL. Managementul medical al meningioamelor. Starea actuală, tratamente eșuate și orizonturi promițătoare. Neurosurg Clin N Am. (2016) 27:249-60. doi: 10.1016/j.nec.2015.11.002
PubMed Abstract | Refef Full Text | Google Scholar
3. Brastianos PK, Galanis E, Butowski N, Chan JW, Dunn IF, Goldbrunner R, et al. Advances in multidisciplinary therapy for meningiomas. Neuro Oncol. (2019) 21:I18-31. doi: 10.1093/neuonc/noy136
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Louis DN, Perry A, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | Refef Full Text | Google Scholar
5. Pettersson-Segerlind J, Orrego A, Lönn S, Mathiesen T. Urmărirea pe termen lung de 25 de ani a meningioamelor parasagitale tratate chirurgical. World Neurosurg. (2011) 76:564-71. doi: 10.1016/j.wneu.2011.05.015
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Van Alkemade H, De Leau M, Dieleman EMT, Kardaun JWPF, Van Os R, Vandertop WP, et al. Supraviețuire afectată și probleme neurologice pe termen lung în meningiomul benign. Neuro Oncol. (2012) 14:658-66. doi: 10.1093/neuonc/nos013
PubMed Abstract | Refef Full Text | Google Scholar
7. Buerki RA, Horbinski CM, Kruser T, Horowitz PM, James CD, Lukas RV. O trecere în revistă a meningioamelor. Futur Oncol. (2018) 14: 2161-77. doi: 10.2217/fon-2018-0006
PubMed Abstract | Refef Full Text | Google Scholar
8. Rogers L, Barani I, Chamberlain M, Kaley TJ, McDermott M, Raizer J, et al. Meningioamele: baza de cunoștințe, rezultatele tratamentului și incertitudinile. O revizuire RANO. J Neurosurg. (2015) 122:4-23. doi: 10.3171/2014.7.JNS131644
PubMed Abstract | Refef Full Text | Google Scholar
9. Marciscano AE, Stemmer-Rachamimov AO, Niemierko A, Larvie M, Curry WT, Barker FG, et al. Meningioame benigne (grad I OMS) cu caracteristici histologice atipice: corelația caracteristicilor histopatologice cu rezultatele clinice. J Neurosurg. (2016) 124:106-14. doi: 10.3171/2015.1.JNS142228
PubMed Abstract | Refef Full Text | Google Scholar
10. Baumgarten P, Gessler F, Schittenhelm J, Skardelly M, Tews DS, Senft C, et al. Brain invasion in otherwise benign meningiomas does not predict tumor recurrence. Acta Neuropathol. (2016) 132:479-81. doi: 10.1007/s00401-016-1598-1
PubMed Abstract | Refef Full Text | Google Scholar
11. Gousias K, Schramm J, Simon M. The simpson grading revisited: chirurgie agresivă și locul ei în managementul modern al meningiomului. J Neurosurg. (2016) 125:551-60. doi: 10.3171/2015.9.JNS15754
PubMed Abstract | Refef Full Text | Google Scholar
12. Matsuno A, Fujimaki T, Sasaki T, Nagashima T, Ide T, Asai A, et al. Analiza clinică și histopatologică a potențialului proliferativ al meningioamelor recurente și nerecurente. Acta Neuropathol. (1996) 91:504-10. doi: 10.1007/s004010050458
PubMed Abstract | Text integral | Google Scholar
13. Oya S, Kawai K, Nakatomi H, Saito N. Semnificația sistemului de clasificare Simpson în chirurgia modernă a meningioamelor: integrarea gradului cu indicele de etichetare MIB-1 ca o cheie pentru a prezice recurența meningioamelor de gradul I OMS – articol clinic. J Neurosurg. (2012) 117:121-8. doi: 10.3171/2012.3.JNS111945
PubMed Abstract | Refef Full Text | Google Scholar
14. Yuzawa S, Nishihara H, Tanaka S. Genetic landscape of meningioma. Brain Tumor Pathol. (2016) 33:237-47. doi: 10.1007/s1007/s10014-016-0271-7
PubMed Abstract | Refef Full Text | Google Scholar
15. Karsy M, Azab MA, Abou-Al-Shaar H, Guan J, Eli I, Jensen RL, et al. Potențialul clinic al perspectivei genomice a meningiomului: o revizuire practică pentru neurochirurgi. Neurosurg Focus. (2018) 44:E10. doi: 10.3171/2018.2.2.FOCUS1849
PubMed Abstract | Reflect Full Text | Google Scholar
16. Patel AJ, Wan YW, Al-Ouran R, Revelli JP, Cardenas MF, Oneissi M, et al. Profilul molecular prezice recurența meningiomului și dezvăluie pierderea reprimării complexului DREAM în tumorile agresive. Proc Natl Acad Sci USA. (2019) 116:21715-26. doi: 10.1073/pnas.1912858116
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Spille DC, Heß K, Sauerland C, Sanai N, Stummer W, Paulus W, et al. Brain invasion in meningiomas: incidence and correlations with clinical variables and prognosis. World Neurosurg. (2016) 93:346-54. doi: 10.1016/j.wneu.2016.06.055
PubMed Abstract | CrossRef Full Text | Google Scholar
18. PiŽem J, Velnar T, Prestor B, Mlakar J, Popović M. Brain invasion assessability in meningiomas is related to meningioma size and grade, and can be improved by extensive sampling of the surgical removed meningioma specimen. Clin Neuropathol. (2014) 33:354-63. doi: 10.5414/NP300750
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Maillo A, Orfao A, Espinosa AB, Sayagués JM, Merino M, Sousa P, et al. Recurențele timpurii în meningioamele histologic benigne/gradul I sunt asociate cu tumori mari și coexistența monosomiei 14 și a del(1p36) în clona celulară ancestrală a tumorii. Neuro Oncol. (2007) 9:438-46. doi: 10.1215/15228517-2007-026
PubMed Abstract | Text integral | Google Scholar
20. Youngblood MW, Duran D, Montejo JD, Li C, Omay SB, Özduman K, Sheth AH, et al. Corelații între subgrupul genomic și caracteristicile clinice într-o cohortă de peste 3000 de meningioame. J Neurosurg. (2019). doi: 10.3171/2019.8.jns191266. .
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Chen WC, Magill ST, Wu A, Vasudevan HN, Morin O, Aghi MK, et al. Histopathological features predictive of local control of atypical meningioma after surgery and adjuvant radiotherapy. J Neurosurg. (2019) 130:443-50. doi: 10.3171/2017.9.JNS171609
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Perry A, Stafford SL, Scheithauer BW, Suman VJ, Lohse CM. Semnificația prognostică a citometriei de flux MIB-1, p53 și ADN în meningioamele primare complet rezecate. Cancer. (1998) 82:2262-9. doi: 10.1002/(SICI)1097-0142(19980601)82:11<2262::AID-CNCR23>3.0.CO;2-R
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Ohba S, Kobayashi M, Horiguchi T, Onozuka S, Yoshida K, Ohira T, et al. Rezultatul chirurgical pe termen lung și factorii biologici de prognostic la pacienții cu meningioame la baza craniului: articol clinic. J Neurosurg. (2011) 114:1278-87. doi: 10.3171/2010.11.11.JNS10701
PubMed Abstract | Refef Full Text | Google Scholar
24. Soyuer S, Chang EL, Selek U, Shi W, Maor MH, DeMonte F. Radioterapia după intervenția chirurgicală pentru meningiom cerebral benign. Radiother Oncol. (2004) 71:85-90. doi: 10.1016/j.radonc.2004.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
25.
25.
. Park S, Cha YJ, Cha YJ, Suh SH, Lee IJ, Lee KS, Hong CK, et al. Risk group-adapted adjuvant radiotherapy for WHO grade I and II skull base meningioma. J Cancer Res Clin Oncol. (2019) 145:1351-60. doi: 10.1007/s00432-019-02891-6
PubMed Abstract | Reflect Full Text | Google Scholar
26. Budohoski KP, Clerkin J, Millward CP, O’Halloran PJ, Waqar M, Looby S, et al. Predictori ai progresiei precoce a meningioamelor atipice tratate chirurgical. Acta Neurochir. (2018) 160:1813-22. doi: 10.1007/s00701-018-3593-x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. De La Monte SM, Flickinger J, Linggood RM. Caracteristici histopatologice care prezic recurența meningioamelor după rezecția subtotală. Am J Surg Pathol. (1986) 10:836-43. doi: 10.1097/00000478-198612000-00002
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Backer-Grøndahl T, Moen BH, Torp SH. The histopathological spectrum of human meningiomas. Int J Clin Exp Pathol. (2012) 5:231-42.
PubMed Abstract | Google Scholar
29. Rezanko T, Akkalp AK, Tunakan M, Sari AA. Metode de numărare a MIB-1 în meningioame și acordul dintre patologi. Anal Quant Cytol Histol. (2008) 30:47-52.
PubMed Abstract | Google Scholar
30. Pérez-Magán E, Campos-Martín Y, Mur P, Fiaño C, Ribalta T, García JF, et al. Genetic alterations associated with progression and recurrence in meningiomas. J Neuropathol Exp Neurol. (2012) 71:882-93. doi: 10.1097/NEN.0b013e31826bf704
PubMed Abstract | Refef Full Text | Google Scholar
31. Linsler S, Kraemer D, Driess C, Oertel J, Kammers K, Rahnenführer J, et al. Determinări biologice moleculare ale progresiei și recidivei meningiomului. PLoS ONE. (2014) 9:e94987. doi: 10.1371/journal.pone.0094987
PubMed Abstract | Refef Full Text | Google Scholar
32. Barbera S, Miguel TS, Gil-Benso R, Muñoz-Hidalgo L, Roldan P, Gonzalez-Darder J, et al. Modificări genetice cu valoare prognostică în meningioamele histologic benigne. Clin Neuropathol. (2013) 32:311-7. doi: 10.5414/NP300580
PubMed Abstract | Full Text | Google Scholar
33. Gao F, Shi L, Russin J, Zeng L, Chang X, He S, et al. Metailarea ADN în transformarea malignă a meningioamelor. PLoS ONE. (2013) 8:e54114. doi: 10.1371/journal.pone.0054114
PubMed Abstract | Refef Full Text | Google Scholar
34. Vengoechea J, Sloan AE, Chen Y, Guan X, Ostrom QT, Kerstetter A, et al. Markeri de metilare a potențialului malign în meningioame. J Neurosurg. (2013) 119:899-906. doi: 10.3171/2013.7.JNS13311
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Lu VM, Goyal A, Goyal A, Lee A, Jentoft M, Quinones-Hinojosa A, Chaichana KL. The prognostic significance of TERT promoter mutations in meningioma: a systematic review and meta-analysis (Semnificația prognostică a mutațiilor promotorului TERT în meningiom: o revizuire sistematică și o meta-analiză). J Neurooncol. (2019) 142:1-10. doi: 10.1007/s11060-018-03067-x
PubMed Abstract | Refef Full Text | Google Scholar
.