Introducere
Razul are o arhitectură complexă a rădăcinilor, cu un amestec de rădăcini embrionare și post-embrionare. Radiculul apare primul în timpul germinării, urmat la scurt timp după aceea de rădăcinile coronare embrionare (Rebouillat et al., 2009; Coudert et al., 2010). Primele rădăcini adventive post-embrionare rezultate din activitatea meristemului apical al lăstarilor apar la câteva zile după germinarea răsadului. Rădăcinile adventive sunt, de asemenea, numite rădăcini coronare sau de coroană și sunt produse pe tot parcursul vieții unei plante.
Anatomia internă a rădăcinilor de orez este bine descrisă, în special în stadiile de răsad (Rebouillat et al., 2009). Mai multe țesuturi concentrice (de la periferie până la stela) sunt situate între epidermă și țesuturile vasculare (figura 1). Aceste țesuturi, denumite în mod colectiv „țesut de sol”, sunt uneori denumite și „cortex” (Lux et al., 2004). Aici, păstrăm termenul generic, și anume, țesut de sol, pentru a descrie țesuturile exodermice, sclerenchyma, corticale și endodermice. Ne referim la „cortex” ca fiind țesutul situat între endodermă și sclerenchyma.
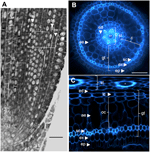
Figura 1. Anatomia unei radicule de Nipponbare în vârstă de 6 zile. (A) Secțiune longitudinală a unei radicule fixate și încorporate în paraplast. Bară = 100 μm. (B) Secțiune transversală a unei radicule proaspete observată sub lumină UV. Bară = 50 μm. (C) Vedere transformată polar din B. Straturile de țesuturi sunt etichetate după cum urmează: stela (st), țesutul de bază (gt) compus din mai multe straturi de celule: un strat de endodermă (ed), mai multe straturi de cortex (c), un strat de sclerenchyma (sc) și un strat de exodermă (ex). Straturile endodermice (ed) și exodermice (ex) sunt ușor de identificat prin absența/reducerea fluorescenței în centrele peretelui celular al acestor celule. Radiculul este protejat de un strat de epidermă (ep). Pot fi identificate două tipuri de straturi corticale: cortexul intern (ic), care se află lângă endoderm (ed), și cortexul extern (oc), care va forma în cele din urmă aerenchima (ae). În stela, observați prezența unui metaxilem central mare (cx) înconjurat de 6 vase metaxilemice (x).
Tesutul tegumentar este alcătuit din mai multe straturi de țesuturi care au aceeași origine parenchimatoasă, dar caracteristici specifice diferite, care joacă roluri structurale și funcționale variate și importante în rădăcini. De exemplu, exodermul și endodermul sunt bariere apoplastice care controlează transportul radial al apei și nutrienților din sol către organele fotosintetice, o caracteristică asigurată în principal prin depunerea de lamele de suberină și diferențierea peretelui celular secundar (Gregory, 2006). Sclerenchyma sunt celule lignificate care reprezintă o barieră critică pentru unele metale și, posibil, joacă un rol de suport mecanic (Huang et al., 2012). Spre deosebire de aceste trei țesuturi monostrat, țesutul cortical din radicula de orez este compus din patru sau cinci straturi. Acest țesut, denumit, de asemenea, cortexul mijlociu sau mezodermul, se caracterizează prin formarea schizogenă a spațiilor, ceea ce duce la formarea aerenchymei la orez (Justin și Armstrong, 1991; Kawai et al., 1998). Aerenchyma joacă un rol major în toleranța la condițiile de inundare și asigură un flux continuu de oxigen de la lăstar la rădăcină, permițând creșterea rădăcinilor în condiții anoxice. Cortexul are o funcție importantă, dar variabilă, în fiziologia rădăcinilor la numeroase specii și este implicat în depozitare, toleranță la inundații sau interacțiuni simbiotice (Lux et al., 2004).
Radiculul și rădăcinile coroanei produc trei tipuri de rădăcini laterale: rădăcini laterale mici (SLR) și două tipuri de rădăcini laterale mari (Kawata și Shibayama, 1965; Kono et al., 1972; Rebouillat et al., 2009). Această diviziune se bazează pe (i) diametrul rădăcinilor: SLR-urile sunt cele mai mici (50-60 μm), iar L-LLR-urile sunt cele mai mari (120-150 μm), (ii) ramificațiile, care sunt observate doar la LLR-uri, (iii) prezența unui vas metaxilemic central doar la LLR-uri și (iv) prezența unui strat de sclerenchyma doar la L-LLR-uri (Kono et al., 1972; Kawata et al., 1977; Rebouillat et al., 2009). În ciuda acestei clasificări, identitatea țesuturilor interne ale rădăcinilor laterale, în special a SLR-urilor, rămâne incertă. Într-adevăr, atât Rebouillat et al. (2009), cât și Kawata et al. (1977) au afirmat că țesutul radicular al SLR este alcătuit din endodermă, sclerenchimă și exodermă (dinspre interior spre exterior), în timp ce în cazul lui Kono et al. (1972), stratul celular sclerenchimatos din interiorul cortexului a fost descris ca fiind absent în SLR și T-LLR.
Pentru a rezolva această dilemă, precum și pentru a studia dezvoltarea și funcția anumitor țesuturi în general, este necesară utilizarea de markeri de identitate. Majoritatea markerilor tisulari utilizați până în prezent sunt markeri morfologici sau coloranți histochimici, care au oferit o modalitate utilă de caracterizare a identității celulare. Berberina relevă prezența suberinei în pereții celulari, care se găsește aproape exclusiv în benzile Casparian care înconjoară fiecare celulă endodermică individuală și este, astfel, un bun marker indirect al identității endodermice (Brundett et al., 1988). La A. thaliana, markerii specifici pentru țesuturi au fost, de asemenea, dezvoltați folosind promotori specifici pentru țesuturi fuzionați cu gene reporter (GUS și/sau GFP) în plante modificate genetic. De exemplu, promotorul SCARECROW este utilizat ca marker de identitate endodermică (Sugimoto et al., 2010). Liniile GUS QC25 și QC46 enhancer trap GUS (Sabatini et al., 2003) și QHB la orez (Kamiya et al., 2003) au fost, de asemenea, identificate ca markeri ai centrului quiescent (QC) pe baza expresiei lor specifice QC. În ciuda interesului pentru acești markeri, doar câțiva sunt disponibili și aproape exclusiv la A. thaliana. Aceștia prezintă, de asemenea, dezavantaje. De exemplu, adecvarea utilizării promotorului SCARECROW (SCR) ca marker al „endodermului” este discutabilă atunci când sunt abordate întrebări specifice privind rolurile SCR și SHORT ROOT (SHR) în diferențierea țesutului de sol. Într-adevăr, genele SCR și SHR sunt implicate per se în formarea endodermei/cortexului (Wu și Gallagher, 2014). La A. thaliana, singurii markeri disponibili pentru cortexul rădăcinii sunt promotorii Co2 și Co3 (Heidstra et al., 2004; Ten Hove et al., 2010). La orez, acești markeri de cortex nu sunt încă utilizați, deoarece nu există ortologi clari pentru genele Co2 și Co3. Până în prezent, la orez au fost utilizați doar markeri morfologici indirecți, cum ar fi formarea aerenchymei pentru identitatea corticală (Rebouillat et al., 2009).
O altă clasă de markeri sunt anticorpii disponibili în comerț, direcționați împotriva pereților celulari ai plantelor (http://www.plantprobes.net/index.php). Acești markeri au fost utilizați foarte puțin în trecut, dar eficiența lor a fost demonstrată. De exemplu, anticorpii împotriva peretelui celular CCRC-M2 și JIM13 au fost utilizați la A. thaliana pentru a arăta că singurul strat de țesut intern prezent la mutantul shr avea identitate corticală, în timp ce stratul de țesut de sol al mutantului scr prezenta identități multiple (Di Laurenzio et al., 1996; Helariutta et al., 2000). Acești markeri au multe avantaje: simplitatea lor și posibilitatea de a combina anticorpi secundari cuplați la diferiți fluorocromi pentru a limita suprapunerea cu auto-fluorescența, nu necesită transformare genetică și pot fi folosiți pentru a completa alte clase de markeri.
În această lucrare, descriem mai întâi un protocol simplu cu randament mediu pentru imunomarcajul secțiunilor de țesut proaspăt vibratome. Folosind acest protocol, am analizat secțiuni radiale de radicule de orez cu o bibliotecă mare de 174 de anticorpi împotriva peretelui celular. Printre aceștia, am identificat opt markeri specifici cortexului și am demonstrat că orezul posedă două tipuri de țesuturi corticale cu identitate distinctă. Am numit aceste straturi cortexul intern și cortexul extern pe baza poziției lor anatomice respective în secțiunile de rădăcină. Pentru a demonstra utilitatea acestor markeri specifici cortexului, am clarificat identitatea țesuturilor de sol ale rădăcinilor laterale folosind trei dintre acești anticorpi. În special în cazul SLR-urilor, arătăm că stratul de țesut intern are o identitate corticală externă. Protocolul nostru este suficient de generic pentru a fi utilizat pentru dezvoltarea de markeri tisulari la orice specie, fără a fi necesară generarea de plante transgenice. Acest protocol poate fi ușor adaptat cu lăstari proaspeți, frunze, rădăcini sau orice alte țesuturi din alte plante și reprezintă o modalitate simplă și ușoară de identificare a markerilor specifici pentru țesut. Mai mult, acești markeri pot fi utilizați împreună cu alți markeri moleculari.
Rezultate
Imunoprofilarea anticorpilor pentru peretele celular în secțiunile radiale ale rădăcinilor de orez dezvăluie anticorpi specifici pentru straturile corticale
Cu scopul de a identifica markerii pe bază de anticorpi pentru celulele corticale, am stabilit mai întâi un protocol pentru imunomarcajul cu randament mediu al secțiunilor radiale ale rădăcinilor proaspete de orez (a se vedea Materiale și metode și Figura suplimentară 1 pentru detalii). Apoi, am efectuat un screening cu anticorpi monoclonali crescuți împotriva componentelor peretelui celular (de la Complex Carbohydrate Research Center (CarboSource Services, Athens Georgia, SUA) și Paul Knox Cell Wall lab (universitatea din Leeds, Regatul Unit), a se vedea Materiale și metode pentru detalii)) pentru a identifica markerii corticali. Din cei 174 de anticorpi testați, doar 12 au fost reținuți ca fiind putativ specifici cortexului. Am testat repetabilitatea acestora prin efectuarea a două experimente suplimentare și am ajuns la concluzia că opt anticorpi au prezentat profiluri similare și robuste între cele trei replici (Figura 2). Cinci anticorpi (JIM7, M14, M38, M130 și M131) au furnizat același model de imunomarcaj în cortex. Doar pereții celularelor neadiacente au fost marcați, rezultând o etichetare singulară în formă de „diamant” a tuturor celulelor corticale. În cazul celorlalți trei anticorpi (LM5, M133 și M107), marcarea a fost detectată în cortex și, uneori, în celulele sclerenchymei, în special cu anticorpii LM5 și M107. Semnalul a fost omogen pe peretele celular al cortexului, dar a fost mult mai slab în straturile interioare ale cortexului (stratul de cortex adiacent stratului endodermal) decât în straturile exterioare ale cortexului. Astfel, toți acești anticorpi cu profiluri care sunt complementare țesuturilor corticale sunt markeri specifici care pot fi utilizați pentru a analiza identitatea celulelor corticale. Mai mult decât atât, cele două etichete corticale diferite, care definesc două zone subcorticale, sugerează că straturile externe și interne au o identitate moleculară distinctă care a fost evidențiată de acești anticorpi.
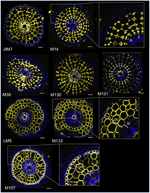
Figura 2. Identificarea a opt anticorpi specifici cortexului (JIM7, M14, M38, M130, M131, LM5, M133 și M107) printre cei 174 de anticorpi selecționați din biblioteca de anticorpi monoclonali împotriva peretelui celular. Pentru fiecare anticorp, imaginile fuzionate ale secțiunilor transversale au fost obținute la un microscop confocal după marcarea imunohistologică: în galben, modelul anticorpului la 561 nm, iar în albastru, autofluorescența peretelui celular sub lumină UV. Cinci anticorpi (JIM7, M14, M38, M130 și M131) prezintă un profil similar în toate straturile de celule corticale colorate (forme de diamant). Trei anticorpi (LM5, M133 și M107) au marcat în mod omogen pereții celulelor corticale. Rețineți că pentru acești anticorpi, straturile corticale interne (ic) nu sunt colorate în comparație cu straturile corticale externe (oc). Inserțiile sunt prim-planuri ale imaginilor corespunzătoare. Barele = 20 μm.
Câteva trăsături specifice ale acestor două straturi subcorticale au fost evidențiate atunci când a fost utilizat pluginul „polar transformer” al software-ului ImageJ (http://imagej.nih.gov/ij/) pentru a vizualiza imaginile secțiunilor rădăcinii (figurile 1B,C; Schneider et al., 2012; Lartaud et al., 2014). Celulele interioare au fost caracterizate de un perete celular gros în comparație cu celulele exterioare, care prezentau diverse cavități care conțineau aer, rezultate din fuziunea peretelui celular. De asemenea, celulele corticale interioare prezentau o formă aplatizată, asemănătoare celulelor endodermice, spre deosebire de celulele exterioare, care erau mai rotunde. În această imagine transformată, peretele celular radial, care este peretele care pornește de la partea interioară a celulei spre partea exterioară, autofluorescența celulelor endodermale și exodermale nu este vizibilă, probabil din cauza prezenței benzilor Casparian. În mod similar, dar într-o măsură mai mică, mici găuri scutite de autofluorescență au fost, de asemenea, vizibile pe pereții celulari radiali ai celulelor corticale interne.
Toate tipurile de rădăcini laterale posedă doar țesut cortical extern
Pentru a demonstra utilitatea markerilor corticali și pentru a caracteriza identitățile celulare, am marcat cele trei tipuri de rădăcini laterale de orez (L-LLR, T-LLR și SLR) cu trei dintre acești anticorpi (M107, M133 și M14). Pentru acest experiment, deoarece L-LLR nu se dezvoltă adesea pe plăci Petri, rădăcinile laterale au fost colectate de la răsaduri de orez cultivate în condiții hidroponice timp de 2 săptămâni. Am analizat mai întâi organizarea țesutului de sol al fiecărui tip de rădăcină laterală prin observarea autofluorescenței pereților celulari în vederile transversală și polară ale secțiunilor de rădăcină (figura 3). Această primă analiză a evidențiat o anatomie radială internă ușor distinctă pentru cele trei tipuri de rădăcini laterale. La fel ca în cazul secțiunilor de radicule privite la lumină UV, țesuturile endodermice și exodermice pot fi identificate prin stingerea fluorescenței în centrul pereților celulari radiali. Aceste două țesuturi au fost prezente în toate rădăcinile laterale. Între endoderm și exoderm, mai multe straturi de țesuturi erau prezente în L-LLR și T-LLR, în timp ce SLR aveau doar un singur strat celular (neidentificat). Anatomia L-LLR-urilor seamănă cu cea a rădăcinilor seminale, iar în exteriorul endodermului, mai multe straturi de țesut cortical au fost ușor de identificat atunci când s-a format țesutul aerenchyma. În plus, a fost observat, de asemenea, un strat de sclerenchyma format din celule strâns compacte cu pereți celulari largi. În funcție de experiment, acest strat celular nu a fost întotdeauna complet dezvoltat. În secțiunile T-LLR, stratul extern semăna cu țesutul cortical, iar stratul intern semăna cu stratul SLR unic (neidentificat).
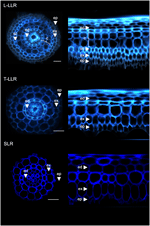
Figura 3. Compoziția tisulară a tipurilor de rădăcină laterală mare (Large-LLR și Thin-LLR) și a rădăcinii laterale mici (SLR). Răsadurile au fost cultivate în condiții hidroponice timp de 2 săptămâni. Autofluorescența peretelui celular din secțiunile transversale și vizualizarea transformată polară sub lumină UV. Țesuturile sunt etichetate după cum urmează: epidermă (ep), exodermă (ex), cortex (c), endodermă (ed). Rețineți că epiderma (ep) a fost adesea fragmentată pe parcursul experimentului. Barele = 20 μm.
Pentru a identifica straturile celulare prezente în țesuturile solului SLR și T-LLR și pentru a confirma identitatea corticală în L-LLR, am imunomarcat secțiuni de rădăcină laterală cu trei anticorpi specifici cortexului (M107, M133 și M14; Figura 4). Anticorpii M107 și M133 au marcat toate straturile celulare situate între endodermă și exodermă în toate rădăcinile laterale. Pe baza colorării radiculelor pentru acești anticorpi, această observație a indicat faptul că aceste straturi celulare ar putea avea identitate de sclerenchyma sau corticală. Cu toate acestea, faptul că M14 a imunomarcat și aceste straturi, în special în secțiunile SLR, demonstrează în mod clar că aceste straturi aveau identitate corticală externă.

Figura 4. Imagini fuzionate ale tipurilor de rădăcină laterală mare (Large-LLR și Thin-LLR) și ale secțiunilor de rădăcină laterală mică (SLR) imunomarcate cu M107, M133 și M14. Răsadurile au fost cultivate în condiții hidroponice timp de 2 săptămâni. În galben, marcarea anticorpilor la 561 nm, iar în albastru, autofluorescența sub lumină UV. Țesuturile sunt etichetate după cum urmează: epidermă (ep), exodermă (ex), cortex (c), endodermă (ed). Rețineți că epiderma (ep) a fost adesea fragmentată pe parcursul experimentului. Barele = 20 μm.
Variațiile numărului de straturi de celule corticale exterioare (unul în SLR, două în T-LLR, trei în L-LLR și patru până la cinci în radiculă) joacă un rol major în diametrul rădăcinilor de orez (Figura 5).
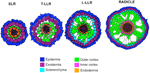
Figura 5. Reprezentarea schematică a țesuturilor rădăcinii laterale și a radiculei.
Concluzii
Diferiți termeni au fost deja utilizați pentru a califica zonele subcorticale din plante. De exemplu, prezența unui strat de cortex lignificat „intern”, comparabil cu cel studiat aici, a fost deja descrisă la orezul sălbatic (Yang et al., 2014). La porumb, cele două domenii corticale sunt definite în mod diferit (Baluška et al., 1993). Domeniul „interior” formează aerenchyma, care corespunde cortexului exterior de aici, iar cortexul „mijlociu-exterior” este un țesut de susținere lignificat, care ar putea fi sclerenchyma. La Arabidopsis, a fost descris, de asemenea, un strat celular de „cortex mijlociu”, situat între monostraturile corticale și endodermă (Baum et al., 2002; Paquette și Benfey, 2005). Rezultatele recente sugerează că acest strat de cortex, a cărui formare este reglată de GA, de stresul oxidativ și de SHR și SCR, printre altele, joacă un rol în toleranța abiotică (Paquette și Benfey, 2005; Cui și Benfey, 2009; Pauluzzi et al., 2012; Wu și Gallagher, 2014). Este interesant faptul că acest strat este, de asemenea, descris ca un strat de tip helix cu o formă tipică (Baum et al., 2002). Ar putea fi acest strat de „cortex mijlociu” din Arabidopsis similar din punct de vedere funcțional și structural cu stratul de cortex intern al radiculei de orez? În secțiunile longitudinale și transversale ale orezului, stratul cortical intern formează, de asemenea, de obicei, un helix, sugerând că aceste două straturi de țesut ar putea fi comparabile. La Arabidopsis, stratul de „cortex mijlociu” este derivat dintr-o diviziune periclinală a endodermului, care apare departe de QC între 7 și 14 zile după germinare (Paquette și Benfey, 2005). Vor fi necesare noi instrumente pentru a verifica acești parametri importanți la orez. De exemplu, până în prezent, nu a fost descris niciun mutant care să afecteze momentul formării acestui strat. În plus, sunt necesare, de asemenea, progrese tehnice în ceea ce privește imagistica QC a orezului. Cu toate acestea, markerii noștri specifici cortexului oferă un nou instrument de comparare a funcției și a rețelei moleculare implicate în formarea cortexului intern (orez) față de „cortexul mijlociu” (Arabidopsis). În laboratorul nostru sunt în curs de desfășurare lucrări de identificare a determinanților moleculari ai formării cortexului intern și extern, cu ortologii de orez SCR și SHR ca primii candidați pentru reglementarea formării cortexului în rădăcinile de orez (Pauluzzi et al., 2012).
Materiale și metode
Material vegetal
Semințe în vârstă de șase zile
Semințe de Oryza sativa L. ssp. japonica Nipponbare cultivar Nipponbare au fost cultivate pe verticală în plăci Petri sterile (Corning, 431301; 20 × 20 cm) în condiții controlate (ritm zi/noapte: 12/12 h, 28/25°C, intensitate luminoasă: 500 μE m-2 s-1). Mai întâi, semințele au fost sterilizate la suprafață prin clătire în etanol 70% timp de ~1 min. Apoi, etanolul a fost înlocuit cu o soluție compusă din 40 % înălbitor în apă distilată conținând trei picături de tween 80 (Sigma-Aldrich P4780-500 mL). Semințele au fost înmuiate în această soluție timp de 30 de minute cu agitare ușoară, iar apoi au fost clătite de cel puțin patru ori cu apă distilată sterilă. Mediul Murashige și Skoog (MS/2) sterilizat la cald (~50°C) în autoclav (250 ml) se toarnă în vase Petri și se lasă să se solidifice timp de ~45 min. Mediul solid MS/2 este compus din 2,15 g.L-1 de amestec de săruri bazale de mediu MS (Duchefa Biochemie, M0221), 75 mg.L-1 de amestec de vitamine MS (Duchefa Biochemie, M0409) și 8 g.L-1 de agaroză de tip II (Sigma-Aldrich, A6877). Semințele sterile sunt apoi împinse în mediul MS/2 solidificat, cu radicula orientată în jos. Rădăcinile au fost recoltate după 6 zile de creștere.
Plante de patru săptămâni
După 3 zile de germinare în apă, răsadurile au fost transferate într-un sistem hidroponic în condiții controlate (ritm zi/noapte: 12/12 h, 28/25°C, intensitate luminoasă: 500 μE m-2 s-1, umiditate relativă: 55%). Sistemul hidroponic este alcătuit dintr-o cutie de plastic de 50 L care conține 30 L de soluție hidroponică, pe care este așezată o saltea de spumă de 1 cm grosime. Salteaua de spumă este perforată cu goluri pentru a menține bazele tulpinilor răsadurilor. Mediul hidroponic este compus din (NH4)2SO4 (0,5 mM), MgSO4.7H2O (1,6 mM), Ca(NO3)2.4H2O (1,2 mM), KNO3 (0,7 mM), FeSO4 (0,1 mM), Na2EDTA (0,1 mM), MnSO4. H2O (1,7 μM), (NH4)6Mo7O24.4H2O (0,2 μM), ZnSO4.7H2O (0,2 μM), CuSO4.5H2O (0,2 μM), H3BO3 (1,4 μM) și KH2PO4 (0,6 mM). Soluția este aerisită de o pompă plasată în partea de jos a cutiei de plastic și este schimbată la fiecare 10 zile. pH-ul a fost ajustat și menținut la 5,4 ± 0,2.
Secționarea rădăcinilor proaspete
Punctele radiculelor în creștere sau ale rădăcinilor laterale (2 cm) au fost tăiate cu o lamă ascuțită și așezate în paralel pentru a alinia vârfurile rădăcinilor (figurile suplimentare 1A,B). Acestea au fost înglobate într-o picătură de agaroză topită 3% (50°C; figura suplimentară 1C). Plasturii care conțineau vârfurile rădăcinilor au fost introduși într-un puț de 3 × 1 × 1 cm umplut cu agaroză topită 3% (Figura suplimentară 1D). După solidificare, blocurile au fost redimensionate și lipite pe o placă vibratome pentru a fi tranșate. Parametrii vibratomei (Hm650v (Thermo Scientific Microm)) au fost viteza 30, frecvența 70, amplitudinea 0,8 și grosimea 60 μm (figura suplimentară 1E). Secțiunile au fost transferate fie pe lamele de cameră (Lab-teak 177402) pentru imunocolorare (Figura suplimentară 1F), fie pe lamele umezite cu soluție tampon de fosfat alcalin 1X (PBS, Sigma-Aldrich P3813) pentru observare.
Imunolocalizare
Secțiunile plasate pe lamele de cameră (trei pe cameră) au fost mai întâi clătite în glicină 0,1 M suplimentată cu PBS 1X și apoi de două ori în PBS 1X, fiecare timp de 10 min. Țesuturile au fost apoi scufundate într-o soluție PBS care conține 5% ser fetal bovin (soluție de blocare, Thermo Fisher 37520) la 4°C peste noapte, sub agitare. Anticorpii primari, diluați la 1/10 în această soluție de blocaj, au fost aplicați peste noapte la 4°C sub agitare. Secțiunile au fost apoi clătite de 3 ori în PBS 1X timp de 10 minute. Secțiunile de rădăcină au fost incubate timp de 2 ore cu anticorpul secundar diluat de 500 de ori în soluție de blocare, sub agitare. Acești anticorpi au fost cuplați la un fluorofor, la anticorpul Alexa 546 anti-șobolan (Invitrogen A11081) sau la anticorpul Alexa 546 anti-șoarece (Invitrogen A11060). Apoi, secțiunile au fost clătite din nou de trei ori în PBS 1X sub agitare, timp de 10 minute fiecare. Camerele au fost îndepărtate și s-au adăugat câteva picături de mediu de montaj mowiol (Sigma-Aldrich 81381). O lamelă de acoperire a fost plasată pe secțiunile de rădăcină, care au fost lăsate să se usuce timp de 36 h la 4°C la întuneric.
Fixare în paraformaldehidă
Radiculele crescute pe plăci Petri timp de 6 zile au fost fixate în paraformaldehidă 4% (în PBS 1X) peste noapte la 4°C și clătite de două ori folosind PBS 1X (Jackson, 1991). Țesuturile fixate au fost deshidratate în etanol, curățate în Histochoice Clearing Agent (HistoClear, Sigma Aldrich) și încorporate în Paraplast (Fisher). Țesuturile au fost secționate (6 μm grosime) pe un microtometru Leica RM2255 și montate pe lame SuperfrostPlus (Fisher).
Microscopie
Observațiile în câmp luminos și autofluorescență au fost efectuate cu ajutorul unui microscop Leica DM4500. Pentru autofluorescență, imaginile au fost realizate cu cubul filtru „A” (interval de excitație: UV; filtru de excitație: BP 340-380; filtru de suprimare: LP 425). Secțiunile imunomarcate au fost observate cu microscoape confocale: Zeiss LSM 510 sau Leica SP8. Pereții celulari au fost vizualizați mai întâi cu ajutorul autofluorescenței . Anticorpul secundar a fost vizualizat cu ajutorul unui laser cu heliu/neon la 543, respectiv 561 nm. Imaginile au fost realizate cu o cameră color Retiga 2000R (QIMAGING, Canada) care rulează software-ul de achiziție a imaginilor Volocity (Improvision, UK).
Contribuții ale autorilor
SH, FD, MB, CB: achiziția datelor; SH, CP, AD analiza datelor; SH, EG, CP, AD: redactarea manuscrisului.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Recunoștințe
Le mulțumim MRI (Montpellier RIO Imaging plateform), PHIV și La Gaillarde Plateforms pentru suportul lor tehnic pentru imunolocalizare și/sau imagistică confocală și multifotonică. SH este susținut de o bursă de doctorat CIRAD.
Material suplimentar
Materialul suplimentar pentru acest articol poate fi găsit online la adresa: https://www.frontiersin.org/article/10.3389/fpls.2015.01139
Abbreviations
ae, aerenchyma; c, cortex; ed, endodermis; ep, epidermis; ex, exodermis; gt, ground tissue; ic, inner cortex; L-LLR, rădăcină laterală mare de tip mare; oc, cortex extern; sc, sclerenchimă; SLR, rădăcină laterală mică; st, stela; T-LLR, rădăcină laterală mare de tip subțire; x, xilem.
Baluška, F., Brailsford, R. W., Hauskrecht, M., Jackson, M. B., și Barlow, P. W. (1993). Dimorfismul celular în cortexul rădăcinii de porumb: implicarea microtubulilor, etilenei și giberelinei în diferențierea comportamentului celular în zonele de creștere postmitotică. Bot. Acta 106, 394-403. doi: 10.1111/j.1438-8677.1993.tb00766.x
CrossRef Full Text | Google Scholar
Baum, S. F., Dubrovsky, J. G., și Rost, T. L. (2002). Organizarea apicală și maturizarea cortexului și a cilindrului vascular în rădăcinile Arabidopsis thaliana (Brassicaceae). Am. J. Bot. 89, 908-920. doi: 10.3732/ajb.89.6.908
PubMed Abstract | Full CrossRef Text | Google Scholar
Brundett, M. C., Enstone, D. E. și Peterson, C. A. (1988). A Berberine-aniline blue fluorescent staining procedure for suberin, lignin, and callose in plant tissue. Protoplasma 146, 133-142. doi: 10.1007/BF0140405922
CrossRef Full Text | Google Scholar
Coudert, Y., Périn, C., Courtois, B., Khong, N. G., și Gantet, P. (2010). Genetic control of root development in rice, the model cereal. Trends Plant Sci. 15, 219-226. doi: 10.1016/j.tplants.2010.01.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., and Benfey, P. N. (2009). Interacțiunea dintre SCARECROW, GA și LIKE HETEROCHROMATIN PROTEIN 1 în modelarea țesutului de sol în rădăcina Arabidopsis. Plant J. 58, 1016-1027. doi: 10.1111/j.1365-313X.2009.03839.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Laurenzio, L., Wysocka-Diller, J., Malamy, J. E., Pysh, L., Helariutta, Y., Freshour, G., et al. (1996). Gena SCARECROW reglează o diviziune celulară asimetrică care este esențială pentru a genera organizarea radială a rădăcinii de Arabidopsis. Cell 86, 423-433. doi: 10.1016/S0092-8674(00)80115-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Gregory, P. J. (2006). Rădăcinile plantelor: Growth, Activity, and Interaction with Soils (Creșterea, activitatea și interacțiunea cu solurile). Oxford; Ames, IA: Blackwell Pub.
Google Scholar
Heidstra, R., Welch, D., și Scheres, B. (2004). Analizele mozaice care utilizează clone de activare și deleție marcate disecă acțiunea SCARECROW din Arabidopsis în diviziunea celulară asimetrică. Genes Dev. 18, 1964-1969. doi: 10.1101/gad.305504
PubMed Abstract | Full CrossRef Text | Google Scholar
Helariutta, Y., Fukaki, H., Wysocka-Diller, J., Nakajima, K., Jung, J., Sena, G., et al. (2000). Gena SHORT-ROOT controlează configurația radială a rădăcinii Arabidopsis prin semnalizare radială. Cell 101, 555-567. doi: 10.1016/S0092-8674(00)80865-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, C. F., Yamaji, N., Ono, K., și Ma, J. F. (2012). O genă a unei kinaze asemănătoare receptorilor de tip receptor cu repetiție bogată în leucină este implicată în specificarea straturilor celulare externe în rădăcinile de orez. Plant J. 69, 565-576. doi: 10.1111/j.1365-313X.2011.04824.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Jackson, D. (1991). „In-situ hybridization in plants” în Molecular Plant Pathology: A Practical Approach, eds D. J. Bowles, M. McPherson, și S. J. Gurr (Totowa, NJ: Humana Press), 163-174.
Google Scholar
Justin, S. H. F. W., și Armstrong, W. (1991). Dovezi pentru implicarea etilenei în formarea aerenchymei în rădăcinile adventive de orez (Oryza sativa L.). New Phytol. 118, 49-62. doi: 10.1111/j.1469-8137.1991.tb00564.x
CrossRef Full Text | Google Scholar
Kamiya, N., Nagasaki, H., Nagasaki, H., Morikami, A., Sato, Y. și Matsuoka, M. (2003). Izolarea și caracterizarea unei gene homeobox de tip WUSCHEL din orez care se exprimă în mod specific în celulele centrale ale unui centru quiescent din meristemul apical al rădăcinii. Plant J. 35, 429-441. doi: 10.1046/j.1365-313X.2003.01816.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kawai, M., Samarajeewa, P. K., Barrero, R. A., Nishiguchi, M. și Uchimiya, H. (1998). Disecția celulară a modelului de degradare a morții celulelor corticale în timpul formării aerenchymei rădăcinilor de orez. Planta 204, 277-287. doi: 10.1007/s00425005050257
CrossRef Full Text | Google Scholar
Kawata, S., Sasaki, O., și Yamazaki, K. (1977). Cu privire la structura rădăcinii coronare și a rădăcinii laterale, precum și a legăturii vasculare dintre ele, la plantele de orez. Jpn. J. Crop. Sci. 46, 569-579. doi: 10.1626/jcs.46.569
CrossRef Full Text | Google Scholar
Kawata, S., și Shibayama, B. (1965). On the lateral root primordia formation in the crown roots of rice plant. Proc. Crop Sci. Soc. Jpn. 33, 423-431. doi: 10.1626/jcs.33.423
CrossRef Full Text | Google Scholar
Kono, Y., Igeta, M., și Yamada, N. (1972). Studii privind fiziologia de dezvoltare a rădăcinilor laterale în rădăcinile seminale de orez. Jpn. J. Crop. Sci. 41, 192-204. doi: 10.1626/jcs.41.192
CrossRef Full Text
Lartaud, M., Perin, C., Courtois, B., Thomas, E., Henry, S., Bettembourg, M., et al. (2014). PHIV-RootCell: un instrument de analiză supravegheată a imaginilor pentru cuantificarea parametrilor anatomici ai rădăcinilor de orez. Front. Plant Sci. 5:790. doi: 10.3389/fpls.2014.00790
PubMed Abstract | CrossRef Full Text | Google Scholar
Lux, A., Luxova, M., Abe, J., și Morita, S. (2004). Cortexul rădăcinii: variabilitatea structurală și funcțională și răspunsurile la stresul de mediu. Root Res. 13, 117-131. doi: 10.3117/rootres.13.117
CrossRef Full Text | Google Scholar
Paquette, A. J., și Benfey, P. N. (2005). Maturarea țesutului de sol al rădăcinii este reglată de giberelină și SCARECROW și necesită SHORT-ROOT. Plant Physiol. 138, 636-640. doi: 10.1104/pp.104.058362
PubMed Abstract | CrossRef Full Text | Google Scholar
Pauluzzi, G., Divol, F., Puig, J., Guiderdoni, E., Dievart, A., și Périn, C. (2012). Navigarea de-a lungul rețelei de gene a țesutului de sol al rădăcinilor. Dev. Biol. 365, 14-22. doi: 10.1016/j.ydbio.2012.02.007
PubMed Abstract | Refef Full Text | Google Scholar
Rebouillat, J., Dievart, A., Verdeil, J., Escoute, J., Giese, G., Breitler, J., et al. (2009). Genetica moleculară a dezvoltării rădăcinilor de orez. Rice 2, 15-34. doi: 10.1007/s12284-008-9016-5
CrossRef Full Text | Google Scholar
Sabatini, S., Heidstra, R., Wildwater, M., and Scheres, B. (2003). SCARECROW este implicat în poziționarea nișei celulelor stem în meristemul rădăcinii Arabidopsis. Genes Dev. 17, 354-358. doi: 10.1101/gad.252503
PubMed Abstract | CrossRef Full Text | Google Scholar
Schneider, C. A., Rasband, W. S., și Eliceiri, K. W. (2012). NIH Image to ImageJ: 25 de ani de analiză a imaginilor. Nat. Methods 9, 671-675. doi: 10.1038/nmeth.2089
PubMed Abstract | Full Text | Google Scholar
Sugimoto, K., Jiao, Y., și Meyerowitz, E. M. (2010). Regenerarea Arabidopsis din mai multe țesuturi are loc prin intermediul unei căi de dezvoltare a rădăcinilor. Dev. Cell 18, 463-471. doi: 10.1016/j.devcel.2010.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Ten Hove, C. A., Willemsen, V., de Vries, W. J., Van Dijken, A., Scheres, B. și Heidstra, R. (2010). SCHIZORIZA codifică un factor nuclear care reglează asimetria diviziunilor celulelor stem în rădăcina Arabidopsis. Curr. Biol. 20, 452-457. doi: 10.1016/j.cub.2010.01.018
PubMed Abstract | Refef Full Text | Google Scholar
Wu, S., și Gallagher, K. L. (2014). Mișcarea factorului de transcripție neautonomă a celulelor, SHORT-ROOT se bazează pe sistemul endomembranar. Plant J. 80, 396-409. doi: 10.1111/tpj.12640
PubMed Abstract | Full Text | Google Scholar
Yang, C., Zhang, X., Li, J., Bao, M., Ni, D. și Seago, J. L. (2014). Anatomia și histochimia rădăcinilor și lăstarilor la orezul sălbatic (Zizania latifolia Griseb.). J. Bot. 2014, 9. doi: 10.1155/2014/181727
CrossRef Full Text | Google Scholar
.