US Pharm. 2012;37(5):HS-2-HS-7.
Durerea este cel mai frecvent motiv pentru care oamenii apelează la asistență medicală.1Un studiu recent estimează că durerea afectează zeci de milioane de americani și costă Statele Unite 635 de miliarde de dolari anual din cauza creșterii consumului de îngrijiri medicale și a costurilor indirecte din cauza zilelor de muncă pierdute și a pierderii productivității.2 Gestionarea durerii cronice cu medicamente, cum ar fi opioidele, este o strategie comună, dar durerea cronică poate persista sau se poate agrava în ciuda tratamentului agresiv cu opioide. Acest articol își propune să facă lumină asupra fenomenului opioidelor care sunt prescrise pentru a trata durerea, dar care provoacă o durere nouă sau o înrăutățire paradoxală a durerii.Această condiție se numește hiperalgezie indusă de opioide (OIH). OIH poate fi definită mai formal ca o sensibilizare nociceptivă crescută cauzată de expunerea la opioide.3OIH diferă în mod distinct de toleranță, dependență, adicție și progresia bolii. Prevalența clinică a OIH este necunoscută.4
Diagnostic și prezentare
Una dintre principalele probleme în diagnosticarea corectă a OIH este asemănarea strânsă a acestei afecțiuni cu toleranța la opioide. Toleranța și OIHîmpărtășesc caracteristica unui răspuns analgezic redus la doza de opioide și probabil că împărtășesc multe dintre aceleași mecanisme celulare.5Toleranța poate fi depășită prin creșterea dozei de opioide, în timp ce aceeași creștere la un pacient cu OIH are ca rezultat o înrăutățire a durerii.4În plus, toleranța tinde să se dezvolte lent în timp, în timp ce durerea crescută care rezultă în urma tratamentului cu opioide la pacientul cu OIH apare relativ rapid. Adesea, OIH diferă de toleranță prin faptul căintensitatea durerii este mai puternică decât cea raportată inițial.6
Durerea subtratată este o altă posibilitate care trebuie exclusă. Dacă terapia cu opioide este suboptimală, creșterea dozei ar trebui să ducă la ameliorarea durerii; dacă este prezentă OIH, ar trebui să fie adevărat contrariul. Pentru un diagnostic precis de OIH, durerea trebuie să se rezolve odată ce tratamentul cu opioidul incriminat este întrerupt.6 Pentru a complica și mai mult lucrurile, hiperalgezia rezultată în urma sevrajului de opioide este un fenomen bine documentat.7 Ca atare, rezolvarea durerii în urma întreruperii tratamentului cu opioide în cazul OIH nu va fi imediată și va necesita răbdare. Acest lucru ridică propriile provocări atât pentru clinician, cât și pentru pacient.
OIH tinde să se prezinte cu alte caracteristici distincte (TABELUL 1).Durerea asociată cu OIH tinde să fie mai difuză și de calitate mai slabă, iar stimulii nocivi tind să fie mai dureroși decât ar fi de așteptat în mod normal. În cazul OIH, durerea se manifestă adesea în zone care se extind dincolo de regiunea leziunii sau a leziunilor tisulare. Durerea poate persista în OIH în ciuda eliminării sursei inițiale de durere sau a vindecării țesutului lezat.În OIH, pe măsură ce tratamentul cu opioide progresează, durerea poate da iluzia că se agravează mai mult decât s-a raportat inițial, în ciuda timpului, a odihnei și a altor măsuri care ar permite în mod normal o vindecare relevantă din punct de vedere clinic.5 În plus, alodinia a fost demonstrată într-o serie de studii de OIH la om și la animale.8

Etiologie
Există o serie de teorii privind cauza OIH. Teoria care a fost cea mai cercetată și care se bucură în prezent de cea mai mare atenție este modelul neuroexcitator. Se crede că anumiteopioide și metaboliții lor agonizează receptorul N-metil-D-aspartat (NMDA). Activarea receptorului NMDA determină un aflux de calciu care sporește foarte mult excitabilitatea neuronului. Atunci când receptorul NMDA și neuronii corespunzători sunt mai activi, aceștia pot transmite mai ușor impulsurile dureroase inițiate de substanța circulantă Por alți stimuli nocivi. Glutamatul este agonistul endogen primar al receptorului NMDA.9
În sprijinul acestei teorii a pronocicepției modulate de activarea receptorilor NMDA sunt studii care arată ameliorarea OIH după administrarea de antagoniști ai receptorilor NMDA. Acești antagoniști se leagă necompetitiv la situsul de fenciclidină de pe canalul NMDA și blochează influxul de calciu care ar avea loc atunci când receptorul leagă glutamatul sau un alt agonist.10 Studiile pe animale și la om au demonstrat că subiecții cu OIH cărora li s-a administrat ketamină, un antagonist al receptorilor NMDA, au obținut scoruri mai bune în timpul testelor controlate de stimulare a durerii. Într-un studiu, șobolanilor li s-au administrat injecții intratecale de morfină timp de câteva zile până când au prezentat OIH sensibilă la căldură. Administrarea de dizocilpină, un inhibitor NMDA, a fost eficientă în inversarea cel puțin parțială a hiperalgeziei termice.5 Alți antagoniști ai receptorilor NMDA, cum ar fi dextrometorfanul, au demonstrat unele dovezi de ameliorare a stărilor hiperalgezice prin inhibarea receptorului NMDA.
Opioidele, cum ar fi codeina, hidromorfonul și morfina, sunt supuse unui număr de biotransformări ca parte a procesului metabolic normal.Codeina este metabolizată în morfină de către enzima CYP2D6. Morfina este metabolizată într-o serie de molecule, dar este metabolizată în principal prin glucuronidare în morfină-3-glucuronidă (M3G) și, într-o măsură mai mică, în morfină-6-glucuronidă (M6G) (FIGURA 1).11
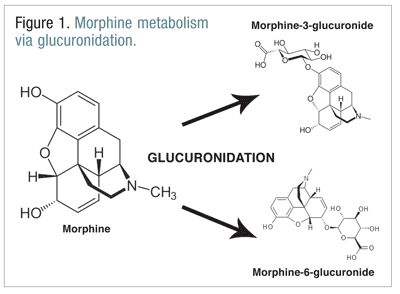
M6G este un metabolit important din punct de vedere terapeutic. Acesta are o afinitate de legare la receptorul mu similară cu cea a morfinei și este capabil să producă analgezie, depresie respiratorie și alte efecte similare cu cele ale morfinei. Cu toate acestea, M3G nu este un agonist la receptorul mu și are o afinitate redusă pentru receptorul mu în comparație cu morfina. Spre deosebire de morfină, M6G și alte opioide, M3G este un agonist NMDA. Pringlucuronidare, M3G este convertit la o rată de aproximativ șase ori mai mare decât cea a M6G.12 Alte opioide au fost implicate ca având activitate agonistă NMDA și efecte neuroexcitatorii paradoxale.6
În sprijinul teoriei conform căreia OIH este cauzată de activitatea altor receptori în afară de receptorul opioid mu se află dovada că OIH nu este ameliorată de administrarea unui antagonist opioid (de exemplu, naloxona). La pacienții care experimentează OIH în timp ce urmează un tratament cu doze mari de opioide, administrarea de naloxonă a provocat o înrăutățire a durerii.13 Prin deplasarea opioidului de la receptorul mu, naloxona a împiedicat opioidul să furnizeze analgezia posibilă prin activarea receptorului mu, în timp ce, în același timp, hiperalgezia a rămas neafectată.14
Dinorfina poate fi, de asemenea, implicată în dezvoltarea OIH.15Dinorfina este o peptidă opioidă endogenă care se leagă în principal de receptorul opioidkappa și, într-o măsură mai mică, de receptorii opioizi mu și NMDA. Se crede că agonizarea de către dinorfină a receptorului opioid kappa și a receptorului NMDA are un rol în pronocicepția OIHîn ciuda prezenței unor agoniști puri ai receptorilor mu. Studiile au arătat că inversarea dinorfinei poate restabili efectele analgezice ale morfinei atunci când subiecților li se administrează un antiserum de dinorfină. Mai mult, se știe că dinorfina crește în timpul administrării prelungite de opioide. Dinofina determină, de asemenea, eliberarea de neuropeptide excitatoare în diferitelocații din sistemul nervos central.
Opțiuni de tratament
După ce a fost pus diagnosticul de OIH, există o serie de opțiuni de tratament din care se poate alege cu atenție. Cu condiția ca leziunea dureroasă inițială sau leziunile tisulare să se fi rezolvat și durerea să persiste în ciuda – și din cauza – tratamentului cu opioide, cea mai directă abordare este întreruperea opioidului incriminat. Acest lucru ar trebui să se facă treptat pentru a minimiza efectele adverse ale sevrajului. Trebuie remarcat faptul că este posibil ca hiperalgezia să se agraveze la începutul procesului de întrerupere.16 Acest lucru prezintă o situație etică dificilă, în care medicul poate avea dificultăți în a convinge pacientul că medicamentul prescris pentru tratarea durerii poate să fi cauzat sau agravat durerea și că durerea se poate agrava în continuare înainte de a se rezolva în cele din urmă.17
Dacă durerea legitimă persistă și este necesară o anumită cantitate de analgezie cu opioide, trebuie explorate și alte strategii în afara întreruperii totale a opioidelor. Pacienții care se confruntă cu OIH pot obține ameliorare prin reducerea dozei de opioide.4 Există rapoarte despre pacienți care au găsit un echilibru acceptabil de analgezie și ameliorare a hiperalgeziei în urma reducerii dozei de opioide.
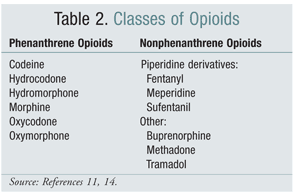
Comutarea de la o clasă structurală de opioide la alta a fost o opțiune eficientă pentru atenuarea OIH în unele studii. Studiile efectuate până în prezent au demonstrat că OIH este mai puternic asociată cu opioidele din clasa fenantrenului (TABELUL 2).4 Titrarea opioidului din clasa fenantrenului și conversia la un alt opioid poate asigura rezolvarea OIH. Codeina, hidromorfonul, morfina și opioidele similare din punct de vedere structural suferă glucuronidare ca parte a metabolismului lor. Evitarea unui metabolit glucuronidic activator al receptorilor NMDA este posibilă prin trecerea la un opioid care este unic din punct de vedere structural, cum ar fi fentanilul. În momentul redactării acestui document, OIH nu a fost demonstrată în studiile care implică oximorfonă.4
Suplimentarea terapiei cu opioide cu un inhibitor al ciclooxigenazei 2 (COX-2) este o altă strategie care are un anumit suport. Prin reducerea sintezei de prostaglandine, inhibitorii COX-2 pot scădea sensibilizarea neuronilor pronociceptivi. Medicamentele antiinflamatoare nesteroidiene (AINS) și inhibitorii COX-2 par să aibă efecte analgezice independente de capacitatea lor de a suprima sinteza prostaglandinelor la nivel periferic.9 Inhibitorii COX-2 au demonstrat, de asemenea, capacitatea de a antagoniza receptorul NMDA. La nivel central, AINS sunt capabile să antagonizeze receptorul NMDA prin blocarea glutamatului, a substanței P și a altor aminoacizi excitanți. Independent de aceasta, activarea receptorului NMDA poate crește expresia COX-2.18
Datorită atenției pe care a primit-o receptorul NMDA pentru rolul său în hipertensiunea miocardică, antagonizarea acestui receptor pare a fi o strategie de tratament rezonabilă. Ketamina a fost mult cercetată, dar efectele sale adverse pot fi severe. În timp ce antagonizează NMDA și oferă un efect anestezic care ar favoriza analgezia, efectele secundare sunt comune, diverse și severe.19 Aceste efecte includ tahiaritmia, hipertensiunea arterială, deficiențe cognitive și reacții psihomimetice, inclusiv modificări ale dispoziției, vise vii, delir, halucinații și sedare. Ketamina este eficientă în inversarea hiperalgeziei și în creșterea efectelor opioidelor la pacienții care primesc doze mari, dar efectele sale adverse o împiedică să fie o opțiune de tratament viabilă.
Dextrometorfanul este un alt antagonist al receptorilor NMDA care a fost studiat pentru tratamentul OIH. A fost studiat un produs combinat care conține un amestec 1:1 de morfină și dextrometorfan.20Studiile nu au reușit să demonstreze că terapia combinată ar putea obține o analgezie superioară în comparație cu morfina singură. Eșecuri similare ale terapiei au avut loc într-un studiu care a utilizat un amestec 2:1 al acelorași agenți.Studiile au fost criticate pentru că au avut o cantitate insuficientă de dextrometorfan pentru a antagoniza în mod adecvat receptorul NMDA.21Ceea ce rămâne necunoscut este doza de dextrometorfan necesară fie pentru a crește analgezia unui opioid, fie pentru a preveni OIH cauzată de activarea receptorilor NMDA.
Metadona este un opioid cu calități unice care o fac o opțiune convingătoare pentru tratarea durerii la pacientul cu OIH. În plus față de efectele sale analgezice prin legarea la receptorul opioid mu, metadona este un antagonist slab al receptorilor NMDA.4 S-a raportat că adăugarea chiar și a unei doze mici de metadonă a fost eficientă pentru reducerea hiperalgeziei. Într-un caz, adăugarea unei doze mici de metadonă (10 mg de două ori pe zi) a îmbunătățit în mod semnificativ rapoartele de durere, cu o reducere a dozei totale de opioide de 40% până la 50%.22 Trecerea de la opioidul incriminat la metadonă a fost o strategie populară de tratament. Tramadolul și meperidina au, de asemenea, o anumită activitate antagonistă a receptorilor NMDA.
O altă modalitate de tratament care are un anumit potențial pentru tratarea OIH este buprenorfina.23,24 Buprenorfina este un agonist parțial al opioidelor la receptorul mu și are, de asemenea, activitate antagonistă a receptorilor kappa.4Dinorfina, un agonist al receptorilor kappa, este cunoscută ca fiind în creștere în timpul tratamentului cu opioide. Activarea receptorului kappa antagonizează în mare măsură efectele mediate de receptorul mu ale opioidelor.25 Utilitatea clinică a buprenorfinei în tratamentul OIH nu a fost încă pe deplin explicată.
Concluzie: Privind înainte
Multă muncă rămâne de făcut înainte de a se putea declara că OIH esteînțeleasă. Mecanismul celular exact și căile de semnalizareresponsabile pentru acest fenomen nu sunt definite. Pentru a complica acest lucru,există rapoarte contradictorii cu privire la faptul dacă anumite componente specifice joacă un rol cheie sau dacă joacă vreun rol. Cea mai mare parte a cercetărilor privind elucidarea fiziopatologiei OIH a implicat modelul animal. Acest lucru are o anumită valoare, dar informațiile din modelul uman sunt rare.
O înțelegere slabă a cauzei unei afecțiuni generează un armamentariu incert de opțiuni de tratament. Cea mai bună strategie disponibilă este întreruperea totală a opioidului problematic, dar acest lucru este puțin util pentru pacientul care are nevoie de ameliorarea durerii de tip opioid.Au fost explorate mai multe alte modalități de tratament, dar toate ar beneficia de studii suplimentare. Majoritatea studiilor efectuate la om implică pacienți perisurgici, dependenți de droguri în recuperare și modele experimentale de durere. Aceste studii nu sunt lipsite de valoare, dar aceste populații nu reflectă populația cu dureri cronice. Alte limitări ale opțiunilor de tratament disponibile includ rezultate lipsite de strălucire, toxicitate excesivă în ciuda unui succes moderat și studii mici care produc concluzii slabe.
În momentul redactării acestui articol, sunt în curs de desfășurare sau sunt planificate o serie de studii clinice care utilizează memantina, antagonist al receptorilor NMDA, pentru tratarea OIH.26 Totuși, există rapoarte contradictorii cu privire la rolul exact al receptorilor NMDA în OIH. Trebuie efectuate cercetări suplimentare pentru a determina receptorii și mecanismele cheieresponsabile prezente în OIH. Extinderea dimensiunii eșantionului studiilor va ajuta la susținerea concluziilor deja făcute cu privire la agenții terapeutici care sunt responsabili pentru OIH și care sunt eficienți pentru tratarea acesteia. Efectuarea de studii care se concentrează pe durerea cronică, mai degrabă decât pe modelele de durere acută, poate aduce informații relevante din punct de vedere clinic pentru practician.
Chapman și colegii săi au ridicat întrebări specifice la care trebuie să se răspundă înainte de a pune diagnosticul de OIH și de a oferi un tratament eficient.27 Care sunt relațiile dintre doza și durata opioidelor și OIH? Cu ce tip de durere sau la ce tip de pacient este mai probabilă apariția OIH? Acestea sunt întrebările care trebuie să ghideze viitoarea cercetare clinică.
1. Parselis Kelly J, Cook SF, Kaufman DW, et al. Prevalența și caracteristicile consumului de opioide în populația adultă din SUA. Pain. 2008;138:507-513.
2. Institutul de Medicină. Ameliorarea durerii în America: A Blueprint for Transforming Prevention, Care, Education, and Research. Washington, DC: The National Academies Press; 2011.
3. Chu LF, Angst MS, Clark D. Hiperalgesia indusă de opioide la om: mecanisme moleculare și considerații clinice. Clin J Pain. 2008;24:479-496.
4. Lee M, Silverman SM, Hansen H, et al. O revizuire cuprinzătoare a hiperalgeziei induse de opioide. Pain Physician. 2011;14:145-161.
5. Mao J. Sensibilitatea anormală la durere indusă de opioide: implicații în terapia clinică cu opioide. Durere. 2002;100:213-217.
6. Raffa RB, Pergolizzi JV Jr. Hiperalgezia indusă de opioide: este relevantă din punct de vedere clinic pentru tratamentul pacienților cu durere? Pain Manage Nurs. 2011;1-17.
7. Li X, Clark JD. Hiperalgesia în timpul abstinenței opioidelor: medierea prin glutamat și substanța P. Anesth Analg. 2002;95:979-984.
8. Pud D, Cohen D, Lawental E, Eisenberg E. Opioidele și percepția anormală a durerii: noi dovezi dintr-un studiu al dependenților cronici de opioide și al subiecților sănătoși. Drug Alcohol Depend. 2006;82:218-223.
9. Malmberg AB, Yaksh TL. Hiperalgesia mediată de receptorul spinal glutamat sau de substanța P blocată de inhibarea ciclooxigenazei spinale. Science. 1992;257:1276 -1279.
10. Fisher K, Coderre TJ, Hagen NA. Direcționarea receptorului N-metil-D-aspartat pentru managementul durerii cronice. Studii preclinice pe animale, experiență clinică recentă și viitoare direcții de cercetare. J Pain Symptom Manage. 2000;20:358-373.
11. Lötsch J. Metaboliți opioizi. J Pain Symptom Manage. 2005;29:S10-S24.
12. Skarke C, Lötsch J. Metaboliții morfinei: implicații clinice. Semin Anesth, Perioperative Med Pain. 2002;21:258-264.
13. Juni A, Klein G, Kest B. Morphine hyperalgesia in mice isunrelated to opioid activity, analgesia, or tolerance: evidence formultiple diverse hyperalgesic systems. Brain Res. 2006;1070:35-44.
14. Angst M, Clark JD. Hiperalgezia indusă de opioide: o revizuire sistematică calitativă. Anesthesiology. 2006;104:570-587.
15. Vanderah TW, Gardell LR, Burgess SE, et al. Dynorphin promovează durerea anormală și toleranța antinociceptivă opioidă spinală. J Neurosci. 2000;20:7074-7079.
16. Hooten WM, Mantilla CB, Sandroni P, Townsend CO. Asociațiiîntre percepția durerii termice și doza de opioide în rândul pacienților cu durere cronică supuși reducerii opioidelor. Pain Med. 2010;11:1587-1598.
17. Silverman S. Hiperalgezia indusă de opioide: implicații clinice pentru practicianul în domeniul durerii. Pain Physician. 2009;12:679-684.
18. Li SQ, Xing YL, Chen WN, et al. Activarea receptorului NMDA esteasociată cu reglarea în sus a expresiei COX-2 în coloana vertebrală dorsală în timpul intrărilor nociceptive la șobolani. Neurochem Res. 2009;34:1451-1463.
19. Okon T. Ketamina: o introducere pentru medicul specialist în durere și medicină paliativă. Pain Physician. 2007;10:493-500.
20. Galer BS, Lee D, Lee D, Ma T, et al. MorphiDex (combinație de morfinesulfat/dextrometorfan hidrobromură) în tratamentul durerii cronice: trei studii multicentrice, randomizate, dublu-orb, controlateclinice nu reușesc să demonstreze o analgezie opioidă îmbunătățită sau o reducere a toleranței. Pain. 2005;115:284-295.
21. Wiesenfeld-Hallin Z. Terapii combinate opioide-NMDA antagoniste. ce avantaje oferă pentru controlul sindroamelor dureroase? Medicamente. 1998;55;1-4.
22. Vorobeychik Y, Chen L, Bush MC, Mao J. Improved opioid analgesic effect following opioid dose reduction. Pain Med. 2008;9:724-727.
23. Baron MJ, McDonald PW. Reducerea semnificativă a durerii la pacienții cu durere cronică după detoxifierea de la doze mari de opioide. J Opioid Manag. 2006;2:277-282.
24. Koppert W, Ihmsen H, Körber N, et al. Different profiles ofbuprenorphine-induced analgesia and antihyperalgesia in a human painmodel. Pain. 2005;118:15-22.
25. Pan ZZ. Acțiuni de opunere Mu a receptorului kappa-opioid. Trends Pharmacol Sci. 1998;19:94-98.
26. Ballantyne JC, Mao J. Terapia cu opioide pentru durerea cronică. N Engl J Med. 2003;349:1943-1953.
27. Chapman CR, Lipschitz DL, Angst MS, et al. Opioid pharmacotherapyfor chronic non-cancer pain in the United States: a research guidelinefor developing an evidence-base. J Pain. 2010;11:807-829.