Definiția legăturii de hidrogen
Legătura de hidrogen este o forță de atracție între un hidrogen parțial încărcat pozitiv și un atom parțial încărcat negativ (oxigen și azot). Aceasta este o legătură foarte slabă, iar puterea legăturii de hidrogen (5-10 Kcal pe legătură) este mult mai mică decât puterea legăturii covalente. Legăturile de hidrogen sunt reprezentate de obicei sub forma unor linii punctate între doi atomi. De exemplu, legătura de hidrogen între două molecule de apă este reprezentată mai jos:
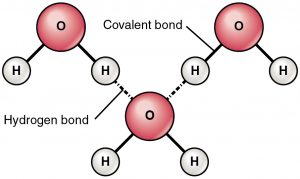
Razonul legăturii de hidrogen
Din cauza prezenței unui atom foarte electronegativ, cum ar fi oxigenul sau azotul, perechea de electroni partajată între oxigen și hidrogen este atrasă spre atomul mai electronegativ. Această distribuție inegală a perechii de electroni duce la formarea a doi dipoli parțiali. Hidrogenul încărcat parțial pozitiv este apoi atras de celălalt oxigen sau azot încărcat parțial negativ este cunoscut sub numele de legătură de hidrogen.
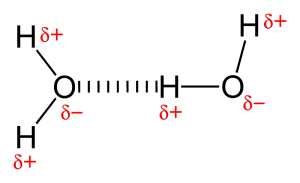
Tipuri de legătură de hidrogen
Legătura de hidrogen poate avea loc între doi atomi din aceeași moleculă sau între doi atomi din molecule diferite. În funcție de aceasta, legăturile de hidrogen sunt de două tipuri:
- Legătura de hidrogen intermoleculară
- Legătura de hidrogen intramoleculară
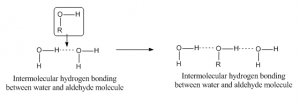
Legătura de hidrogen intermoleculară
Când legătura de hidrogen se produce între doi atomi din molecule diferite, atunci se numește legătură de hidrogen intermoleculară. Pentru o astfel de legătură, o moleculă trebuie să aibă un hidrogen parțial pozitiv ca atom acceptor și alta trebuie să aibă un atom parțial negativ sau donor. De exemplu, legătura de hidrogen între aldehidă și molecula de apă este prezentată mai jos:
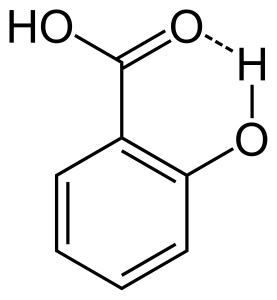
2. Legătura de hidrogen intramoleculară
Când legătura de hidrogen are loc între doi atomi parțial încărcați din aceeași moleculă, aceasta se numește legătură de hidrogen intramoleculară. Aceasta apare atunci când două grupe funcționale sunt prezente în aceeași moleculă și sunt în așa fel încât se pot atrage reciproc pentru a forma o legătură de hidrogen. De exemplu, acidul salicilic are două grupe funcționale: alcool și acid carboxilic. Aici legătura de hidrogen intramoleculară are loc între atomul de hidrogen al grupei alcool și atomul de oxigen al grupei acid carboxilic.
Efectele legăturii de hidrogen
Supra punctului de fierbere
Este de așteptat ca punctul de fierbere al substanțelor cu greutate moleculară identică sau similară să aibă un punct de fierbere identic sau similar. Punctul de fierbere al eterului și al alcanului cu greutate moleculară similară nu sunt foarte îndepărtate. Dar punctul de fierbere al alcoolilor este mult mai mare decât cel al eterului cu greutate moleculară similară. Acest lucru poate fi explicat prin prisma legăturilor de hidrogen. Din cauza legăturilor de hidrogen din alcool, punctul de fierbere crește. Este nevoie de energie suplimentară pentru a rupe legătura de hidrogen înainte de fierbere. Deoarece nu există legături de hidrogen, alcanii și eterul au un punct de fierbere scăzut.

Despre solubilitate
Alcoolii sunt solubili în apă, dar alcanii nu sunt. Acest lucru se datorează faptului că, compușii cu legături de hidrogen intermoleculare se pot dizolva în solventul cu legături de hidrogen intermoleculare. O moleculă polară, cum ar fi alcoolul, poate intra în două molecule de apă pentru a forma o legătură de hidrogen, în timp ce o substanță nepolară, cum ar fi alcanii, nu poate. Cu toate acestea, odată cu creșterea lanțului de carbon din alcooli, solubilitatea scade, deoarece lanțul lung împiedică formarea legăturii de hidrogen.
Rezumat
- Legătura de hidrogen este o forță de atracție între un hidrogen parțial încărcat pozitiv și un atom parțial încărcat negativ.
- Când legătura de hidrogen are loc între atomii unei molecule diferite, atunci se numește legătură de hidrogen intermoleculară.
- Când legătura de hidrogen apare între doi atomi parțial încărcați ai aceleiași molecule atunci se numește legătură de hidrogen intramoleculară.
- Din cauza legăturii de hidrogen intermoleculare punctul de fierbere al compușilor polari este mai mare decât al compușilor nepolari cu același a.
- Din cauza legăturii de hidrogen dintre compusul organic și apă, solubilitatea este posibilă într-o anumită măsură.
.