La Exelead, abordăm producția prin contract cu o expertiză concentrată asupra formulărilor lipozomale și PEGilate pentru tratarea bolilor rare și a populațiilor mici sau insuficient deservite. Suntem specializați în dezvoltarea și fabricarea de produse medicamentoase parenterale pe bază de lipide, iar echipa noastră are o experiență de peste 20 de ani de lucru cu o gamă largă de clienți de fabricație contractuală preclinică, clinică și comercială.
Ce sunt lipozomii și cum sunt utilizați în eliberarea medicamentelor?
Lipozomii sunt vehicule de livrare specializate care îndeplinesc mai multe roluri în îmbunătățirea capacităților ingredientelor farmaceutice active (API). În primul rând, ei pot proteja un medicament de detectarea de către sistemul imunitar al organismului, imitând membranele biologice și oferind medicamentului mai mult timp pentru a ajunge la destinația sa. În al doilea rând, ei servesc pentru a ajuta la solubilizarea moleculelor de medicamente foarte lipofile sau pentru a modula farmacocinetica și biodistribuția API – contribuind astfel la minimizarea efectelor secundare și la îmbunătățirea profilului de siguranță al produsului.
Lipozomii posedă o structură veziculară unică. Aceste vezicule sunt compuse dintr-un bistrat lipidic care se formează sub forma unei sfere goale care înglobează o fază apoasă. Ca atare, orice încărcătură de interes poate fi încapsulată în lipozomi, fie în compartimentul apos (dacă este solubilă în apă/hidrofilă), fie în interiorul stratului bistratificat lipidic (dacă este solubilă în grăsimi/lipofilă).
Câteva dintre lipidele primare utilizate pentru fabricarea lipozomilor sunt fosfolipidele și sfingolipidele. Aceste două categorii de lipide sunt unice în ceea ce privește o grupare de cap care este iubitoare de apă/hidrofilă și o grupare de coadă care urăște apa/lipofilă. Datorită naturii lor amfifile, aceste molecule se autoasamblează în mod spontan pentru a forma lipozomi și alte structuri 3D unice atunci când sunt adăugate în soluții apoase. Forma sau morfologia structurilor 3D depinde de o varietate de factori diferiți – de exemplu, compoziția lipidică, temperatura, pH-ul sau prezența altor tampoane, săruri și zaharuri în apă.

Sursa imaginii: Chem Libre Texts
Cum interacționează un medicament cu organismul și cum devine disponibil pentru utilizare atunci când este formulat ca produs medicamentos lipozomal?
În ultimii ani, lipozomii au atras o atenție semnificativă ca o clasă de încredere de vehicule de livrare a medicamentelor. Structurile lor autoînchise pot încapsula mai multe medicamente deodată, protejând încărcătura închisă de hidroliză și descompunere. În plus, proteinele de direcționare și liganzii funcționali de suprafață de pe învelișul exterior al stratului bistrat lipidic pot adăuga o funcționalitate nouă – permițând intrarea țintită a lipozomilor în celule, fie prin intermediul anticorpilor, fie al liganzilor direcționați către receptori. Acești liganzi se atașează la receptorii celulari care sunt supraexprimați în anumite celule bolnave, permițând intrarea medicamentului prin membrana celulară.
„Lipozomii protejează moleculele de medicament încărcate de degradarea externă, iar similitudinea lor cu membranele biologice oferă oportunități unice de a livra molecule de medicament în celule sau compartimente subcelulare … În plus, diverse proprietăți fizico-chimice ale lipozomilor – inclusiv dimensiunea, sarcina și liganzii funcționali de suprafață – pot fi modificate, rezultând funcționalități care favorizează sarcini specifice de eliberare a medicamentelor. Aceste avantaje au făcut din lipozomi o platformă principală de eliberare a medicamentelor, cu o gamă largă de utilizări în clinică.”
– Nanostructuri asemănătoare lipozomilor pentru eliberarea medicamentelor | Gao W, Hu C-MJ, Fang RH, Zhang L 1
În mod obișnuit, lipozomii sunt fabricați sub formă de injectabile sterile pentru a fi livrați în fluxul sanguin, iar eliberarea medicamentului are loc atunci când învelișurile lipidice se descompun – ceea ce se poate întâmpla în medii extracelulare sau intracelulare.
Au fost utilizate diverse strategii pentru a proiecta lipozomi convenționali cu capacități de eliberare declanșată, sporind eficacitatea terapeutică prin determinarea lipozomilor să elibereze API-ul încapsulat sau „încărcătura” pe baza unui răspuns la un stimul. Această eliberare este determinată fie de descompunerea convențională a lipozomilor, fie este determinată de stimuli activi și de indicii de mediu, inclusiv energia termică, gradientul de pH și stresul de forfecare.1
Formulațiile orientate spre eliberarea în medii intracelulare pot include lipide sensibile la pH care modifică structura lipozomală sau se degradează în compartimentele acide, permițând eliberarea medicamentului încapsulat. Alternativ, se includ uneori componente termosensibile sau fotosensibile pentru a permite degradarea și modularea structurii ca urmare a schimbărilor de temperatură sau a reacției la lumina cu anumite lungimi de undă.
Transportorii de medicamente de tip lipozom pot fi de mai multe feluri, prezentând o gamă largă de proprietăți biochimice și biofizice. Deși acest lucru este avantajos și permite acestor particule pe bază de lipide să își asume aplicații utile în sute de contexte diferite, numărul de variații potențiale face imperativ un control riguros al fabricației.2
Exelead produce medicamente pe bază de lipide încă de la începutul anilor 1990, începând cu Abelcet. Amfotericina B, ingredientul activ din Abelcet, este reținut într-un complex lipidic și fuzionează selectiv cu membranele fungice pentru a ținti celulele bolnave.
Lipozomi vs. nanoparticule lipidice
Lipozomii și nanoparticulele lipidice (LNP) sunt similare prin design, dar ușor diferite în ceea ce privește compoziția și funcția. Ambele sunt nanoformulații lipidice și vehicule excelente de livrare a medicamentelor, transportând încărcătura de interes în interiorul unui strat protector, exterior, de lipide. Cu toate acestea, în aplicații, LNP-urile pot lua o varietate de forme.
LNPs sunt structuri asemănătoare lipozomilor orientate în special spre încapsularea unei largi varietăți de acizi nucleici (ARN și ADN); și, ca atare, sunt cel mai popular sistem non-viral de livrare de gene. Exelead dezvoltă și produce LNP-uri pentru a încapsula diferite tipuri de încărcături genetice utile, inclusiv ARNi, ARNm și ARNa.
Lipozomii tradiționali includ unul sau mai multe inele de bistrat lipidic care înconjoară un buzunar apos, dar nu toate LNP-urile au un bistrat contiguu care să le califice drept vezicule lipidice sau lipozomi. Unele LNP presupun o structură de tip micelă, încapsulând moleculele de medicament într-un miez neacvatic.
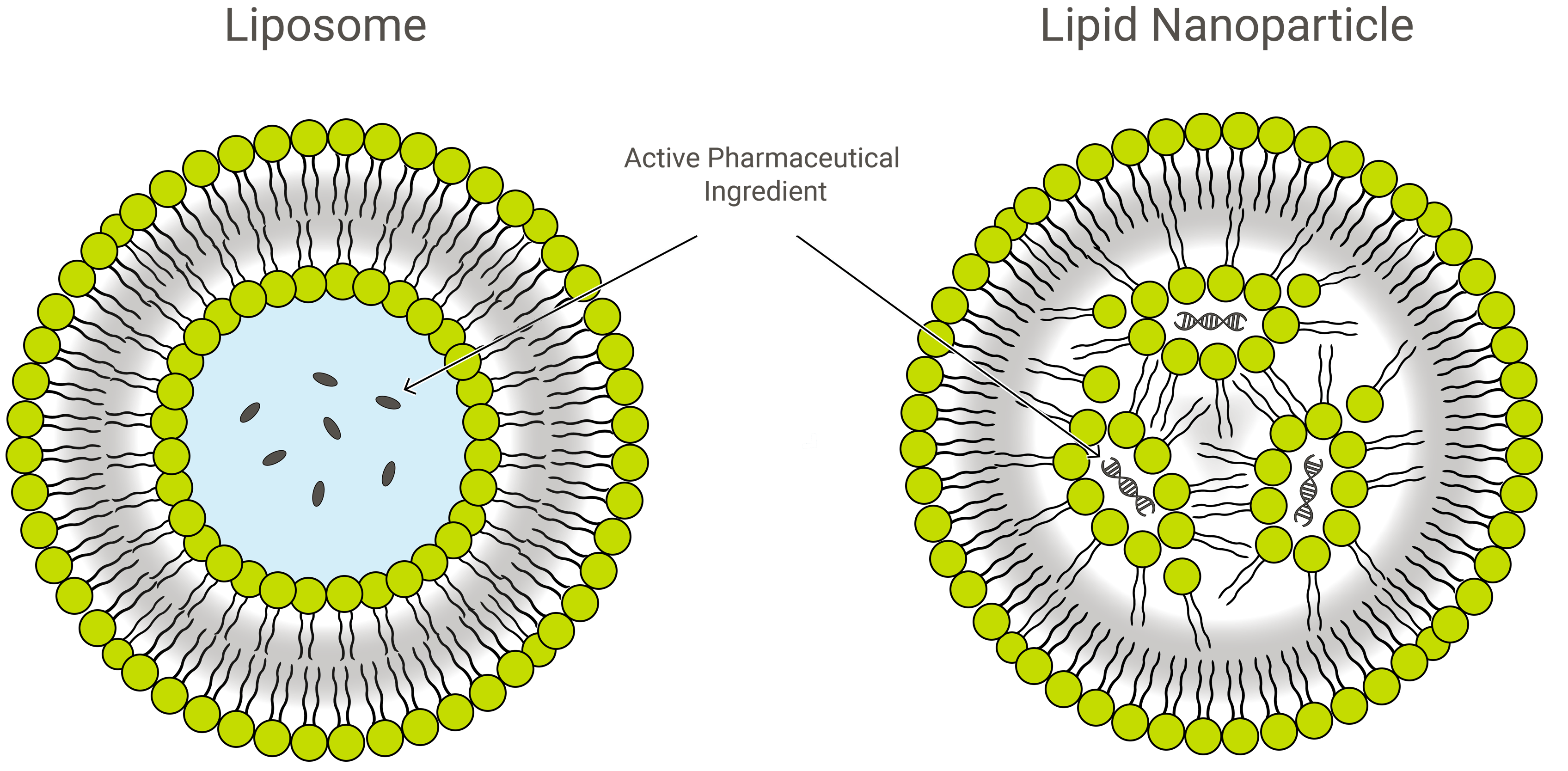
PEGilarea LNP și a structurilor de eliberare a medicamentelor de tip lipozom
LNP sunt compuse în principal din lipide cationice (a se vedea terapia genică de mai jos) împreună cu alte ingrediente lipidice. Acestea includ de obicei molecule de fosfolipide neutre aparținând clasei fosfatidilcolinei (PC) și steroli, cum ar fi colesterolul. Un alt ingredient lipidic comun este ceea ce este cunoscut sub numele de fosfolipide PEGilate – un polimer de polietilenglicol (PEG) atașat covalent la grupa de cap a unei fosfolipide.

Fosfolipidele PEGilate sunt utilizate în mulți purtători de medicamente pe bază de lipide în primul rând pentru că oferă ceea ce este cunoscut sub numele de efect invizibil produsului medicamentos în timp ce acesta circulă în organism. Sistemul imunitar uman este determinat să protejeze organismul de orice obiect străin, iar nanoparticulele medicinale nu fac excepție. Pentru a ajuta la eficiența administrării și pentru a permite mai mult timp de circulație pentru ca moleculele de încărcătură să ajungă la locurile destinate bolilor, se adaugă PEG pentru a proteja aceste nanoparticule, împiedicând proteinele din plasma sanguină să fie absorbite de suprafața lipozomilor, mărind durata de viață a circulației în sânge.1
Al doilea beneficiu al PEGilării este creșterea stabilității pentru nanostructurile de tip lipozom. Lipozomii convenționali, în special cei cu dimensiuni mai mici de 200 nm, pot fi instabili pe cont propriu și au tendința de a fuziona între ei pentru a reduce tensiunea de suprafață. Acest lucru poate duce la pierderea medicamentului încapsulat sau la amestecarea nefavorabilă a încărcăturii diferitelor vezicule. O modalitate prin care producătorii de medicamente au învățat să depășească această problemă este acoperirea exteriorului lipozomilor cu polimeri precum PEG.
Aceste nanoparticule echipate invizibil au dus la o nouă generație de formulări lipozomale și la multiple produse aprobate clinic. Lipozomii PEGilați și LNP-urile reprezintă în prezent noua paradigmă pentru majoritatea terapiilor împotriva cancerului.
LNP-urile în terapia genică
Pentru o lungă perioadă de timp, cel mai eficient mod de a livra terapii pe bază de gene în celulele umane a fost utilizarea unui virus care a fost modificat pentru a transporta încărcătura medicinală, mai degrabă decât gene dăunătoare, care se auto-replică. Această metodă este încă folosită ocazional și astăzi și este denumită livrare virală de gene. Cu toate acestea, administrarea de gene non-virale a devenit populară în ultimii 20 de ani datorită profilurilor de siguranță îmbunătățite, a ratelor mai mici de reacții adverse imunogene și a ușurinței de fabricație. Unul dintre principalii factori determinanți ai acestei mișcări a fost dezvoltarea de purtători pe bază de lipide și polimeri, dintre care PNL-urile sunt cele mai populare.
LNPs utilizate pentru livrarea de gene sunt în principal sintetizate folosind lipide cationice, sau încărcate pozitiv, care se asociază cu acizi nucleici anionici, sau încărcați negativ. Se pot adăuga, de asemenea, alte componente pe bază de lipide pentru a modula eficiența livrării și eliberarea în locație a încărcăturii genetice. LNP-urile oferă, de asemenea, stabilitate mecanică, morfologie controlată și distribuție îngustă a dimensiunilor.1
Materialele anorganice, materialele organice și hidrogelurile au fost fiecare explorate ca nuclee pentru nanoparticulele lipozomale, încapsulate în interiorul unui număr variabil de straturi lipidice care formează învelișul. Una dintre cele mai reușite variante ale acestor nanoparticule hibride încorporează polimeri PLA sau PGLA în cadrul unui monostrat lipidic. Acești doi biopolimeri de bază sunt deosebit de utili în eliberarea de medicamente, deoarece facilitează eliberarea controlată a medicamentelor.1

Formulația de nanoparticule prezentată mai sus este un hibrid lipidic-polimeric cu un miez hidrofob de PGLA și un înveliș hidrofil de lipide-PEG.
Un domeniu în expansiune
„Lipozomii au parcurs un drum lung pentru a deveni o clasă de purtători de medicamente validați … O varietate din ce în ce mai mare de nanostructuri asemănătoare lipozomilor sunt în curs de dezvoltare, fiecare cu forțe unice potrivite pentru sarcini specifice de eliberare a medicamentelor. Între timp, înțelegerea interacțiunilor dintre aceste nanostructuri și sistemele biologice progresează rapid. A fost obținută o cantitate substanțială de informații privind timpul de circulație, acumularea în țesuturi și potențiala toxicitate a acestora. Este cert că nanocarrierii de tip lipozom vor juca un rol mai mare pentru eliberarea de medicamente în viitorul apropiat.”
– Nanostructuri de tip lipozom pentru eliberarea de medicamente | Gao W, Hu C-MJ, Fang RH, Zhang L 1
În timp ce există o activitate semnificativă în curs de desfășurare în dezvoltarea de agenți medicinali cu eliberare controlată, nanocompartimentați, lipozomii și LNP-urile sunt opțiuni deosebit de promițătoare. Aceste structuri oferă o morfologie unică, stabilă în mod natural, asemănătoare celulelor, pentru nanomedicamente și sunt pregătite să progreseze către strategii terapeutice mai avansate. Exelead își asumă astfel de provocări, inclusiv dezvoltarea de nanogeluri care încorporează o serie de substanțe biologice și molecule mici.
De când lipozomii au fost propuși pentru prima dată ca sistem de eliberare a medicamentelor, la sfârșitul anilor 1960, au apărut variații în structură și funcționalitate, oferind progrese valoroase în ceea ce privește direcționarea bolilor. Medicamentele LNP au apărut în întreaga industrie farmaceutică ca terapii concepute pentru a livra agenți anticancerigeni, antibiotice, medicamente genetice, anestezice și medicamente antiinflamatorii.3
„În aplicațiile clinice, medicamentele lipozomale s-au dovedit a fi cele mai utile pentru capacitatea lor de a se acumula „pasiv” în locurile cu permeabilitate crescută a vaselor, atunci când diametrul lor mediu se află în intervalul ultrafiltrabil (<200 nm în diametru), și pentru capacitatea lor de a reduce efectele secundare ale medicamentelor încapsulate în raport cu medicamentele libere. Acest lucru a dus la o creștere generală a indicelui terapeutic, care măsoară eficacitatea în raport cu toxicitatea.”
– Sisteme lipozomale de eliberare a medicamentelor: de la concept la aplicații clinice | Allen TM, Cullis PR 3
Aplicații în medicina personalizată – o nouă eră în strategiile terapeutice
În contrast cu abordările tradiționale, de tip big-pharma, pentru tratamentul bolilor, medicina personalizată ia în considerare diferențele individuale în ceea ce privește stilul de viață, mediul și biologia – inclusiv genetica pacientului.
Acest lucru este extrem de aplicabil pentru boli precum cancerul. Chiar și în cadrul unui singur tip de cancer, tipurile de tumori diferă de la un pacient la altul, iar înțelegerea mutației genetice specifice pe care a dezvoltat-o un pacient le permite medicilor să utilizeze tratamente mai specifice și mai precise.4
Cu apariția terapiilor genetice personalizate, medicii și oamenii de știință pot adapta în mod eficient un ingredient farmaceutic activ – adesea ARN sau ADN – pentru a se potrivi profilului specific de boală al unui anumit pacient sau al unui grup mic de pacienți. Această abordare a țintirii hiper-specifice a bolii crește eficacitatea și diminuează efectele secundare nedorite pentru grupuri de pacienți similari.
LNPs ca vehicule de livrare pentru oligonucleotide
Pentru că o mare parte din domeniul în creștere al medicinei personalizate se concentrează pe terapiile genetice, LNPs au devenit deosebit de utile ca platformă de livrare a medicamentelor. Orice oligonucleotid ar putea fi teoretic încapsulat în cadrul unui lipozom sau LNP, dar siARN-urile sunt în prezent cea mai comună încărcătură în aceste tipuri de produse medicamentoase.
În teorie, segmentele de siARN pot fi concepute pentru a reduce la tăcere orice genă, ceea ce reprezintă un concept interesant atât pentru medici, cât și pentru cercetători. Din nefericire, livrarea ARN-ului liber, neîncapsulat, în celulele umane este dificilă, deoarece acestea sunt mari, instabile în ser și predispuse la degradarea nucleazei.5
În timp ce cercetătorii au făcut încercări de a stabiliza siARN-ul în ser prin adăugarea de legături fosforotiolate, sunt necesare doze mari pentru a reduce efectiv la tăcere genele la om. PNL-urile au oferit o soluție la această problemă, oferind mijloace flexibile și ușoare de încapsulare, protejând segmentele de siARN până când acestea ajung la destinația dorită și facilitând livrarea lor în celulele țintă.5
„PNL-urile care conțin lipide cationice ionizabile au o serie de caracteristici necesare pentru livrarea sistemică a acizilor polinucleici, inclusiv dimensiuni mici, stabilitate serică, potențiale zeta de suprafață scăzute la pH fiziologic și sarcină cationică la valori acide ale pH-ului (de exemplu, în endosomi). Mai mult, profitând de procesele de direcționare „endogene” datorate asocierii cu ApoE în urma administrării, se poate obține o absorbție foarte eficientă în hepatocite în urma administrării i.v., ceea ce duce la capacități excelente de reducere la tăcere a genelor.”
– Sisteme de eliberare a nanoparticulelor lipidice pentru produse terapeutice pe bază de siARN | Wan C, Allen TM, Cullis PR 5
Dimensiuni mai mici ale loturilor
Produsele medicamentoase personalizate sunt adesea fabricate în loturi de dimensiuni mici pentru un singur pacient sau pentru populații mici și pot rezulta frecvent în mai puțin de un litru de produs. În schimb, loturile de fabricație tradiționale pentru produsele farmaceutice obișnuite produc adesea mii de litri de produs medicamentos la scară largă. Medicina personalizată necesită o abordare unică, iar fiecare lot trebuie să fie fabricat în condiții cGMP stricte.
Cum medicina personalizată a devenit un punct de interes proeminent în dezvoltarea medicamentelor, multe companii din industria de producție farmaceutică și-au adaptat produsele pentru a se adapta la loturi mai mici programate pentru grupuri mici de pacienți, pe lângă producția tradițională de medicamente la scară largă.
La Exelead, s-au depus eforturi ample pentru a se adapta la aceste produse terapeutice în loturi mici, care necesită adesea API costisitoare și un timp de execuție rapid. Medicamentele specifice pacientului sau antigenului nu lasă mult timp din momentul în care oligonucleotidul este secvențiat până în momentul în care produsul trebuie să fie formulat la noi. Aceste previziuni pe termen scurt, uneori de numai șase săptămâni, prezintă provocări pe care am reușit să le depășim prin perfecționarea sistemelor noastre existente și prin încorporarea unor tehnici inovatoare de formulare.
Aplicații pe scară largă
În timp ce medicina personalizată are potențialul de a trata aproape orice boală, cercetările actuale s-au axat în principal pe 1) imunoterapii, 2) terapii convenționale augmentate prin intermediul farmacogenomicii și 3) tratamente pentru cancer legate de biomarkerii. Lipozomii și PNL-urile au aplicații ca vehicule de livrare pentru fiecare dintre aceste categorii de produse medicamentoase, ceea ce le face un atu indispensabil în acest nou domeniu al dezvoltării farmaceutice.

Articole de referință
- Gao W, Hu C-MJ, Fang RH, Zhang L. Liposome-like Nanostructures for Drug Delivery. Journal of materials chemistry B, Materials for biology and medicine (Jurnalul de chimie a materialelor B, Materiale pentru biologie și medicină). 2013;1(48):10.1039/C3TB21238F. doi:10.1039/C3TB21238F.
- Kraft JC, Freeling JP, Wang Z, Ho RJY. Emerging Research and Clinical Development Trends of Liposome and Lipid Nanoparticle Drug Delivery Systems. Jurnalul de științe farmaceutice. 2014;103(1):29-52. doi:10.1002/jps.23773.
- Theresa M. Allen, Pieter R. Cullis. Liposomal drug delivery systems: De la concept la aplicații clinice. Advanced Drug Delivery Reviews. 2013 Jan;65(1):36-48
- Esposito L. What Does Personalized Medicine Really Mean? US News: Health Care. 2018 Jan;
- Wan C, Allen TM, Cullis PR. Sisteme de livrare a nanoparticulelor lipidice pentru terapiile bazate pe siRNA. Drug Deliv Transl Res. 2014 Feb;4(1):74-83. doi: 10.1007/s13346-013-0161-z.
- Vogenberg FR, Isaacson Barash C, Pursel M. Personalized Medicine: Part 1: Evolution and Development into Theranostics. Farmacie și terapeutică. 2010;35(10):560-576.