Introducere
Imunofluorescența (IF) utilizează anticorpi și detecția fluorescentă pentru a studia localizarea, expresia relativă și stările de activare a proteinelor țintă în celule sau țesuturi fixate. IF este utilizată pe scară largă în diverse domenii de studiu.
IF poate fi utilizată pentru a răspunde la întrebări precum:
- Ce celule sau țesuturi exprimă proteina (proteinele) mea (mele) țintă?
- Cum se modifică expresia și/sau activarea proteinei mele țintă ca răspuns la perturbări experimentale?
- În ce parte a celulei/țesutului este localizată proteina-țintă?
- Care este relația spațială dintre diferitele proteine-țintă în contextul arhitecturii celulare sau tisulare?
Imunofluorescența cuprinde o serie de tehnici conexe care au evoluat de-a lungul timpului. Toate aceste tehnici valorifică recunoașterea specifică a țintelor biologice de către anticorpi și detectarea reportofoanelor fluorescente în analiza citometrică. Asigurarea faptului că proba biologică este bine conservată în timp ce antigenele țintă sunt accesibile anticorpilor este importantă, dar poate prezenta provocări care variază în funcție de probă, țintă și anticorp.
În această pagină, am compilat resurse pentru a vă ajuta să navigați prin protocoale, să răspundeți la întrebări frecvente și să vă ajutați să proiectați experimente IF de succes.
Alegerea tehnicii și protocolului IF potrivit
Tehnica/protocolul IF optim este influențat de tipul de material biologic, de etapele de procesare a probei, de proprietățile antigenului țintă și de anticorpul special utilizat.
Considerările includ:
- Materialele de intrare pot fi linii celulare cultivate, țesuturi congelate sau țesuturi fixate în formalină și incluse în parafină (FFPE).
- Pentru liniile celulare cultivate și celulele primare, căutați anticorpi validați pentru imunofluorescență-imunocitochimie (IF-IC).
- În multe laboratoare, „imunohistochimie/IHC” este folosit ca un termen general pentru a include țesut care este fie încorporat în parafină, fie congelat, și poate fi folosit pentru a include atât detecția cromogenică, cât și cea fluorescentă. Pe cellsignal.com, aplicațiile diferențiază între preparatele de țesut congelate (IF-F) și cele încorporate în parafină.
- Pentru probele de țesut FFPE, anticorpii validați pentru imunohistochimie (IHC-P) pot fi, de asemenea, utilizați cu detecție fluorescentă fără amplificare, dacă antigenul țintă este abundent, sau în IHC multiplexat (mIHC) cu amplificare a semnalului.
- Un anticorp poate fi validat pentru una sau mai multe dintre aplicațiile enumerate mai sus. Recomandările de protocol sunt rezultatul testării de către oamenii de știință în timpul procesului de validare.
- Protocoalele specifice produsului pot fi găsite pe pagina web a fiecărui produs. Pentru anticorpii validați IF, selectați „IF” pe pagina produsului pentru a vizualiza datele și protocolul de validare IF. Informațiile de bază (diluții/concentrația de lucru, aplicații validate, reactivitatea speciilor, specii gazdă) pentru fiecare anticorp sunt incluse în fișa tehnică a produsului.
- Protocoalele IF cel mai frecvent utilizate pot fi găsite, de asemenea, pe pagina de protocol.
- Nu aveți nevoie sau nu doriți să utilizați detecția prin fluorescență pentru probele dvs. de țesut? O abordare alternativă este detecția cromogenică, abordată pe pagina IHC.
Salegerea anticorpilor pentru IF: importanța validării anticorpilor
Cei mai buni anticorpi produc un semnal puternic, specific, cu un fond minim. Este important să alegeți anticorpi care au fost validați în aplicația pe care o veți utiliza. Validarea anticorpilor în IF poate include experimente de expresie pozitivă și negativă (folosind linii celulare knockout, modele genetice, CRISPR sau RNAi), manipularea experimentală a localizării proteinei țintă sau a modificărilor post-translaționale și optimizarea protocolului.
Performanța unui anticorp variază în funcție de aplicație. Un anticorp care se comportă bine într-un experiment de Western Blot, de exemplu, poate sau nu se poate comporta în IF. În timpul testării noilor anticorpi, unii vor prezenta o legare minoră în afara țintei; aceștia nu sunt niciodată recomandați pentru IF sau alte aplicații non-WB. În plus, un anticorp poate funcționa bine pe țesut congelat, dar nu și pe țesut FFPE, sau invers. Sensibilitatea și performanța anticorpilor se poate schimba în funcție de modul în care proba este fixată și procesată și de condițiile de lucru ale anticorpilor.
După ce ați decis ce tip de probe biologice să folosiți în experimentul dvs. și cum vor fi pregătite, cel mai simplu mod de a răsfoi anticorpii pe cellsignal.com este de a selecta mai întâi aplicația corespunzătoare. Apoi, puteți introduce termeni de căutare sau puteți selecta alte atribute (cum ar fi specia gazdă, domeniul de cercetare și altele) pentru a vă rafina și mai mult căutarea și pentru a selecta un anticorp care a fost validat în aplicația de care aveți nevoie.
Proiectarea experimentelor de control pentru IF
Pentru a fi încrezător în designul și rezultatele experimentale și pentru a fi sigur că anticorpul dumneavoastră raportează cu fidelitate ținta sa, experimentele de control pozitiv și negativ pot fi informative. De exemplu:
- Controalele numai secundare vă pot spune dacă există o legare nespecifică a anticorpului secundar.
- Confirmați specificitatea unui anticorp primar prin proiectarea experimentelor Knockout/siRNA sau prin compararea liniilor celulare cunoscute care exprimă și cele care nu exprimă.
- Experimentele cu o singură țintă sunt utilizate în configurarea imagisticii de neamestec spectral. Acest tip de experiment poate ajuta la determinarea dacă o lipsă de colorare se datorează împiedicării sterice care apare atunci când 2 antigeni se află în imediata apropiere unul de celălalt.
- Tratați probele cu fosfatază pentru a confirma că anticorpii fosfo-specifici recunosc doar ținta fosforilată în IF.
- Dacă suspectați probleme cu fixarea sau permeabilizarea, verificarea cu un anticorp care a funcționat pentru laboratorul dvs. în trecut poate fi utilă pentru depanare.
Specialiștii de la Cell Signaling Technology (CST) efectuează în mod obișnuit aceste tipuri de controale ca parte a procesului nostru de validare (a se vedea un exemplu). Poate fi util să stabiliți controale similare în sistemul dvs. experimental model, în special dacă întâmpinați dificultăți în obținerea rezultatelor dorite.
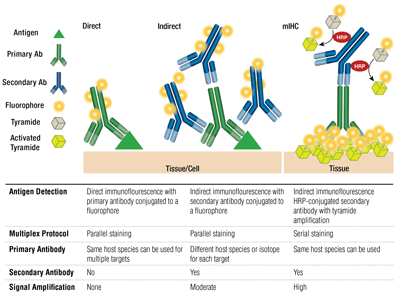
Anticorpi primari vs. secundari și colorare directă vs. indirectă
Anticorpii primari asigură recunoașterea specifică a antigenului țintă. Anticorpii secundari se leagă de anticorpii primari în funcție de specia în care au fost crescuți. Anticorpii primari care au fost crescuți la iepure sau la șoarece se pretează la detectarea cu anticorpi secundari anti-iepure, respectiv anti-șoarece.
Încrucișarea unui anticorp primar și a unui anticorp secundar (specific pentru specia gazdă a primarului) care este conjugat cu un fluorofor este cunoscută sub denumirea de colorare indirectă. Utilizarea anticorpilor primari conjugați cu fluorofori, fără anticorpi secundari, este cunoscută sub denumirea de colorare directă. Metodele de colorare directă economisesc timp și permit multiplexarea folosind anticorpi crescuți în aceeași specie gazdă. Colorarea indirectă oferă în mod tradițional o sensibilitate mai mare datorită amplificării semnalului care are loc atunci când mai mulți anticorpi secundari se leagă de un singur anticorp primar.
Există și alte variații ale acestor tehnici, cum ar fi utilizarea anticorpilor primari biotinilați cu fluorocromi conjugați cu avidină/streptavidină. Fragmentele de anticorpi secundari F(ab’)2 conjugate cu fluorofori (lipsite de domeniul Fc) pot ajuta la reducerea fondului. În mIHC, anticorpii secundari conjugați cu peroxidază de hrean (HRP) sunt folosiți pentru a cataliza depunerea conjugatelor tiramidă-fluorofor.
Selectarea anticorpilor fluorofori
Selectarea anticorpilor fluorofori
Câte ținte/anticorpi pot fi multiplexate?
Multiplexarea utilizează detectarea a mai mult de o țintă la un moment dat prin intermediul mai multor anticorpi și detectarea unor lungimi de undă (culori) diferite pentru fiecare țintă. Pentru colorarea indirectă, capacitatea de multiplexare se bazează pe împerecherea anticorpilor secundari conjugați cu fluorofori, specifici fiecărei specii, cu fiecare anticorp primar. Anticorpii de șoarece din izotipuri distincte pot fi, de asemenea, multiplexați cu ajutorul secundarilor specifici pentru izotipuri, permițând detectarea a până la 5 anticorpi de șoarece în același timp. Pentru colorarea directă, fiecare anticorp primar trebuie să fie cuplat la un fluorofor diferit. Acest lucru permite combinarea mai multor anticorpi din aceeași specie/izotip și permite, de asemenea, colorarea „șoarece pe șoarece”, deoarece legarea nespecifică a secundarilor anti-șoarece la țesutul de șoarece nu reprezintă o problemă.
Când se proiectează experimentele de IF multiplex, trebuie să se ia în considerare caracteristicile spectrale ale microscopului cu fluorescență, inclusiv sursele de excitație disponibile și seturile de filtrare, pentru a evita pierderile spectrale. Microscoapele moderne cu fluorescență epifluorescentă și confocală au, de obicei, capacitatea de a distinge 3 sau mai multe canale.
Combinarea colorării anticorpilor cu coloranți sau etichete
Corpii celulari care sunt aplicați după fixare sau etichetele fixabile ale celulelor vii pot fi încorporate într-un flux de lucru IF. Marcarea organitelor este adesea utilizată pentru a verifica localizarea subcelulară a unei ținte. Etichetele exprimate, cum ar fi GFP, sunt adesea utilizate pentru a urmări celulele transfectate sau în experimentele mozaic; dacă semnalul de fluorescență GFP este scăzut, se poate utiliza un anticorp anti-GFP în IF. Folosirea coloranților sau a proteinelor fluorescente va ocupa canalele de fluorescență, lăsând mai puține disponibile pentru anticorpi.
Scoaterea fluoroforilor pentru experimentul dumneavoastră
Acest lucru va depinde de caracteristicile spectrale ale sursei de excitație și de filtrarea excitației/emisiunii de care dispuneți. Evaluați profilul de excitație și de emisie al fluoroforului înainte de a vă desfășura experimentul pentru a evita sângerarea fluorescenței. CST oferă o varietate de anticorpi primari și secundari conjugați cu fluorofori, inclusiv coloranți din linia Alexa Fluor®.
Prepararea probelor
Tesut
Secțiunile de țesut pot fi pregătite fie prin congelare rapidă în mediu cu temperatură optimă de tăiere (OCT), fie prin fixare și încorporare în parafină. Probele congelate pot fi secționate cu ajutorul unui criostat și se lasă să se usuce la aer pe lamă între 10 și 15 minute înainte de fixare, înainte de următoarea etapă. Pentru probele de țesut FFPE, cerințele pentru etapele de recoltare, fixare și încorporare în parafină pot varia în funcție de fiecare tip de țesut în parte.
Tesut congelat vs. țesut FFPE
În general, țesutul FFPE oferă o morfologie mai bună decât țesutul congelat încorporat în OCT. Acest lucru poate face mai ușoară cuantificarea celulelor pozitive sau identificarea limitelor dintre pete. Țesutul FFPE este, de asemenea, foarte stabil; odată încorporate, blocurile de țesut pot fi păstrate timp de ani de zile. Acest tip de țesut este, de asemenea, mai ușor de expediat între laboratoare și este metoda de procesare preferată pentru probele de patologie umană.
Pe de altă parte, țesutul FFPE trece prin mai multe etape suplimentare de procesare care reduc cantitatea totală de antigen din cauza degradării proteinelor, necesită etape de demascare pentru a detecta antigenul rămas și exacerbează autofluorescența indusă de aldehide. Cu excepția cazului în care se lucrează cu o proteină foarte abundentă, antigenul rămas poate fi dificil de detectat prin IF indirectă și poate necesita amplificare pentru a obține o colorație adecvată. Este, de asemenea, posibil ca recuperarea antigenului să demascheze antigene care nu ar fi detectate în mod normal, iar un anticorp care, în mod normal, dă modelul de colorare așteptat, poate da o colorare nespecifică. Este la fel de posibil să se lucreze cu o țintă în cazul în care este necesară o metodă specifică de recuperare a antigenului pentru a detecta epitopul țintă. Prin urmare, este important să se ia în considerare modul în care un anticorp este validat și ce etape sunt necesare pentru a-l utiliza.
În cazul țesutului congelat încorporat în OCT, reducerea procesării este prioritară față de morfologie. Aceasta este cea mai rapidă metodă de a obține rezultate de imunomarcație, deoarece lamelele sunt gata de utilizare în momentul în care țesutul este tăiat și există mai puține etape de procesare înainte de încorporare. Există mai puțină degradare a proteinelor și mai mult antigen este disponibil pentru a se lega de anticorpi, fără a fi nevoie de etape suplimentare și dure de prelevare. Deoarece această metodă nu necesită amplificare, este mai sensibilă la calitatea țesutului. Tipul de fixare (alcool vs. aldehidă), durata (unele obiective, cum ar fi factorii de transcripție, necesită un timp de fixare mai scurt) și vârsta țesutului (în special după secționare) sunt toate importante și variază în funcție de obiectiv. În cele din urmă, lucrul cu țesut congelat oferă mai multă flexibilitate în selectarea țintei, deoarece procesarea poate avea loc după secționare, permițând o mai mare personalizare în proiectarea analizelor.
Celule cultivate
Celele trebuie să fie însămânțate pe un material suport compatibil cu microscopia de fluorescență. Suporturile tipice includ vase de cultură celulară cu fund de sticlă, lamele de sticlă (păstrate în vase de cultură din plastic) pregătite cu polilizină și/sau componente ale matricei extracelulare pentru a susține cultura celulară aderentă și camere cu mai multe puțuri disponibile în comerț, montate pe lamele de sticlă care sunt compatibile cu microscoapele.
Atenție: condițiile de cultură celulară pot afecta sănătatea celulelor, morfologia și expresia/localizarea proteinei țintă și, în cele din urmă, pot dicta calitatea datelor IF. Asigurați-vă că celulele dvs. sunt sănătoase prin verificarea regulată a mediilor de cultură pentru modificări de pH și inspectarea semnelor de stres celular (cum ar fi celulele multinucleate) la o mărire mică la microscop. De asemenea, verificați dacă confluența celulelor este corespunzătoare tipului de celule și țintei.
Fixarea probelor
Fixatorul ideal păstrează o imagine „ca în viață”, în timp ce oprește rapid procesul de degradare al autolizei prin reticulare și inhibarea enzimelor endogene, și prezintă antigenul pentru recunoașterea de către anticorp. Din păcate, nu există o singură metodă de fixare care să funcționeze în mod ideal pe fiecare probă și pentru fiecare antigen. Chiar și antigene diferite de pe aceeași proteină țintă pot prezenta diferențe între protocoale. Acesta este motivul pentru care cel mai bun protocol poate varia nu numai în funcție de tipul de probă, ci și în funcție de epitop (și de anticorp).
Tesut
Pentru țesut proaspăt congelat, secțiunile care au fost congelate și secționate prin criostat trebuie tratate acum cu fixator. Alternativ, probele de țesut pot fi conservate prin fixare mai întâi cu perfuzie transcardială sau imersie, post-fixare și etape de crioconservare, urmate de congelare și secționare.
În prelucrarea țesuturilor FFPE, țesutul este conservat prin fixare prin imersie cu formalină (sau alt fixator pe bază de aldehide) sau cu perfuzie ca mai sus, urmată de încorporare în parafină și secționare. Înainte de incubarea cu anticorpi, secțiunile trebuie să fie supuse unor etape de deparafinare, rehidratare și recuperare a antigenului pentru a permite anticorpilor să acceseze proba și să se lege de moleculele țintă.
Celule
Rezolvarea celulelor cu mediu cald fără proteine sau PBS imediat înainte de fixare poate preveni precipitarea proteinelor extracelulare și a resturilor. Fixarea rapidă se realizează prin schimbarea rapidă a mediului cu soluția de fixare.
Fixarea cu aldehidă vs. fixarea cu alcool
Fixatorii pe bază de aldehidă, cum ar fi formaldehida, formalina (un amestec de formaldehidă dizolvată cu un procent mai mic de metanol) și glutaraldehida sunt cel mai frecvent utilizați atunci când păstrarea structurii este primordială. Pentru majoritatea anticorpilor, CST recomandă fixarea cu formaldehidă 4% (fără metanol). Aldehidele reacționează cu și reticulează aminele primare ale proteinelor celulare și stabilizează proba. În plus, enzimele celulare, inclusiv fosfatazele și proteazele, sunt dezactivate prin reticulare. Aldehidele traversează membrana plasmatică și fixează proteinele solubile mai bine decât alcoolii, dar unele ținte își pot pierde antigenitatea prin reticulare aldehidică.
Fixatorii alcoolici deshidratanți/denaturanți, cum ar fi metanolul, deplasează apa din jurul macromoleculelor celulare, ceea ce duce la denaturarea și precipitarea lor in situ. Denaturarea proteinei țintă poate expune epitopi îngropați, ceea ce face ca această abordare să fie avantajoasă față de fixarea cu aldehide pentru unii anticorpi. Cu toate acestea, fixatorii de deshidratare sunt mai puțin potriviți pentru țintele solubile și pentru anticorpii specifici stării de modificare, cum ar fi fosfoanticorpii. Verificați fișa tehnică a produsului pentru metoda optimă de fixare.
Salegerea unui agent de permeabilizare
Dacă se utilizează un fixator de reticulare, membrana plasmatică va fi încă intactă, ceea ce face ca țintele intracelulare să fie inaccesibile anticorpilor. Prin urmare, permeabilizarea trebuie efectuată după fixarea prin reticulare, cu excepția cazului în care anticorpii dvs. recunosc epitopi extracelulari. Metoda optimă de permeabilizare variază în funcție de anticorp; verificați întotdeauna pagina produsului pentru protocolul recomandat.
Utilizarea permeabilizării cu Triton® X-100 după fixare este comună. Tritonul și alți detergenți, cum ar fi NP-40, TWEEN®, Saponin, Digitonin și DOTMAC, interacționează cu membranele celulare pentru a crea dimensiuni variabile ale „porilor” și a permite accesul anticorpilor.
Alternativ, permabilizarea cu alcool cu etanol sau metanol poate fi efectuată după etapa de fixare. Această metodă combină fixarea rapidă a fixatorilor de reticulare cu denaturarea intermediară a proteinelor și delipidarea membranei. Acest lucru poate îmbunătăți semnalul pentru anumite ținte, în special pentru cele asociate cu organitele sau cu citoscheletul.
Ce condiții de fixare/permanență folosesc atunci când fac multiplexare?
Dacă faceți multiplexare cu anticorpi care necesită protocoale CST diferite, este posibil să trebuiască să acordați prioritate anticorpului care trebuie utilizat în condițiile sale optime. Un exemplu de optimizare a ordinii realizată în mIHC este prezentat în această notă de aplicare (PDF). Efectuarea unui test de testare la scară mică, comparând diferite protocoale, poate fi informativă înainte de a vă extinde experimentele.
Salegerea unui reactiv de blocare
Cea mai frecventă recomandare este 5% ser normal de capră (sau ser din aceeași specie ca și anticorpul secundar) în PBS + 0,3% Triton® X-100. Verificați fișa tehnică pentru agentul de blocare recomandat.
Dacă în probă sunt prezenți receptori Fc, semnalul anticorpului va proveni dintr-un amestec de recunoaștere specifică a țintei (prin intermediul situsului de legare a antigenului/regiunea variabilă a anticorpului), precum și de absorbție nespecifică a legăturii lanțului greu al anticorpului cu receptorii Fc. IgG-ul total prezent în serul animal blochează receptorii Fc pentru a împiedica legarea anticorpilor primari și secundari și pentru a reduce zgomotul de fond. Alegerea fragmentelor F(ab’)2 conjugate cu fluorofori va evita, de asemenea, legarea receptorilor Fc pentru anticorpul secundar (dar nu și pentru anticorpul primar)
În alte aplicații pe bază de anticorpi, cum ar fi Western blotting, etapele de blocare reduc semnalul de fond cauzat de legarea nespecifică, de mai mică afinitate, a anticorpilor primari și secundari la alte situsuri decât cele ale țintei lor prevăzute. Cu toate acestea, am constatat că anticorpii monoclonali recombinați de iepure care au fost riguros testați în IF funcționează bine pe multe probe cu sau fără blocare. În cele din urmă, alegerea anticorpilor de calitate validați în imunofluorescență contribuie în mare măsură la evitarea zgomotului de fond.
Concentrația anticorpilor și raportul semnal-zgomot în IF
Raportul semnal-zgomot (S/N) este legat de specificitatea și sensibilitatea unui anticorp într-o anumită aplicație. S/N poate fi calculat prin compararea „semnalului” intensităților de fluorescență din celulele care exprimă ținta de interes cu „zgomotul de fond” al celulelor care nu o exprimă. În cazul în care anticorpul este aplicat la o concentrație prea mică, semnalul de fluorescență va fi prea slab pentru a fi distins de zgomotul de fond. Pe de altă parte, o concentrație excesiv de mare va contribui la colorarea de fond, scăzând S/N. Verificați întotdeauna fișa tehnică a produsului pentru diluția recomandată, care se bazează pe titrări efectuate în timpul validării anticorpilor.
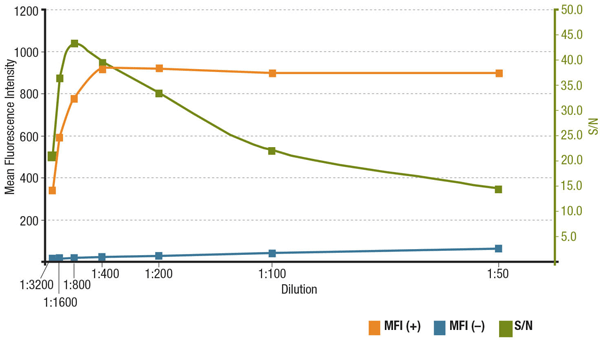
Analiză a S/N pentru MUC1 (D9O8K) XP® Rabbit mAb #14161 diluție. Cuantificarea intensității medii de fluorescență în celulele ZR-75-1 care exprimă (MFI(+), portocaliu) și în celulele HCT 116 care nu exprimă (MFI(-), albastru) și calcularea raportului S/N (verde).
Analiză a raportului S/N pentru diluția MUC1 (D9O8K) XP® Rabbit mAb #14161. Cuantificarea intensității medii de fluorescență în celulele ZR-75-1 care exprimă (MFI(+), portocaliu) și în celulele HCT 116 care nu exprimă (MFI(-), albastru) și calcularea S/N (verde).
Timp de incubare a anticorpilor
În general, incubarea peste noapte la 4°C duce la un semnal puternic. Schimbarea timpului de incubare și a temperaturii poate modifica semnalul și S/N. Diferiți anticorpi pot răspunde în mod diferit la modificarea condițiilor de incubare; pentru mai multe informații, consultați această postare pe blog.
Am nevoie de acces la un microscop confocal pentru a efectua IF?
IF se poate efectua pe orice microscop cu fluorescență cu sursă de excitație și filtrare corespunzătoare, inclusiv microscoape confocale epifluorescente, cu scanare și cu discuri rotative. Imunofluorescența este, de asemenea, în general, compatibilă cu tehnicile de fluorescență specializate, inclusiv fluorescența cu reflexie internă totală (TIRF), microscopia cu foaie de lumină și unele tehnici de super-rezoluție.
Compatibilitate cu screening-ul automatizat de mare capacitate/analiza de conținut ridicat
Care anticorp aprobat pentru IF-IC poate fi utilizat în screening-ul de mare capacitate (HCS) și analiza de conținut ridicat (HCA). Aceste experimente se bazează pe tehnici standard de IF, care încorporează automatizarea.
Întâmpinați probleme cu experimentul dvs. de IF? Faceți clic aici pentru un ghid de depanare.
Cell Signaling Technology, CST și XP sunt mărci comerciale ale Cell Signaling Technology, Inc. Toate celelalte mărci comerciale sunt proprietatea proprietarilor lor respectivi.