Introduktion
Immunofluorescens (IF) används antikroppar och fluorescerande detektion för att studera lokaliseringen, det relativa uttrycket och aktiveringstillstånden för målproteiner i fixerade celler eller vävnader. IF används i stor utsträckning inom olika studieområden.
IF kan användas för att besvara frågor som:
- Vilka celler eller vävnader uttrycker mina målproteiner?
- Hur förändras uttrycket och/eller aktiveringen av mitt målprotein som svar på experimentella störningar?
- Var i cellen/vävnaden är målproteinet lokaliserat?
- Vad är det rumsliga förhållandet mellan olika målproteiner i samband med cell- eller vävnadsarkitekturen?
Immunofluorescens omfattar ett antal besläktade tekniker som har utvecklats över tiden. Alla dessa tekniker utnyttjar den specifika identifieringen av biologiska mål genom antikroppar och detektering av fluorescerande rapportörer i cytometrisk analys. Det är viktigt att se till att det biologiska provet är välbevarat samtidigt som målantigenerna är tillgängliga för antikropparna, men det kan innebära utmaningar som varierar beroende på provet, målet och antikroppen.
På den här sidan har vi sammanställt resurser för att hjälpa dig att navigera i protokollen, svara på vanliga frågor och hjälpa dig att utforma framgångsrika IF-experiment.
Välja rätt IF-teknik och protokoll
Den optimala IF-tekniken/protokollet påverkas av typen av biologiskt material, provbehandlingsstegen, egenskaperna hos målantigenet och den särskilda antikropp som används.
Tillsynen omfattar:
- Inputmaterial kan vara odlade cellinjer, fryst vävnad eller formalinfixerad, paraffinininbäddad (FFPE) vävnad.
- För odlade cellinjer och primära celler, leta efter antikroppar som är validerade för immunofluorescens-immunocytokemi (IF-IC).
- I många laboratorier används ”immunohistokemi/IHC” som ett samlingsbegrepp för att inkludera vävnad som antingen är paraffininbäddad eller fryst, och kan användas för att inkludera både kromogen och fluorescerande detektion. På cellsignal.com skiljer tillämpningarna mellan frysta (IF-F) och paraffininbäddade vävnadspreparat.
- För FFPE-vävnadsprover kan antikroppar som validerats för immunohistokemi (IHC-P) också användas med fluorescerande detektion utan förstärkning om målantigenet är rikligt förekommande, eller i multiplexed IHC (mIHC) med signalförstärkning.
- En antikropp kan vara validerad för en eller flera av de tillämpningar som anges ovan. Protokollrekommendationerna är resultatet av tester av forskare under valideringsprocessen.
- Produktspecifika protokoll finns på varje produkts webbsida. För IF-validerade antikroppar, välj ”IF” på produktsidan för att visa IF-valideringsdata och protokoll. Grundläggande information (utspädning/arbetskoncentration, validerade tillämpningar, artreaktivitet, värdart) för varje antikropp finns i produktdatabladet.
- De vanligaste IF-protokollen finns också på protokollsidan.
- Behövs eller vill du inte använda fluorescensdetektion för dina vävnadsprover? Ett alternativt tillvägagångssätt är kromogen detektion, som behandlas på IHC-sidan.
Väljning av antikroppar för IF: vikten av antikroppsvalidering
De bästa antikropparna ger en stark, specifik signal med minimal bakgrund. Det är viktigt att välja antikroppar som har validerats i den applikation du ska använda. Validering av antikroppar i IF kan inkludera positiva och negativa uttrycksexperiment (med hjälp av knockout-cellinjer, genetiska modeller, CRISPR eller RNAi), experimentell manipulation av målproteinets lokalisering eller posttranslationella modifieringar samt protokolloptimering.
Prestationen hos en antikropp varierar beroende på tillämpning. En antikropp som till exempel presterar bra i ett western blot-experiment kan eller kan inte prestera i IF. Vid testning av nya antikroppar kommer vissa att uppvisa en mindre off-target-bindning; dessa rekommenderas aldrig för IF eller andra icke-WB-tillämpningar. Dessutom kan en antikropp fungera bra på fryst vävnad men inte på FFPE-vävnad, eller vice versa. Antikropparnas känslighet och prestanda kan förändras beroende på hur provet fixeras och bearbetas och på antikropparnas arbetsförhållanden.
När du har bestämt dig för vilken typ av biologiska prover som ska användas i ditt experiment och hur de ska förberedas, är det enklaste sättet att bläddra bland antikropparna på cellsignal.com att först välja lämplig tillämpning. Därefter kan du ange söktermer eller välja andra attribut (t.ex. värdart, forskningsområde m.m.) för att ytterligare förfina din sökning och välja en antikropp som har validerats i den applikation du behöver.
Utforma kontrollexperiment för IF
För att vara säker på din experimentella utformning och dina resultat, och på att din antikropp rapporterar sitt mål på ett trovärdigt sätt, kan positiva och negativa kontrollexperiment vara informativa. Till exempel:
- Enbart sekundära kontroller kan tala om för dig om det finns ospecifik bindning av sekundär antikropp.
- Bekräfta specificiteten hos en primär antikropp genom att utforma Knockout/siRNA-experiment eller genom att jämföra kända exprimerande och icke-uttryckande cellinjer.
- Enkla målexperiment används för att ställa in spektral oblandning av avbildning. Denna typ av experiment kan hjälpa till att avgöra om en brist på färgning beror på steriskt hinder som uppstår när två antigener befinner sig nära varandra.
- Behandla prover med fosfatas för att bekräfta att fosfospecifika antikroppar endast känner igen det fosforylerade målet i IF.
- Om du misstänker problem med fixering eller permeabilisering kan en kontroll med en antikropp som tidigare har fungerat för ditt labb vara till hjälp vid felsökning.
Vetenskapsmän från Cell Signaling Technology (CST) utför rutinmässigt dessa typer av kontroller som en del av vår valideringsprocess (se ett exempel). Det kan vara värt att sätta upp liknande kontroller i ditt experimentella modellsystem, särskilt om du har svårt att få de resultat du vill ha.
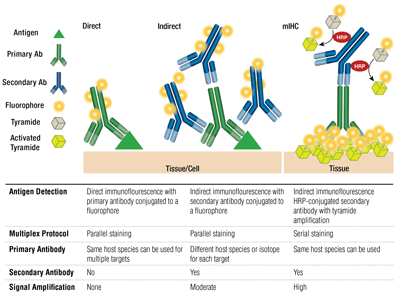
Primära vs sekundära antikroppar och direkt vs indirekt färgning
Primära antikroppar ger specifik igenkänning av målantigenet. Sekundära antikroppar binder till primära antikroppar baserat på den art de uppföddes på. Primära antikroppar som har framställts i kanin eller mus kan detekteras med sekundära antikroppar mot kanin eller mus.
Parningen av en primär antikropp och en sekundär antikropp (som är specifik för den primära antikroppens värddjursspecifika art) som är konjugerad till en fluorofor är känd som indirekt färgning. Användning av primära antikroppar som är konjugerade till fluoroforer, utan sekundära antikroppar, kallas direkt färgning. Direkta färgningsmetoder sparar tid och möjliggör multiplexering med hjälp av antikroppar från samma värdart. Indirekt färgning ger traditionellt sett högre känslighet tack vare den signalförstärkning som sker när flera sekundära antikroppar binder till en enda primär antikropp.
Det finns andra variationer av dessa tekniker, t.ex. användning av biotinylerade primära antikroppar med avidin/streptavidin-konjugerade fluorokromer. Fluoroforkonjugerade F(ab’)2-fragment av sekundära antikroppar (som saknar Fc-domänen) kan bidra till att minska bakgrunden. Vid mIHC används pepparrotsperoxidas (HRP)-konjugerade sekundära antikroppar för att katalysera deponering av tyramid-fluoroforkonjugat.
Väljning av antikroppar fluoroforer
Väljning av antikroppar fluoroforer
Hur många mål/antikroppar kan multiplexeras?
Multiplexering innebär att man upptäcker mer än ett mål åt gången med hjälp av flera antikroppar och att man upptäcker olika våglängder (färger) för varje mål. För indirekt färgning bygger förmågan till multiplexering på parning av fluorforkonjugerade, artspecifika sekundära antikroppar till varje primär antikropp. Musantikroppar från olika isotyper kan också multiplexeras med hjälp av isotypspecifika sekundära antikroppar, vilket gör det möjligt att detektera upp till fem musantikroppar samtidigt. För direkt färgning bör varje primär antikropp kopplas till en annan fluorofor. Detta gör det möjligt att kombinera flera antikroppar från samma art/isotyp och även möjliggöra ”mus-till-mus”-färgning, eftersom ospecifik bindning av sekundära antikroppar från mus till musvävnad inte är något problem.
När man utformar multiplexa IF-experiment bör fluorescensmikroskopets spektrala egenskaper, inklusive tillgängliga excitationskällor och filtreringsuppsättningar, beaktas för att undvika spektral blödning. Moderna epifluorescerande och konfokala fluorescensmikroskop har vanligtvis möjlighet att skilja 3 eller fler kanaler.
Kombinera antikroppsfärgning med färgämnen eller taggar
Cellulära färgämnen som appliceras efter fixering eller fixerbara etiketter för levande celler kan införlivas i ett IF-arbetsflöde. Organellmärkning används ofta för att verifiera subcellulär lokalisering av ett mål. Uttryckta etiketter, t.ex. GFP, används ofta för att spåra transfekterade celler eller i mosaikexperiment; om GFP-fluorescenssignalen är låg kan en anti-GFP-antikropp användas i IF. Användning av färgämnen eller fluorescerande proteiner kommer att uppta fluorescenskanaler, vilket gör att det blir mindre tillgängligt för antikroppar.
Väljning av fluoroforer för ditt experiment
Detta beror på spektralegenskaperna hos excitationskällan och exciterings-/emissionsfiltreringen som du har tillgång till. Utvärdera excitations- och emissionsprofilen för fluoroforen innan du utför ditt experiment för att undvika att fluorescens blöder igenom. CST erbjuder en mängd fluorforkonjugerade primära och sekundära antikroppar, inklusive färgämnen i Alexa Fluor®-serien.
Provberedning
Vävnad
Vävnadssektioner kan förberedas antingen genom snabbfrysning i medium med optimal skärningstemperatur (OCT) eller genom fixering och inbäddning i paraffin. Frysta prover kan sektioneras med hjälp av en kryostat och tillåtas lufttorka på objektglaset 10 till 15 minuter före fixering före nästa steg. För FFPE-vävnadsprover kan kraven för stegen för uttag, fixering och inbäddning i paraffin variera beroende på den enskilda vävnadstypen.
Frusen vs FFPE-vävnad
I allmänhet ger FFPE-vävnad bättre morfologi än OCT-inbäddad frusen vävnad. Detta kan göra det lättare att kvantifiera positiva celler eller identifiera gränser mellan fläckar. FFPE-vävnad är också mycket stabil; när de väl är inbäddade kan vävnadsblock förvaras i flera år. Denna typ av vävnad är också lättare att skicka mellan laboratorier, och det är den föredragna bearbetningsmetoden för humanpatologiska prover.
Å andra sidan genomgår FFPE-vävnad flera extra bearbetningssteg som minskar den totala mängden antigen på grund av proteinnedbrytning, kräver avmaskningssteg för att detektera kvarvarande antigen och förvärrar aldehydinducerad autofluorescens. Om man inte arbetar med ett mycket rikligt protein kan det återstående antigenet vara svårt att detektera med indirekt IF och kan kräva amplifiering för att ge en lämplig färgning. Det är också möjligt att antigenåtervinning kan avslöja antigener som normalt inte skulle upptäckas och att en antikropp som annars ger det förväntade färgningsmönstret kan ge ospecifik färgning. Det är lika möjligt att arbeta med en måltavla där det krävs en specifik metod för antigenhämtning för att upptäcka målets epitop. Därför är det viktigt att överväga hur en antikropp valideras och vilka steg som krävs för att använda den.
I fallet med OCT-inbäddad frusen vävnad prioriteras reducering av bearbetning framför morfologi. Detta är den snabbaste metoden för att erhålla immunfärgningsresultat, eftersom objektglasen är färdiga för användning i samma ögonblick som vävnaden skärs upp och det finns färre bearbetningssteg före inbäddning. Det sker mindre proteinnedbrytning och mer antigen finns tillgängligt för att binda antikroppar utan att det krävs några ytterligare, hårda steg för att ta fram antikroppar. Eftersom denna metod inte kräver förstärkning är den känsligare för vävnadskvalitet. Fixeringstyp (alkohol vs. aldehyd), varaktighet (vissa mål, t.ex. transkriptionsfaktorer, kräver kortare fixeringstid) och vävnadsålder (särskilt efter sektionering) är alla viktiga och varierar beroende på mål. Slutligen ger arbete med fryst vävnad större flexibilitet vid val av mål, eftersom bearbetning kan ske efter sektionering, vilket möjliggör större anpassning vid utformning av analyser.
Kulturerade celler
Celler måste sås på ett stödmaterial som är kompatibelt med fluorescensmikroskopi. Typiska stöd inkluderar cellodlingsskålar med glasbotten, täckglas (som förvaras i plastodlingsskålar) preparerade med polylysin och/eller extracellulära matriskomponenter för att stödja adherent cellodling och kommersiellt tillgängliga multiwellkammare monterade på glasobjektiv som är kompatibla med mikroskop.
Bemärk att cellodlingsförhållandena kan påverka cellhälsan, morfologin och uttrycket/lokaliseringen av ditt målprotein och i slutändan diktera kvaliteten på dina IF-data. Se till att dina celler är friska genom att regelbundet kontrollera kulturmediet för pH-förändringar och inspektera för tecken på cellstress (t.ex. flerkärniga celler) vid låg förstoring i ett mikroskop. Kontrollera också att cellernas konfluens är lämplig för celltypen och målet.
Provsfixering
Det ideala fixeringsmedlet bevarar en ”livliknande” ögonblicksbild samtidigt som det snabbt stoppar den nedbrytande processen av autolys genom att tvärbinda och hämma endogena enzymer och det presenterar antigenet för igenkänning av antikroppen. Tyvärr finns det inte en enda fixeringsmetod som fungerar idealiskt på alla prover och för alla antigener. Även olika antigener på samma målprotein kan uppvisa skillnader mellan olika protokoll. Därför kan det bästa protokollet inte bara variera beroende på provtyp utan även beroende på epitop (och antikropp).
Vävnad
För färskfryst vävnad ska sektioner som har frysts och kryostatsektionerats nu behandlas med fixeringsmedel. Alternativt kan vävnadsprover bevaras genom fixering först med transkardiell perfusion eller nedsänkning, steg för postfixering och kryokonservering, följt av frysning och sektionering.
I FFPE-vävnadsbearbetning bevaras vävnad genom nedsänkning fixering med formalin (eller annat aldehydbaserat fixeringsmedel) eller med perfusion enligt ovan, följt av inbäddning i paraffin och sektionering. Före inkubation med antikropp måste sektionerna genomgå deparaffinering, rehydrering och antigenåtervinning för att antikropparna ska kunna komma åt provet och binda målmolekylerna.
Celler
Sköljning av cellerna med varmt proteinfritt medium eller PBS omedelbart före fixering kan förhindra utfällning av extracellulärt protein och skräp. Snabb fixering åstadkoms genom att snabbt byta ut media mot fixeringslösning.
Aldehydfixering vs alkoholfixering
Aldehydbaserade fixeringsmedel som formaldehyd, formalin (en blandning av upplöst formaldehyd med en lägre procentandel metanol) och glutaraldehyd används oftast när bevarandet av strukturen är av största vikt. För de flesta antikroppar rekommenderar CST fixering med 4 % formaldehyd (metanolfri). Aldehyder reagerar med och tvärbinder de primära aminerna i cellulära proteiner och stabiliserar provet. Dessutom inaktiveras cellulära enzymer, inklusive fosfataser och proteaser, av tvärbindningen. Aldehyder korsar plasmamembranet och fixerar lösliga proteiner bättre än alkoholer, men vissa mål kan förlora sin antigenicitet med aldehydkorsbindning.
Dehydrerande/denaturerande alkoholfixeringsmedel, t.ex. metanol, tränger undan vatten runt cellulära makromolekyler, vilket resulterar i denaturering och utfällning av dem in situ. Denaturering av målproteinet kan exponera begravda epitoper, vilket gör detta tillvägagångssätt fördelaktigt jämfört med aldehydfixering för vissa antikroppar. Dehydrerande fixeringsmedel är dock mindre lämpliga för lösliga mål och modifieringstillståndsspecifika antikroppar, t.ex. fosfo-antikroppar. Kontrollera produktens datablad för optimal fixeringsmetod.
Väljning av permeabiliserande medel
Om ett tvärbindande fixeringsmedel används kommer plasmamembranet fortfarande att vara intakt, vilket gör intracellulära mål otillgängliga för antikroppar. Därför bör permeabilisering utföras efter tvärbindande fixering om inte dina antikroppar känner igen extracellulära epitoper. Den optimala permeabiliseringsmetoden varierar beroende på antikroppen; kontrollera alltid produktsidan för rekommenderat protokoll.
Användning av Triton® X-100 permeabilisering efter fixering är vanligt. Triton och andra detergenter, såsom NP-40, TWEEN®, Saponin, Digitonin och DOTMAC, interagerar med cellmembran för att skapa variabla ”porstorlekar” och möjliggöra tillgång till antikroppar.
Alternativt kan alkoholpermeabilisering med etanol eller metanol utföras efter fixeringssteget. Denna metod kombinerar den snabba fixeringen av tvärbindande fixeringsmedel med en mellanliggande denaturering av proteiner och delipidering av membranen. Detta kan förbättra signalen för vissa mål, särskilt de som är associerade med organeller eller cytoskelettet.
Vilka fixerings-/permabiliseringsbetingelser använder jag vid multiplexering?
Om du multiplexerar med antikroppar som kräver olika CST-protokoll kan du behöva prioritera vilken antikropp som ska användas vid dess optimala förhållanden. Ett exempel på orderoptimering som utförs i mIHC visas i den här applikationsnoten (PDF). Att utföra en testkörning i liten skala där olika protokoll jämförs kan vara informativt innan du skalar upp dina experiment.
Väljning av blockeringsreagens
Den vanligaste rekommendationen är 5 % normalt getserum (eller serum från samma art som den sekundära antikroppen) i PBS + 0,3 % Triton® X-100. Kontrollera databladet för rekommenderat blockeringsmedel.
Om Fc-receptorer finns i provet kommer antikroppssignalen att komma från en blandning av specifik måligenkänning (via antikroppens antigenbindningsställe/variabla region) samt icke-specifik absorption av antikroppens tunga kedja som binder till Fc-receptorer. Det totala IgG som finns i djurserum blockerar Fc-receptorer för att förhindra bindning av primära och sekundära antikroppar och minska bakgrundsbruset. Genom att välja fluorforkonjugerade F(ab’)2-fragment undviks också Fc-receptorbindning för den sekundära antikroppen (men inte för den primära antikroppen)
I andra antikroppsbaserade tillämpningar, t.ex. västerblotting, reducerar blockeringsstegen bakgrundssignalen som orsakas av ospecifik bindning med lägre affinitet av primära och sekundära antikroppar till andra ställen än deras avsedda mål. Vi har dock funnit att rekombinanta monoklonala antikroppar av kanin som har testats rigoröst i IF fungerar bra på många prover med eller utan blockering. I slutändan är det viktigt att välja kvalitetsantikroppar som validerats i immunofluorescens för att undvika bakgrundsbrus.
Antikroppskoncentration och signal-brusförhållande i IF
Signal-brusförhållandet (S/N) är relaterat till en antikropps specificitet och känslighet i en viss tillämpning. S/N kan beräknas genom att jämföra ”signalen” av fluorescensintensiteter i celler som uttrycker det aktuella målet med ”bakgrundsbruset” i celler som saknar uttryck. Om antikroppen appliceras i för låg koncentration kommer fluorescenssignalen att vara för svag för att kunna särskiljas från bakgrundsbruset. Å andra sidan kommer en alltför hög koncentration att bidra till bakgrundsfärgning, vilket minskar S/N. Kontrollera alltid produktdatabladet för rekommenderad utspädning, som är baserad på titreringar som utförts under antikroppsvalidering.
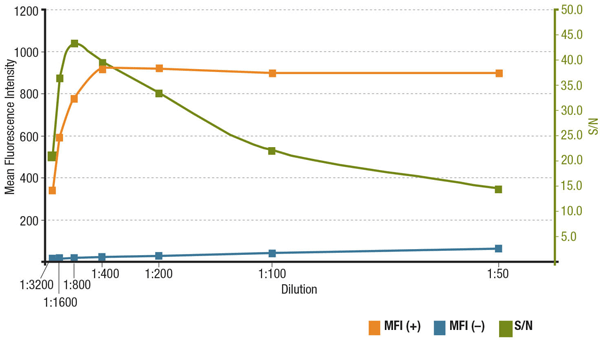
Analys av S/N för MUC1 (D9O8K) XP® Rabbit mAb #14161 utspädning. Kvantifiering av genomsnittlig fluorescensintensitet i ZR-75-1-celler som uttrycker (MFI(+), orange) och HCT 116-celler som inte uttrycker (MFI(-), blå) samt beräknat S/N (grönt).
Analys av S/N för MUC1 (D9O8K) XP® Rabbit mAb #14161 spädning. Kvantifiering av genomsnittlig fluorescensintensitet i uttryckande (MFI(+), orange) ZR-75-1-celler och icke-uttryckande (MFI(-), blå) HCT 116-celler, och beräknat S/N (grönt).
Inkubationstid för antikropparna
Inallmänt resulterar inkubation över natten i 4 °C i en stark signal. Ändring av inkubationstid och temperatur kan förändra signal och S/N. Olika antikroppar kan reagera olika på ändrade inkubationsförhållanden; för mer information, se det här blogginlägget.
Behövs det tillgång till ett konfokalmikroskop för att utföra IF?
IF kan utföras på vilket fluorescensmikroskop som helst med lämplig exciteringskälla och filtrering, inklusive epifluorescerande, skanande och snurrande disk-konfokalmikroskop. Immunofluorescens är också i allmänhet kompatibel med specialiserade fluorescenstekniker, inklusive total intern reflektionsfluorescens (TIRF), ljusplattmikroskopi och vissa superupplösningstekniker.
Kompatibilitet med automatiserad screening med hög genomströmning/analys med högt innehåll
Alla antikroppar som är godkända för IF-IC kan användas vid screening med hög genomströmning (HCS) och analys med högt innehåll (HCA). Dessa experiment är baserade på standard IF-tekniker som innehåller automatisering.
Har du stött på problem med ditt IF-experiment? Klicka här för en felsökningsguide.
Cell Signaling Technology, CST och XP är varumärken som tillhör Cell Signaling Technology, Inc. Alla andra varumärken tillhör respektive ägare.