I början av den organiska kemin beskrevs alkener som ”omättade” eftersom de, i motsats till de ”mättade” alkanerna, visade sig reagera lätt med substanser som halogener, vätehalogenider, oxiderande ämnen och så vidare. Därför ansågs alkenernas ”kemiska affinitet” vara otillfredsställd eller ”omättad”. (Se även avsnitt 1-1I.)
En anledning till att alkener och alkyner reagerar lättare än alkaner är att kol-kol-bindningarna i en multipelbindning är individuellt svagare än normala kol-kol enkelbindningar. Tänk på de inblandade bindningsenergierna. Enligt tabell 4-3 är styrkan hos kol-kol- enkel-, dubbel- och trippelbindningar \(83\), \(146\) respektive \(200 \: \text{kcal}\). Från dessa värden kan vi beräkna att klyvning av hälften av en kol-kol dubbelbindning bör kräva \(63 \: \text{kcal}\) och klyvning av en tredjedel av en kol-kol trippelbindning bör kräva \(54 \: \text{kcal}\):

Som en följd av detta förväntas additionsreaktioner till multipla bindningar vara ungefär \(20\)-\(30 \: \text{kcal}\) mer exotermiska än motsvarande klyvningsreaktioner av kol-kol enkelbindningar, vilket uppskattas här för reaktion med brom:
Den avsevärda skillnaden i reaktionsvärme för etan, ethen och etyne med brom återspeglas i ett mycket viktigt praktiskt övervägande vid hantering av etyne (acetylen), nämligen dess termodynamiska stabilitet i förhållande till fast kol och vätegas. Till skillnad från etan kan både eten och etyn visas utifrån bindningsenergier vara instabila med avseende på bildning av fast kol och gasformigt väte:
Och även om detta inte tycks innebära några särskilda problem med eten, kan en explosiv sönderdelning av etyn till kol och väte inträffa om gasen komprimeras till \(10\)-\(20 \: \text{kg cm}^{-2}\). Även flytande etan (bp \sim 83^\text{o}\)) måste hanteras med försiktighet. Etyne används inte kommersiellt under tryck om det inte blandas med en inert gas och hanteras i robust utrustning. Etyne brinner med rent syre och ger en mycket varm låga som ofta används för svetsning. För detta ändamål löses gasen under ca \(15 \(15 \text: \text{kg cm}^{-2}\) i 2-propanon (aceton, 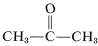 , bp \(56,5^\text{o}\)) och innesluts i flaskor packade med kiselgur.
, bp \(56,5^\text{o}\)) och innesluts i flaskor packade med kiselgur.
Varför är etan så mycket mindre stabilt än eten eller etan? För det första är \(\ce{C-C}\) bindningar inte lika starka som \(\ce{C-H}\) bindningar. Därför kan man vanligtvis förvänta sig en ökad stabilitet när \(\ce{C-H}\) bindningar görs på bekostnad av \(\ce{C-C}\) bindningar; ethen och etan har vardera fler \(\ce{C-H}\) bindningar än vad ethen har. För det andra har etan sex elektroner mellan de två kolvätena och dessa elektroner upplever en betydande ömsesidig interelektronisk repulsion. Detta förklarar det faktum att den genomsnittliga bindningsstyrkan \(\ce{C-C}\) för trippelbindningen i ett alkin är \(200/3 = 67: \text{kcal}\), jämfört med \(146/2 = 73: \text{kcal}\) för dubbelbindningen i ett alken och \(83 \text{kcal}\) för en normal enkelbindning i ett alkan.
- John D. Robert och Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, andra upplagan. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Detta innehåll är upphovsrättsligt skyddat enligt följande villkor: ”Du beviljas tillstånd för individuell, pedagogisk, forskningsmässig och icke-kommersiell reproduktion, distribution, visning och framförande av detta verk i vilket format som helst.”